- 1013.00 KB
- 2021-04-16 发布
www.ks5u.com
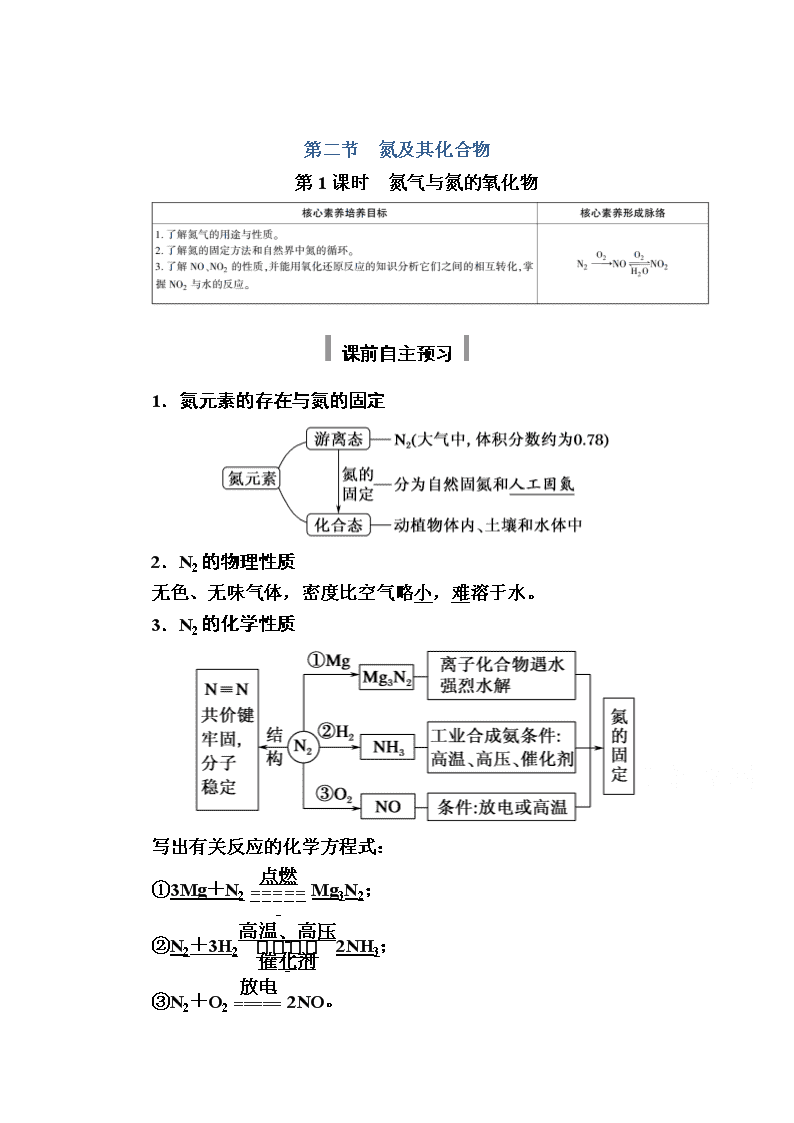
第二节 氮及其化合物
第1课时 氮气与氮的氧化物
课前自主预习
1.氮元素的存在与氮的固定
2.N2的物理性质
无色、无味气体,密度比空气略小,难溶于水。
3.N2的化学性质
写出有关反应的化学方程式:
①3Mg+N2Mg3N2;
②N2+3H22NH3;
③N2+O22NO。
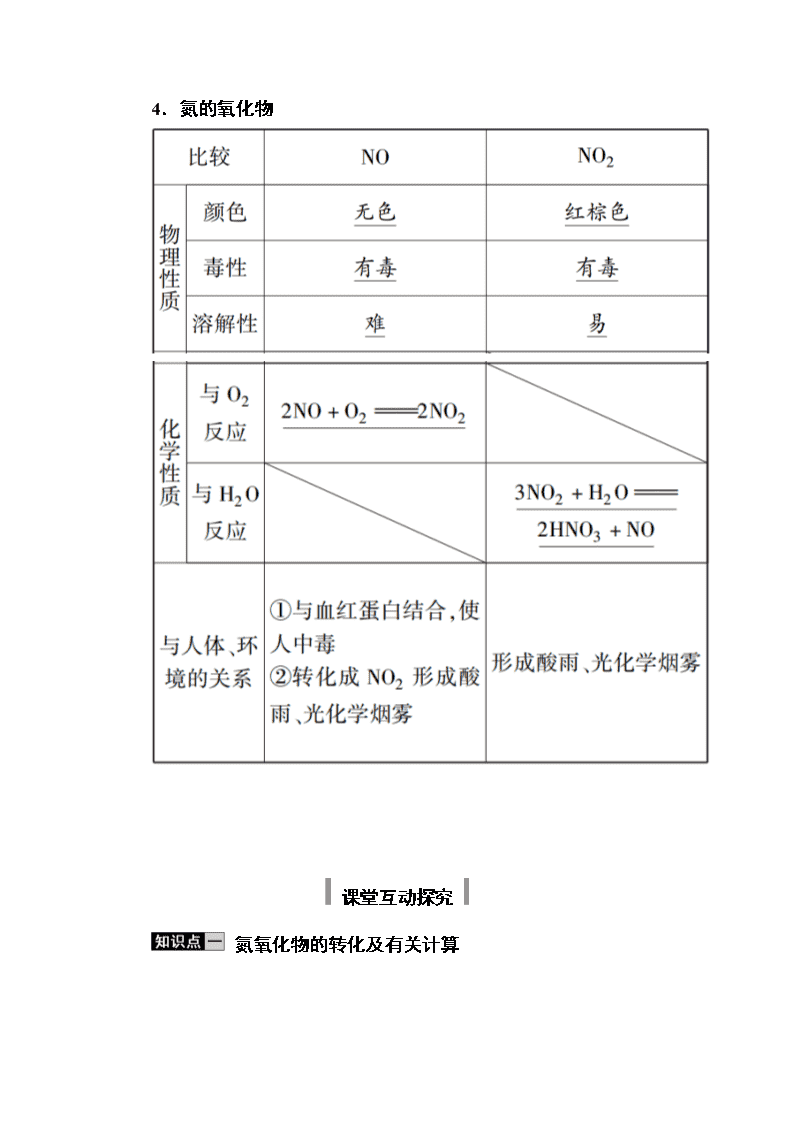
4.氮的氧化物
课堂互动探究
氮氧化物的转化及有关计算
1.NO→NO2
NO具有还原性,能与氧气反应生成二氧化氮,反应方程式为2NO+O2===2NO2,将盛有一氧化氮气体的试剂瓶的瓶塞打开,会发现瓶口变红棕色。
2.NO2→NO
二氧化氮易溶于水且能与水反应生成一氧化氮。
(1)反应的化学方程式为3NO2+H2O===2HNO3+NO
(2)反应现象:反应后气体体积减少为原来的三分之一,气体颜色由红棕色变为无色。
(3)反应特点:反应中的二氧化氮既是氧化剂又是还原剂,每3 mol二氧化氮参加反应转移2 mol电子。二氧化氮不是酸性氧化物。
(4)有关计算:
NO2(NO2与N2的混合气体)溶于水时,可根据反应3NO2+H2O===2HNO3+NO,利用气体体积的变化差值进行计算。
例:氮气和二氧化氮混合气体20 mL通入水中,气体的体积缩小为16 mL,则原混合气体中二氧化氮的体积V可通过以下关系求得:
氮的氧化物溶于水的有关计算
氮的氧化物溶于水的几种情况
(1)NO2或NO2与N2(非O2)的混合气体溶于水
根据3NO2+H2O===2HNO3+NO ①
利用气体体积变化差值进行计算。
(2)NO2和O2的混合气体溶于水
根据4NO2+O2+2H2O===4HNO3 ②
可知:当体积比
(3)NO和O2的混合气体溶于水
根据4NO+3O2+2H2O===4HNO3 ③
可知:当体积比
(4)NO、NO2、O2三种混合气体通入水中
可先按①式求出NO2和H2O反应后生成的NO的体积,再加上原混合气体中NO的体积,即为NO的总体积,再按③式进行计算。
(5)无论是4NO2+O2混合,还是4NO+3O2混合,均可看成是2N2O5,这是实质,即利用N、O原子个数比进行分析推断。
(6)电子守恒法
当NO2或NO转化为HNO3时要失去电子,若上述两种气体与O2混合,O2得电子,且得失电子总数必然相等,这是解题的依据。
典例题组训练
题组一 氮在自然界中的循环
1.(双选)下列关于自然界中氮循环(如图所示)的说法不正确的是( AD )
A.氮元素均被氧化
B.工业合成氨属于人工固氮
C.含氮无机物和含氮有机物可相互转化
D.只有碳、氢二种元素参与了氮循环
解析:人工固氮中氮气转化为氨气,N化合价由0→-3价,化合价降低,被还原,故A错误;工业合成氨是典型的人工固氮方法,故B正确;根据图像知,通过生物体可以将铵盐和蛋白质相互转化,实现了含氮的无机物和有机物的转化,故C正确;生物体合成蛋白质的过程有碳、氢、氧三种元素的参与,故D错误。
2.雷雨发庄稼,解释其科学原理,并写出相关化学方程式。
答案:空气中的氮气和氧气在放电条件下生成一氧化氮,一氧化氮再和氧气反应,生成二氧化氮,二氧化氮和水反应生成硝酸,硝酸与土壤中矿物质作用形成可溶性硝酸盐,成为氮肥被植物吸收,所以有利于庄稼生长。
相关化学方程式:N2+O22NO,2NO+O2===2NO2,3NO2+H
2O===2HNO3+NO。
题组二 氮的氧化物
3.(双选)下列关于NO和NO2的叙述正确的是( AC )
A.NO2是一种红棕色气体
B.常温常压下,NO不能与空气中的氧气直接化合
C.含等质量的氧元素的NO和CO的物质的量相等
D.NO2可用排水法收集
解析:解答本题要抓住NO易被氧化、NO2易与水反应的特点。NO2是红棕色的气体,A正确。常温常压下,NO易与空气中的氧气直接化合生成NO2,B错误。NO2能与水反应,故不能用排水法收集,D错误。
4.NO2溶于水时,与水发生氧化还原反应,该反应中氧化剂和还原剂的物质的量之比是( B )
A.21 B.12 C.31 D.13
解析:NO2与H2O的反应中,NO2既作氧化剂又作还原剂:
根据得失电子守恒,n(氧化剂)n(还原剂)=12。
(1)NO和NO2都是有毒气体,NO的中毒原理同CO。
(2)收集NO时不能用排气法,应用排水法,收集NO2时,不能用排水法。
题组三 氮的氧化物、氧气与水的反应
5.将盛有10 mL NO和NO2混合气体的试管倒立于盛满水的水槽中,再通入4 mL O2,充分反应后,整个试管充满水。则原混合气体中NO与NO2体积比为( C )
A.12 B.25 C.37 D.无法确定
解析:设10 mL NO和NO2的混合气体中有a mL NO和(10-a) mL NO2,根据4NO+3O2+2H2O===4HNO3和4NO2+O2+2H2O
===4HNO3可得:a+=4,所以a=3,V(NO)V(NO2)=37。
6.如图所示,试管中盛装的是红棕色气体,当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中水柱继续上升,经过多次重复后,试管被水充满,原来试管中盛装的气体是( D )
A.肯定是NO2气体
B.肯定是O2与NO2的混合气体
C.肯定是NO气体
D.可能是NO与NO2的混合气体
解析:由气体“红棕色”推测肯定含有NO2,与水反应后生成物有NO,由“向试管内鼓入氧气多次后,试管被水充满”,则试管中原来可能还含有NO或含有O2。由4NO2+O2+2H2O===
4HNO3,4NO+3O2+2H2O===4HNO3这两个方程式进行判断,可能是NO与NO2的混合气体;若是O2与NO2的混合气体,当O2过量,试管就不可能被水充满,因此,原试管中可能情况之一是O2与NO2
的混合气体且O2不过量。
(1)要明确试题要求,如反应后容器内是否有剩余气体?剩余气体可能是什么?注意剩余气体不可能是NO2,也不可能是NO与O2的混合气体。
(2)计算中可能用到的化学反应:
3NO2+H2O===2HNO3+NO
4NO2+O2+2H2O===4HNO3
4NO+3O2+2H2O===4HNO3,(3)要对试题中产生的结果进行可能情况的讨论,如NO2与O2的混合气体溶于水时,剩余的气体是NO还是O2要进行讨论。
核心素养
氮氧化物与O2、H2O反应的计算
(1)关系式法
①NO和O2通入水中
由2NO+O2===2NO2和3NO2+H2O===2HNO3+NO得总反应为4NO+3O2+2H2O===4HNO3
②NO2和O2混合气体通入水中
由3NO2+H2O===2HNO3+NO和2NO+O2===2NO2得总反应为4NO2+O2+2H2O===4HNO3
③NO、NO2和O2三种气体通入水中
先按3NO2+H2O===2HNO3+NO计算出生成的NO体积,然后加上原来混合气体中NO体积,再按①计算。
(2)电子守恒法
当NOx转化为硝酸时要失去电子,如果是NOx与O2混合,则反应中O2得到的电子数与NOx失去的电子数相等。
【例1】 (双选)在一定条件下,将NO2和O2的混合气体12 mL通入足量水中,充分反应后剩余2 mL气体(同温同压下),则原混合气体中氧气的体积为( )
A.1.2 mL B.2.4 mL C.3 mL D.4 mL
【解析】 4NO2+O2+2H2O===4HNO3
若剩余的气体是O2,则V(NO2)=×(12-2) mL=8 mL,V(O2)=12 mL-8 mL=4 mL。
若剩余的气体是NO(2 mL)⇒6 mL NO2。
则V(O2)=×(12-6) mL=1.2 mL。
【答案】 AD
【例2】 将相同条件下的m体积NO和n体积O2同时通入倒立于水槽中且盛满水的试管内,充分反应后,试管内残留
体积的气体,该气体与空气接触后立即变为红棕色。则m与n的比值为( )
A.32 B.23 C.83 D.38
【解析】 该过程中涉及的反应有2NO+O2===2NO2、3NO2+H2O===2HNO3+NO,可将两个方程式“合并”为4NO+3O2+2H2O===4HNO3。剩余气体与空气接触立即变为红棕色,说明剩余气体为NO。则可知体积的NO气体与n体积的O2恰好完全反应。
4NO+3O2+2H2O===4HNO3
4 3
n
4=3n,解得mn=83。
【答案】 C
相关文档
- 2016年辽宁省东北育才学校高中部高2021-04-16 23:10:3412页
- 高中生工厂社会实践报告范文2021-04-16 23:09:185页
- 高中化学选修5人教版同步练习及测2021-04-16 23:08:302页
- 北京市高中物理 电磁感应 05 电磁2021-04-16 23:07:505页
- 高中数学必修1人教A同步练习试题及2021-04-16 23:04:203页
- 精编高中军训动员会领导发言稿(四)2021-04-16 23:02:2210页
- 安徽省芜湖市示范高中2020届高三下2021-04-16 23:01:5624页
- 2020高中物理 第3、4章 原子核与放2021-04-16 23:01:516页
- 2020年高中语文第四单元铁肩担道义2021-04-16 23:01:1724页
- 2020_2021学年高中历史第四单元近2021-04-16 22:58:1911页