- 711.75 KB
- 2021-04-16 发布
重庆市七校2019-2020学年
高一上学期期末联考化学试题
考试说明:1.考试时间90分钟
2.试题总分100分
3.试卷页数8页
可能用到的相对原子质量: H-1 C-12 N-14 O-16 S-32 Cl-35.5 Na-23 Fe-56 Mg-24
第一部分(选择题共48分)
本部分包括16个小题,每小题只有一个正确选项,每小题3分,共48分。
1.现如今,许多城市开始实施垃圾分类,其中可回收物主要包括废纸、塑料、玻璃、金属和布料五大类。下列属于可回收物标志的是( )
2.合金是一类用途广泛的金属材料。下列物质中,不属于合金的是( )
A.生铁 B.不锈钢 C.赤铁矿 D.硬铝
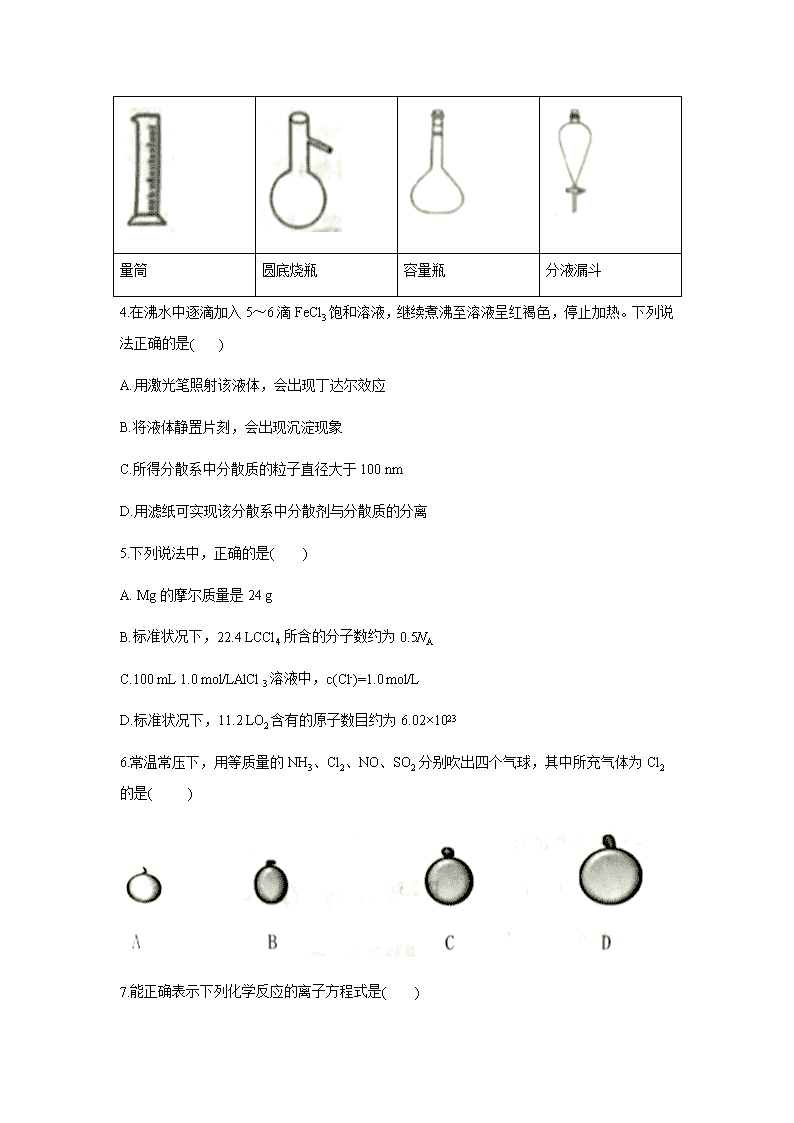
3.下列仪器名称不正确的是( )
A
B
C
D
量筒
圆底烧瓶
容量瓶
分液漏斗
4.在沸水中逐滴加入5~6滴 FeCl3饱和溶液,继续煮沸至溶液呈红褐色,停止加热。下列说法正确的是( )
A.用激光笔照射该液体,会出现丁达尔效应
B.将液体静置片刻,会出现沉淀现象
C.所得分散系中分散质的粒子直径大于100 nm
D.用滤纸可实现该分散系中分散剂与分散质的分离
5.下列说法中,正确的是( )
A. Mg的摩尔质量是24 g
B.标准状况下,22.4 LCCl4 所含的分子数约为0.5NA
C.100 mL 1.0 mol/LAlCl3溶液中,c(Cl-)=1.0 mol/L
D.标准状况下,11.2 LO2含有的原子数目约为6.02×1023
6.常温常压下,用等质量的NH3、Cl2、NO、SO2 分别吹出四个气球,其中所充气体为Cl2的是( )
7.能正确表示下列化学反应的离子方程式是( )
A.铜片插入硝酸银溶液中:Cu+Ag+= Cu2++Ag
B.向AlCl3溶液中加入过量氨水: Al3++3 NH3·H2O=AlOH)3↓+ 3NH4+
C.铁粉与稀H2SO4反应:2Fe+6H+= 2Fe3++3H2↑
D.钠与水反应:Na+ 2H2O= Na++2OH-+H2↑
8.下列变化过程发生氧化反应的是( )
A. SO2→H2SO3 B. N2→NH3 C. H2→H2O D. FeSO4→Fe
9.下列有关物质的性质与用途,不具有对应关系的是( )
A. Na2O2为淡黄色固体,可用于潜艇中的供氧剂
B. Na2CO3溶液显碱性,可用于除器皿表面的油污
C. A12O3的熔点高,常用作耐火、耐高温材料
D. NaC1O具有强氧化性,常作为杀菌、消毒剂
10.下表是某矿物质饮用水的部分标签说明,则该饮用水中还可能大量存在的( )
主要成分
K+
Cl-
Mg2+
SO42-
含量(mg/L)
20~27.3
30~34.2
2.02~2.49
24~27.5
A. Na+ B. Ba2+ C. Ag+ D. OH-
11.关于二氧化硅的叙述正确的是( )
①二氧化硅是制造光导纤维的重要原料
②硅、碳原子最外层都有4个电子,故SiO2的物理性质与CO2类似
③SiO2既能和氢氧化钠溶液反应也能和氢氟酸反应,是两性氧化物
④将CO2通入Na2SiO3溶液中有胶状沉淀生成,说明碳酸比硅酸酸性强
A.②③ B.③④ C.②④ D.①④
12.某溶液只含有Na+、A13+、Cl-、SO42-四种离子,已知Na+、A13+、Cl-的个数比为1:2:
3,则溶液中A13+和SO42-的个数比为( )
A.1:2 B.1:4 C.1:1 D.2:3
13.下列离子检验的方法正确的是( )
A.某溶液中加入BaCl2溶液,生成白色沉淀,说明原溶液中含有SO42-
B.某溶液中加入KSCN溶液,生成红色溶液,说明原溶液中含有Fe3+
C.某溶液中加入硝酸银溶液,生成白色沉淀,说明原溶液中含有Cl-
D.某溶液中加入过量NaOH,生成白色沉淀,说明原溶液中含有A13+
14.在探究新制氯水成分及性质实验中,依据下列方法和现象,结论错误的是( )
方法
现象
结论
A
观察氯水颜色
氯水呈黄绿色
氯水中含Cl2
B
向饱和NaHCO3溶液中滴加氯水
有无色气体产生
氯水具有酸性
C
向红色纸条上滴加氯水
红色纸条褪色
氯水具有漂白性
D
向FeCl3溶液中滴加氯水
溶液变成棕黄色
氯水具有还原性
A.A B.B C.C D. D
15.高锰酸钾溶液在酸性条件下可以与草酸(H2C2O4,其中O显-2价)反应,化学方程式如下: KMnO4+H2C2O4+H2SO4→K2SO4+ MnSO4+CO2↑+H2O。(未配平)
下列说法正确的是( )
A. MnO4-是氧化剂,Mn2+是氧化产物 B.还原性:H2C2O4>Mn2+
C.氧化剂和还原剂物质的量之比为5:2 D.生成1 molCO2时,转移2NA个电子
16将一定量的CO2气体通入2 L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法正确是( )
A. Oa段反应的离子方程式只有: H++HCO3-=H2O+CO2↑
B.O点溶液中所含溶质为NaHCO3、Na2CO3
C. b点产生CO2的体积为44.8 L
D.原NaOH溶液的物质的量浓度为2.5 mol/L
第二部分(非选择题共52分)
17. (15分)
I.下图为五个椭圆交叉构成的图案,椭圆内分别写了C2H5OH、CO2、Fe2O3、FeCl3 和NaOH五种物质,图中相连的两种物质均可归为一类,相交的部分A、B、C、D为其相应的分类标准代号。请回答下列问题:
(1)两种物质都是电解质的是__________(填分类标准代号:A或B……);分类标准代号A表示_____________________。
a.两物质都是非电解质 b.两物质都是易燃物
c.两物质都是含碳化合物 d.两物质都是氧化物
(2)用洁净的烧杯取25 mL蒸馏水,加热至沸腾,向烧杯中逐滴加入上述五种物质中的某一物质的饱和溶液,加热至溶液呈红褐色,得到的分散系称为__________;用洁净的铂丝蘸取上述五种物质中的某种物质在酒精灯火焰上灼烧,火焰呈黄色,该物质的化学式为_______;上述五种物质中的碱性氧化物能与某种强酸反应生成上述物质中的另一种物质, 该反应的离子方程式为_________________________。
II. (1) 水是生命之源,化学中与水有关的反应也很多:
A.2F2+2H2O=4HF+O2 B.2Na+2H2O= 2NaOH +H2↑
C. CaO+H2O=Ca(OH)2 D.2H2O2H2↑+O2↑
E. 3NO2+H2O= 2HNO3+NO
上述反应中:
①水只作氧化剂的是____________;(填选项字母, 下同)
②水只作还原剂的是____________;
③水既是氧化剂,又是还原剂的是____________;
④水既不是氧化剂,又不是还原剂的是____________;
(2)沾有水的铁制器皿在高温火焰上会发黑,该反应的化学方程式是____________。
18. (12分)已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
84消毒液
(有效成分) NaClO
(规 格) 1000 mL
(质量分数) 25%
(密 度) 1.1 g/cm3
(1) 84消毒液有效成分NaClO的摩尔质量为______________。
(2)某同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。需要称量NaClO固体的质量为_________g;配制上述溶液除了以下仪器外,还需要的玻璃仪器是________________。
(3) 84消毒液和洁厕灵混合在一起使用,会产生一种刺鼻的有毒气体——氯气。NaClO+2HCl=NaCl+Cl2↑+H2O;当有l mol HCl被氧化时,转移的电子数为___个。
(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组用18.4 mol/L的浓硫酸配制200 mL 2.3 mol/L的稀硫酸用于增强“84消毒液”的消毒能力。
①需用量简量取浓硫酸的体积为_____________mL;
②若所配制的稀硫酸浓度偏小,则下列可能的原因分析中正确的是__________。
A.配制前,容量瓶中有少量蒸馏水 B.量取浓硫酸时,仰视液体的凹液面
C.未冷却,立即转移至容量瓶定容 D.定容时,仰视溶液的凹液面
19 (12 分)为了探究“一氧化碳是否在水存在时才能和过氧化钠反应”,某课外活动小组设计了下列装置进行探究。广口瓶②、③中分别装有试剂X和试剂Y,④、⑤中均是干燥的过氧化钠。
【实验与现象】
步骤1:打开弹簧夹K2,关闭K1,
打开分液漏斗活塞加入盐酸,将带火星的木条放在a处,木条不复燃。
步骤2:打开弹簧夹K1,关闭K2,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处,木条复燃。
【思考与分析】
(1)装置①中反应的离子方程式是_____________________________。
(2)装置②中的试剂X是__________;装置③中的试剂Y是____________。
A.浓H2SO4 B.饱和食盐水 C.饱和Na2CO3溶液 D.饱和NaHCO,溶液
【结论与反思】
(3)根据步骤和步骤2的实验现象,得到的结论是____________________________。
(4)实验后有同学提出质疑:
“步骤2的实验并不能证明过氧化钠跟二氧化碳发生了化学反应。”小组其他同学也认为很有道理,请写出其理由的方程式____________________________________。
(5)若要证明“过氧化钠跟二氧化碳发生了化学反应”,需要补充的实验操作是:取⑤中反应后的少量固体,_________________________________________________________。
20. (13分)某铜矿石的主要成分是CuO,还含有少量的Al2O3、Fe2O3和 SiO2。某工厂利用此矿石炼制粗铜的工艺流程如图所示(已知:Cu2O+2H+=Cu+Cu2++H2O)。
请结合流程图回答下列问题:
(1)滤液A中铁元素的存在形式为_________________(填离子符号),生成该离子的离子方程式为_________________________________________。
(2)已知滤液C的主要成分为NaAlO2溶液,请写出由滤液A生成滤液C的离子方程式________________________________________。
(3)固体F中有两种物质,一种是黑色固体,另一种为__________________(填化学式),生成黑色固体的化学方程式为_________________________________________。
(4)已知废液的主要成分是Na2SiO3溶液。固体混合物B中加入溶液G发生反应的离子方程式为____________________;反应后,实现铜与废液分离的实验操作为____________________(填实验名称)。
相关文档
- 【物理】福建省福州市八县一中20192021-04-16 19:48:0518页
- 2018-2019学年浙江省浙南名校联盟(2021-04-16 15:55:058页
- 重庆市七校联盟2019-2020学年高二2021-04-16 12:59:3714页
- 2018-2019学年湖南省岳阳县、汨罗2021-04-16 09:47:355页
- 2018-2019学年福建省福州市八县(市)2021-04-16 02:57:1315页
- 吉林省辽源市友好学校第七十届20202021-04-15 21:31:3916页
- 2018-2019学年河南省商丘市九校高2021-04-15 20:58:266页
- 安徽省滁州市九校2019-2020学年高2021-04-15 19:47:1413页
- 2018-2019学年浙江省浙南联盟(温州2021-04-15 19:35:0011页
- 2019-2020学年湖北省宜昌市部分示2021-04-15 18:10:2111页