- 893.00 KB
- 2021-04-16 发布
第6讲 离子共存与离子推断
一、离子共存
离子共存问题是离子反应条件和本质的最直接应用。所谓几种离子在同一溶液中能大量共存,就是指离子之间不发生反应;若离子之间能发生反应,则不能大量共存。
二、掌握离子检验的三种方法
1.沉淀法
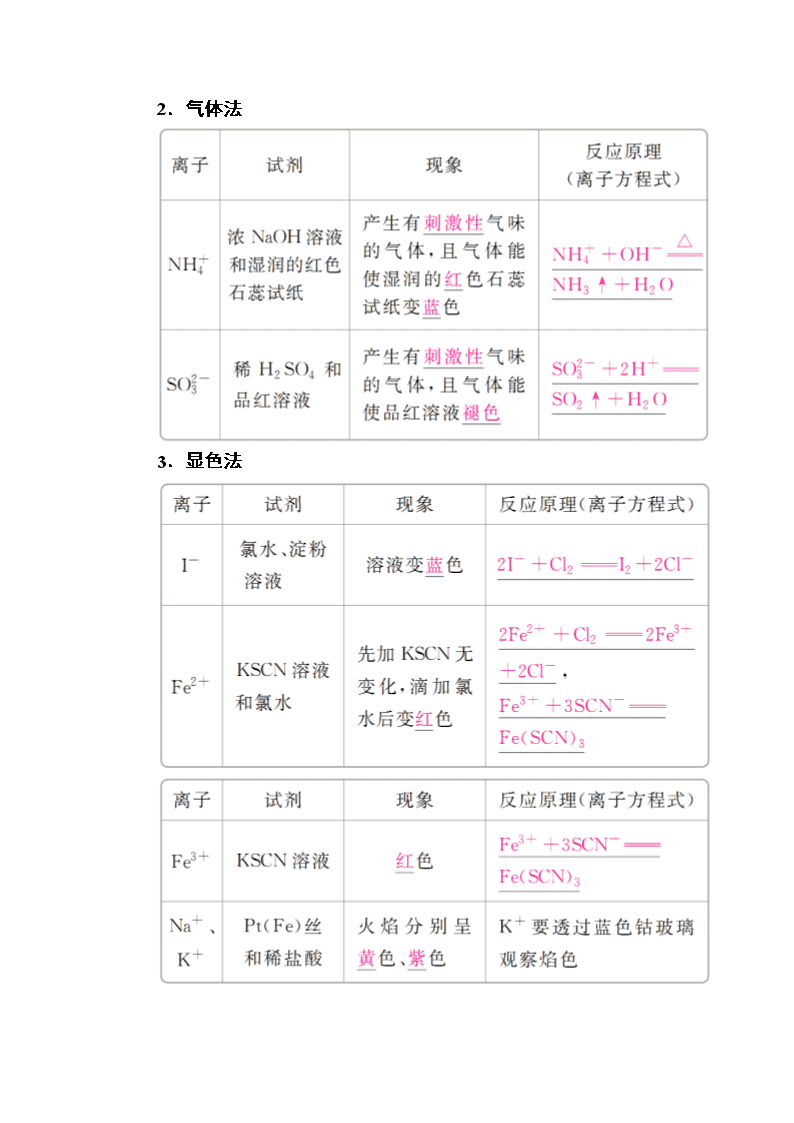
2.气体法
3.显色法
1.正误判断,正确的画“√”,错误的画“×”。
(1)向某溶液中加入BaCl2溶液,有白色沉淀生成,再加入稀盐酸,沉淀不消失,则溶液一定存在SO。( )
(2)向某溶液中加入Ba(NO3)2溶液,产生不溶于稀HNO3的白色沉淀,则溶液中一定存在SO。( )
(3)向某溶液中加入Ca(OH)2溶液,有白色沉淀生成,则溶液中一定存在CO。( )
(4)加入稀盐酸酸化的BaCl2溶液,出现白色沉淀,则溶液中可能有SO或Ag+。( )
(5)加入CaCl2溶液,有白色沉淀生成,溶液中一定存在CO。( )
(6)滴入硝酸酸化的BaCl2溶液,产生白色沉淀,溶液中一定存在SO。( )
答案 (1)× (2)× (3)× (4)√ (5)× (6)×
2.教材改编题
(据人教必修一P34 T7)下列各组离子,在溶液中能大量共存的是( )
A.Na+、H+、Cl-、OH-
B.K+、Mg2+、Cl-、SO
C.Na+、OH-、NO、HCO
D.K+、Cl-、H+、HCO
答案 B
考点1 离子共存
典例1 (2017·四川南充模拟)在指定条件下,下列各组离子一定不能大量共存的是( )
①能使红色石蕊试纸变蓝的溶液中:Na+、K+、CO、NO、AlO
②c(H+)=0.1 mol·L-1的溶液中:Cu2+、Al3+、SO、NO
③能使碘化钾-淀粉试纸变蓝的溶液中:Na+、NH、S2-、Br-
④由水电离出的c(H+)=10-12 mol·L-1的溶液中:Na+、Mg2+、Cl-、HCO
⑤加入铝粉能产生氢气的溶液中:NH、Fe2+、SO、NO
⑥含有大量Fe3+的溶液中:NH、Na+、Cl-、SCN-
A.①②③ B.①③⑥
C.③④⑤⑥ D.②④
解析 由题意知,①溶液呈碱性,指定的离子均能大量共存;②溶液呈酸性,指定的离子均能大量共存;③溶液中存在氧化性强于I2的物质,由于氧化性I2>S,故S2-不能大量存在;④溶液可能呈酸性也可能呈碱性,而HCO在酸性和碱性溶液中均不能大量存在,Mg2+在碱性溶液中不能大量存在;⑤加入铝粉产生氢气的溶液可能呈强酸性,也可能呈强碱性,NH、Fe2+在强碱性溶液中不能大量存在,Fe2+、NO在强酸性溶液中不能大量共存;⑥Fe3+与SCN-不能大量共存。
答案 C
名师精讲
1.离子共存判断
判断多种离子能否大量共存于同一溶液中,归纳起来就是:一色、二性、三特殊、四反应。
(1)一色——溶液颜色
几种常见离子的颜色:
Cu2+
Fe3+
Fe2+
MnO
离子
溶液颜色
蓝色
棕黄色
浅绿色
紫红色
(2)二性——溶液的酸碱性
①在强酸性溶液中,OH-及弱酸根阴离子(如CO、SO、S2-、CH3COO-等)均不能大量存在;
②在强碱性溶液中,H+及弱碱阳离子(如NH、Al3+、Fe3+等)均不能大量存在;
③酸式弱酸根离子(如HCO、HSO、HS-等)在强酸性或强碱性溶液中均不能大量存在。
(3)三特殊——三种特殊情况
①AlO与HCO不能大量共存:
AlO+HCO+H2O===Al(OH)3↓+CO;
②“NO+H+”组合具有强氧化性,能与S2-、Fe2+、I-、SO等还原性的离子因发生氧化还原反应而不能大量共存;
③NH与CH3COO-、CO,Mg2+与HCO等组合中,虽然两种离子都能水解且水解相互促进,但总的水解程度仍很小,它们在溶液中能大量共存。
(4)四反应——四种反应类型
指离子间通常能发生的四种类型的反应,能相互反应的离子显然不能大量共存。
①复分解反应,如Ba2+与SO,NH与OH-,H+与CH3COO-等;
②氧化还原反应,如Fe3+与I-、S2-,NO(H+)与Fe2+,MnO(H+)与Br-等;
③相互促进的水解反应,如Al3+与HCO,Al3+与AlO等;
④络合反应,如Fe3+与SCN-等。
2.警惕离子共存判断题干中的常见“陷阱”
1.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A.使酚酞变红色的溶液中:Na+、Al3+、SO、Cl-
B.=1×10-13 mol·L-1的溶液中:NH、Ca2+、Cl-、NO
C.与Al反应能放出H2的溶液中:Fe2+、K+、NO、SO
D.水电离的c(H+)=1×10-13 mol·L-1的溶液中:K+、Na+、AlO、CO
答案 B
解析 A项,使酚酞变红色的溶液显碱性,而Al3+在碱性条件下不能大量存在,所以错误;B项,溶液的pH=1,各离子之间不发生反应,可以大量共存,所以正确;C项,与铝反应能放出氢气的溶液可能显酸性也可能显碱性,若溶液显碱性,亚铁离子不能大量存在,若溶液显酸性,Fe2+和NO不能大量共存,所以错误;D项,该溶液可能显酸性也可能显碱性,如果显酸性,偏铝酸根离子和碳酸根离子不能大量存在,所以错误。
2.常温下,下列各组离子在指定溶液中一定能大量共存的是________。
①无色溶液中:K+、H+、MnO、HSO
②澄清透明的溶液中:Cu2+、Fe3+、NO、Cl-
③石蕊呈红色的溶液中:Fe2+、NO、SO、Na+
④石蕊呈蓝色的溶液中:Na+、AlO、NO、HCO
答案 ②
解析 ①MnO有颜色,而且在H+存在时MnO可以氧化HSO,错误;②中离子能大量共存,正确;③溶液呈酸性,Fe2+与NO发生氧化还原反应,错误;④溶液呈碱性,HCO不能大量共存,同时AlO与HCO反应,错误。
考点2 离子推断
典例2 有一无色透明溶液,欲确定是否含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、NO、SO、Cl-、I-、HCO,取该溶液实验如表所示:
实验步骤
实验现象
①取少量该溶液,加几滴甲基橙
溶液变红色
②取少量该溶液加热浓缩,加Cu片和浓H2SO4,加热
有无色气体产生,气体遇空气可以变成红棕色
③取少量该溶液,加BaCl2溶液
有白色沉淀生成
④取③中上层清液,加AgNO3溶液
有稳定的白色沉淀生成,且不溶于HNO3
⑤取少量该溶液,加NaOH溶液
有白色沉淀生成,当NaOH过量时沉淀部分溶解
由此判断:
(1)溶液中肯定存在的离子是_________________,溶液中肯定不存在的离子是______________________。
(2)为进一步确定其他离子,应该补充的实验及对应欲检离子的名称(说明使用试剂的名称,不必写详细操作步骤)___________________________________________________。
解析 利用肯定性原则,溶液无色,表明溶液中不存在Fe2+;由实验①确定溶液呈酸性;由实验②确定溶液中存在NO;由实验③确定溶液中存在SO;由实验⑤确定溶液中存在Mg2+和Al3+
。再根据互斥性原则,溶液呈酸性,H+与HCO不共存,故溶液中不存在HCO;NO(H+)具有强氧化性,与I-不共存,故溶液中不存在I-;Ba2+与SO不共存,故溶液中不存在Ba2+。最后根据进出性原则,实验③向溶液中带入了Cl-,故实验④不能确定溶液中是否存在Cl-。
答案 (1)Al3+、Mg2+、NO、SO Fe2+、Ba2+、I-、HCO
(2)焰色反应,检验K+;稀HNO3溶液、AgNO3溶液,检验Cl-
名师精讲
离子推断的“四项基本原则”
3.某溶液中含K+、Fe3+、Fe2+、Cl-、CO、NO、SO、SiO、I-中的若干种,某同学欲探究该溶液的组成,进行如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃,观察到紫色火焰。
Ⅱ.另取原溶液加入足量盐酸有无色气体生成,该气体遇空气变成红棕色,此时溶液颜色加深,但无沉淀生成。
Ⅲ.取Ⅱ反应后的溶液分别置于两支试管中,第一支试管中加入BaCl2溶液,有白色沉淀生成,再滴加KSCN溶液,上层清液变红;第二支试管中加入CCl4,充分振荡静置后溶液分层,下层为无色。
下列说法正确的是( )
A.原溶液中肯定不含Fe2+、NO、SiO、I-
B.原溶液中肯定含有K+、Fe3+、Fe2+、NO、SO
C.步骤Ⅱ中无色气体是NO气体,无CO2气体产生
D.为确定是否含有Cl-,可取原溶液加入过量硝酸银溶液,观察是否产生白色沉淀
答案 C
解析 由实验Ⅰ,透过蓝色钴玻璃观察到紫色火焰,说明溶液中有K+;由实验Ⅱ,说明溶液中有NO,且有还原性的离子,故至少有Fe2+、I-中的一种,无沉淀生成,说明溶液中无SiO;由实验Ⅲ,第二支试管加CCl4振荡后,下层为无色,说明溶液中不含I-,A错误;由实验Ⅲ,说明实验Ⅱ所得溶液中有Fe3+,但该离子可能是原溶液就有,或者是由Fe2+被氧化生成的,B错误;溶液中至少有Fe3+、Fe2+中的一种,故溶液中不存在CO,C正确;由实验Ⅲ可知,原溶液中含有SO,向原溶液中滴加硝酸银溶液,会生成Ag2SO4白色沉淀,不能确定溶液中是否含Cl-,D错误。
4.某无色溶液,其中有可能存在的离子如下:Na+、Ag+、Ba2+、Al3+、AlO、S2-、CO、SO、SO。现取该溶液进行有关实验,实验结果如下图所示:
(1)沉淀甲是__________________,生成沉淀甲的离子方程式为_______________________________________________________。
(2)沉淀乙是________________,由溶液甲生成沉淀乙的离子方程式为___________________________________________。
(3)沉淀丙可能是____________________________。
(4)综合上述信息,肯定存在的离子有_______________________。
答案 (1)S 2S2-+SO+6H+===3S↓+3H2O
(2)Al(OH)3 Al3++3HCO===Al(OH)3↓+3CO2↑
(3)BaCO3或BaCO3和BaSO4
(4)Na+、S2-、SO、AlO
解析 无色溶液中的阴离子均不能与Ag+大量共存,则加入HBr生成的淡黄色沉淀不可能为AgBr,则沉淀甲为S,发生2S2-+SO+6H+===3S↓+3H2O,一定存在S2-、SO,则原溶液不存在Ba2+、Al3+;溶液甲与过量碳酸氢铵反应,则沉淀乙为Al(OH)3,气体乙为二氧化碳,溶液乙中加过量氢氧化钡反应生成的白色沉淀丙可能为BaCO3或BaCO3和BaSO4,气体丙为氨气,由电荷守恒可知,一定存在的阳离子为Na+,一定存在的阴离子为S2-、SO、AlO。
(3)原溶液中有可能有硫酸根离子,溶液乙中含碳酸氢根离子,则沉淀丙中有BaCO3,也可能有BaSO4。
(4)肯定存在的离子有Na+、S2-、SO、AlO。
(建议用时:40分钟)
一、选择题(每题6分,共66分)
1.水溶液中能大量共存的一组离子是( )
A.Na+、Al3+、Cl-、CO
B.H+、Na+、Fe2+、MnO
C.K+、Ca2+、Cl-、NO
D.K+、NH、OH-、SO
答案 C
解析 A项,Al3+、CO相互促进水解,不能大量共存;B项,Fe2+与MnO(H+)发生氧化还原反应,不能大量共存;D项,NH与OH-发生反应生成弱电解质,不能大量共存。
2.能大量共存于同一溶液中,且当改变条件使溶液呈强酸性或强碱性时,一定能发生反应的离子组是( )
A.Fe3+、Na+、SCN-、Cl-
B.Ca2+、NH、SO、SO
C.Na+、Ba2+、Cl-、HCO
D.Al3+、Na+、SO、NO
答案 C
解析 A项,Fe3+与SCN-不能大量共存;B项,Ca2+与SO、SO不能大量共存;C项,四种离子能大量共存,HCO与H+、OH-都能反应;D项,四种离子能大量共存,在酸性条件下四种离子及H+间均不发生反应,在碱性条件下Al3+与OH-反应。
3.(2017·陕西宝鸡一模)某溶液中含有大量的K+、Cl-及X与Y两种离子,现向该溶液中加入W试剂,根据实验现象得到的关于X、Y的推断能成立的是( )
W试剂
实验现象
X、Y的推断
A
KI淀粉溶液
溶液变蓝
Fe3+、SO
B
用pH试纸检测
pH=7(常温)
CH3COO-、Na+
C
硝酸酸化的
AgNO3溶液
白色沉淀
CO、NH
D
过量NaOH溶液
无明显现象
Al3+、Mg2+
答案 A
解析 加入KI淀粉溶液,溶液变蓝,说明原溶液中含有氧化性离子,该离子可以为Fe3+,且K+、Cl-、Fe3+、SO在该溶液中可以大量共存,A符合题意;pH=7说明溶液呈中性,若含有CH3COO-
,则该溶液显碱性,B不符合题意;若含有CO,则加入硝酸酸化的AgNO3溶液还会产生气体,与实验现象不符,C不符合题意;若含有Mg2+,则加入过量NaOH溶液会产生Mg(OH)2沉淀,D不符合题意。
4.下列各组离子中,在给定条件下能够大量共存的是( )
A.通入足量CO2后的溶液中:Na+、SiO、CH3COO-、
CO
B.无色溶液中:Mg2+、MnO、SO、K+
C.酸性溶液中可能大量存在Na+、ClO-、SO、I-
D.c(H+)/c(OH-)=1012的溶液中:NH、Al3+、NO、Cl-
答案 D
解析 A项,二氧化碳和硅酸根离子反应生成硅酸沉淀,和碳酸根离子反应生成碳酸氢根离子,不能共存,错误;B项,高锰酸根离子有颜色,错误;C项,酸性溶液中次氯酸根离子会氧化碘离子,错误;D项,溶液为酸性,四种离子不反应。
5.某同学为检验溶液中是否含有常见的几种无机离子,进行了如下图所示的实验操作,其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得到的正确结论是( )
A.原溶液中一定含有SO
B.原溶液中一定含有NH
C.原溶液中一定含有Cl-
D.原溶液中一定含有Fe3+
答案 B
解析 原溶液中加入硝酸钡和盐酸生成白色沉淀,原溶液中可能存在SO、SO或Ag+,A错误;加硝酸银溶液产生白色沉淀,可能是加入盐酸引起的,C错误;因检验过程中产生的气体能使湿润的红色石蕊试纸变蓝,说明原溶液中一定含有NH,B正确;加入KSCN溶液得到红色溶液,Fe3+可能是由原溶液中的Fe2+被NO、H+氧化而来的,故原溶液中不一定含有Fe3+,D错误。
6.在同一溶液中,含有NH、I-、Ba2+、Cl-等离子,则该溶液可能的pH和介质是( )
A.pH=1,稀硝酸为介质
B.pH=3,硫酸为介质
C.pH=8,次氯酸钠溶液为介质
D.pH=12,氨水为介质
答案 D
解析 溶液中含有还原性的I-,与稀硝酸、ClO-均不能共存,A、C错误;溶液中含有Ba2+与H2SO4不能共存,B错误。
7.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.使甲基橙变红色的溶液:Al3+、Cu2+、I-、S2O
B.常温下,加水稀释时的值明显增大的溶液:CH3COO-、Ba2+、NO、Br-
C.0.1 mol·L-1Fe(NO3)2溶液:[Fe(CN)6]3-、Na+、SO、Cl-
D.0.1 mol·L-1 NaAlO2溶液:NH、K+、HCO、SO
答案 B
解析 能使甲基橙变红色的溶液是酸性溶液,S2O不能大量存在,会发生反应:S2O+2H+===S↓+SO2↑+H2O,A错误;加水稀释时
的值明显增大,说明溶液显碱性,四种离子可以大量共存,B正确;[Fe(CN)6]3-与Fe2+不能大量共存,C错误;0.1 mol·L-1 NaAlO2溶液中HCO不能大量存在,D错误。
8.下列离子组在一定条件下能大量共存,且加入试剂后发生反应的离子方程式正确的是( )
答案 A
解析 K+、AlO、NO可以大量共存,加入过量CO2与AlO反应生成Al(OH)3和HCO,A正确;Fe3+和ClO-均具有较强的氧化性,而I-具有较强的还原性,故Fe3+、ClO-与I-不能大量共存,B错误;Ba2+、OH-、Na+可以共存,加NaHCO3溶液后,HCO+OH-===CO+H2O,Ba2+与CO生成BaCO3沉淀,C错误;Al3+与HCO发生双水解,不能共存,D错误。
9.甲、乙、丙、丁由H+、Na+、Al3+、Ba2+、OH-、Cl-、HCO中的两种组成,可以发生如图转化,下列说法正确的是( )
A.甲为AlCl3,乙为NaHCO3
B.溶液丙中还可以大量共存的离子有Fe2+、NO、SO
C.在甲中滴加丁开始反应的离子方程式:HCO+Ba2++OH-===BaCO3↓+H2O
D.白色沉淀A可能溶解在溶液D中
答案 D
解析 根据离子共存可确定甲、乙、丙、丁中的两种为HCl、AlCl3。且甲与乙、丙均能生成NaCl和无色气体B。则甲为NaHCO3,丙为HCl。甲和乙除生成NaCl、CO2外,还有沉淀A,则乙为AlCl3,丁为Ba(OH)2,A错误;Fe2+、NO在酸性条件下发生氧化还原反应不能共存,B错误;在甲中滴加丁开始反应的离子方程式为2HCO+Ba2++2OH-===BaCO3↓+CO+2H2O,C错误;无色溶液D为NaOH溶液,白色沉淀A为Al(OH)3,Al(OH)3能溶解在NaOH溶液中,D正确。
10.某溶液只可能含有K+、Al3+、Fe3+、Mg2+、Ba2+、NH、Cl-、CO、SO中的若干种离子。某同学取100 mL的溶液分成两等份进行如下实验:
①第一份加过量的氢氧化钠溶液后加热,收集到0.02 mol的气体,无沉淀产生,同时得到溶液甲。
②向溶液甲中通入过量的二氧化碳气体,生成白色沉淀,沉淀经过滤,洗涤灼烧后,得到1.02 g固体。
③
第二份加足量的氯化钡溶液后,生成白色沉淀,沉淀经盐酸充分洗涤,干燥,得到11.65 g固体。
据此,该同学得到的结论正确的是( )
A.实验①中产生的气体为氨气,并可得原溶液中c(NH)=0.2 mol·L-1
B.实验③中的白色沉淀中一定有BaSO4,无BaCO3
C.原溶液中一定有K+,且c(K+)=0.4 mol·L-1
D.若要判断原溶液中是否有Cl-,无需另外设计实验验证
答案 B
解析 由①得50 mL溶液中n(NH)=0.02 mol,根据离子共存原则,无Fe3+、Mg2+;②中得到的沉淀为Al(OH)3,1.02 g固体为Al2O3,则 50 mL溶液中n(Al3+)=0.02 mol,根据离子共存原则,无CO;由③得,溶液中一定含SO,其物质的量为n(SO)=0.05 mol(指50 mL溶液中),根据离子共存原则,原溶液中一定无Ba2+。综上所述,有SO(0.05 mol)、Al3+(0.02 mol)、NH(0.02 mol),根据电荷守恒,还一定有K+,根据上述实验,由于无法确定是否含有Cl-,所以n(K+)≥0.05 mol×2-0.02 mol×3-0.02 mol=0.02 mol,其浓度为c(K+)≥=0.4 mol·L-1。
11.下列各组粒子在指定溶液中一定能大量共存的是( )
A.中性透明溶液中:K+、SO、NO、Fe3+
B.在酸性KMnO4溶液中:SO、Mg2+、NO、
CH3CH2OH
C.常温下由水电离出的c(H+)·c(OH-)=10-20 mol2·L-2的溶液中:Na+、NH、Cl-、SiO
D.离子的物质的量浓度相同的溶液中:CH3COO-、SO、NH、Cu2+
答案 D
解析 Fe3+不能存在于中性透明溶液中,A错误;在具有强氧化性的酸性KMnO4溶液中,CH3CH2OH不能存在,B
错误;常温下由水电离出的c(H+)·c(OH-)=10-20 mol2·L-2的溶液中,由水电离的c(H+)=c(OH-)=10-10 mol·L-1,水的电离受到抑制,该溶液为酸溶液或碱溶液,NH在碱溶液中不能大量存在,SiO在酸溶液中不能大量存在,C错误。
二、非选择题(共34分)
12.(11分)已知四种强电解质溶液,分别含有下列阴、阳离子中的各一种,并且互不重复:NH、Ba2+、Na+、H+、SO、NO、OH-、CO。将这四种溶液分别标记为A、B、C、D,进行如下实验:①在A或D中滴入C,均有沉淀生成;②D和B反应生成的气体能被A吸收;③A和D反应生成的气体能被B吸收。试回答下列问题:
(1)D的化学式是________,判断理由是____________________。
(2)写出其余几种物质的化学式:A________,B________,C________。
(3)写出实验②中有关反应的离子方程式_______________________________________________________。
答案 (1)(NH4)2CO3 D和A、B都能生成气体,而题给离子中只有H+与CO、OH-与NH能反应生成气体,D只能为(NH4)2CO3
(2)H2SO4 NaOH Ba(NO3)2
(3)NH+OH-===NH3↑+H2O、NH3+H+===NH
解析 D和A、B都能生成气体,而题给离子中只有H+与CO、OH-与NH能反应生成气体,故D只能为(NH4)2CO3;在A或D中滴入C,均有沉淀生成,说明A中含有SO,C中应含有Ba2+,而A和D反应能生成气体,说明A一定是硫酸,产生的气体是二氧化碳,能被B吸收,说明B是一种碱,所以C是硝酸钡,B是氢氧化钠。
13.(12分)现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子K+、Fe3+、Cu2+、Ba2
+、Al3+和五种阴离子Cl-、OH-、NO、CO、X中的一种。
(1)某同学通过比较分析,认为无须检验就可判断其中必有的两种物质是________和________。
(2)物质C中含有离子X。为了确定X,现将(1)中的两种物质记为A和B,当C与A的溶液混合时产生蓝色沉淀,向该沉淀中滴入足量稀HNO3,沉淀部分溶解,剩余白色固体,则X为________(填字母)。
A.Br- B.SO
C.CH3COO- D.HCO
(3)将19.2 g Cu投入装有足量D溶液的试管中,Cu不溶解,再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,写出Cu溶解的离子方程式__________________________,若要将Cu完全溶解,至少加入H2SO4的物质的量是________。
(4)E溶液与氢碘酸反应时可生成棕色物质,该反应的离子方程式为___________________________________________。
答案 (1)K2CO3 Ba(OH)2 (2)B
(3)3Cu+8H++2NO===3Cu2++2NO↑+4H2O 0.4 mol
(4)2Fe3++2I-===2Fe2++I2
解析 (1)根据溶解性,一定含有K2CO3,由于OH-和Fe3+、Cu2+、Al3+均反应,所以还一定含有Ba(OH)2。
(2)根据产生蓝色沉淀,加入稀HNO3后,还剩余白色沉淀,说明C中含Cu2+,A为Ba(OH)2,最后的白色沉淀为BaSO4,所以X为SO。
(3)根据产生的现象,D中含NO,根据剩余的阳离子,D应为Al(NO3)3,加入Cu后,其离子方程式为3Cu+8H++2NO===3Cu2++2NO↑+4H2O,根据上述离子方程式可知,若使19.2 g(0.3 mol)的Cu完全溶解,则需0.8 mol的H+,即0.4 mol的H2SO4。
(4)最后可以判断E为FeCl3溶液,FeCl3与HI反应的离子方程式为2Fe3++2I-===2Fe2++I2。
14.(11分)某固体混合物,仅含有以下阴、阳离子中的某几种(不考虑水的电离):
阳离子
K+、Ba2+、Ag+、Mg2+、NH
阴离子
Cl-、SO、CO、AlO、MnO
为了判断该混合物的组成,现依次进行如下实验,根据实验现象,回答下列问题:
(1)取该固体混合物,加水后固体完全溶解得到无色溶液,且未嗅到气味;用pH试纸测得溶液的pH为12。则混合物组成中肯定不存在的离子是________。
(2)向(1)所得溶液中滴加盐酸,开始有沉淀生成,继续滴加,沉淀消失,同时有无色无味气体逸出。则肯定存在的离子是________,可以排除的离子是________。
(3)取以上实验的上层澄清液,滴加AgNO3溶液,有白色沉淀生成。你认为还有哪些离子尚待检验:________(填离子符号),请你对尚待检验的离子提出合理的检验方法(要求写出具体的步骤、现象与结论):________________________________________________。
答案 (1)MnO、NH、Ag+、Mg2+
(2)AlO、CO、K+ Ba2+、SO
(3)Cl- 取(1)中所得溶液少许于试管中,用硝酸酸化后滴加AgNO3溶液,若有白色沉淀生成则含有Cl-,否则不含Cl-
您可能关注的文档
相关文档
- 复习备考高考化学红对勾系列一轮复2021-04-16 11:27:2821页
- 2020届高考化学一轮复习化学反应中2021-04-16 09:12:3517页
- 2020届高考化学一轮复习化学工艺流2021-04-16 03:18:1110页
- 2020届高考化学一轮复习化学反应速2021-04-16 02:01:3615页
- 2019届高考化学一轮复习化学与材料2021-04-15 23:06:2929页
- 2020届高考化学一轮复习化学电源及2021-04-15 19:13:5831页
- 2021届(鲁科版)高考化学一轮复习化学2021-04-15 18:59:595页
- 2020届高考化学一轮复习化学反应与2021-04-15 16:29:146页
- 2021届(鲁科版)高考化学一轮复习化学2021-04-15 03:18:5213页
- 2021届高考化学一轮复习化学实验基2021-04-14 20:43:436页