- 527.72 KB
- 2021-04-16 发布
2016-2017学年山东省枣庄市薛城区九年级(上)期中化学试卷
一、单项选择题(每小题3分,共48分)
1. 同学们进入九年级了,要用“洪荒之力”好好拼搏一年哟!你知道编制了第一张元素周期表的科学家是( )
A. 门捷列夫 B. 达尔文
C. 拉瓦锡 D. 牛顿
2. 下列物质不属于空气污染物的是( )
A.二氧化硫 B.一氧化碳 C.氮气 D.可吸入颗粒物
3. 成语是中华文化的瑰宝。下列成语涉及化学变化的是( )
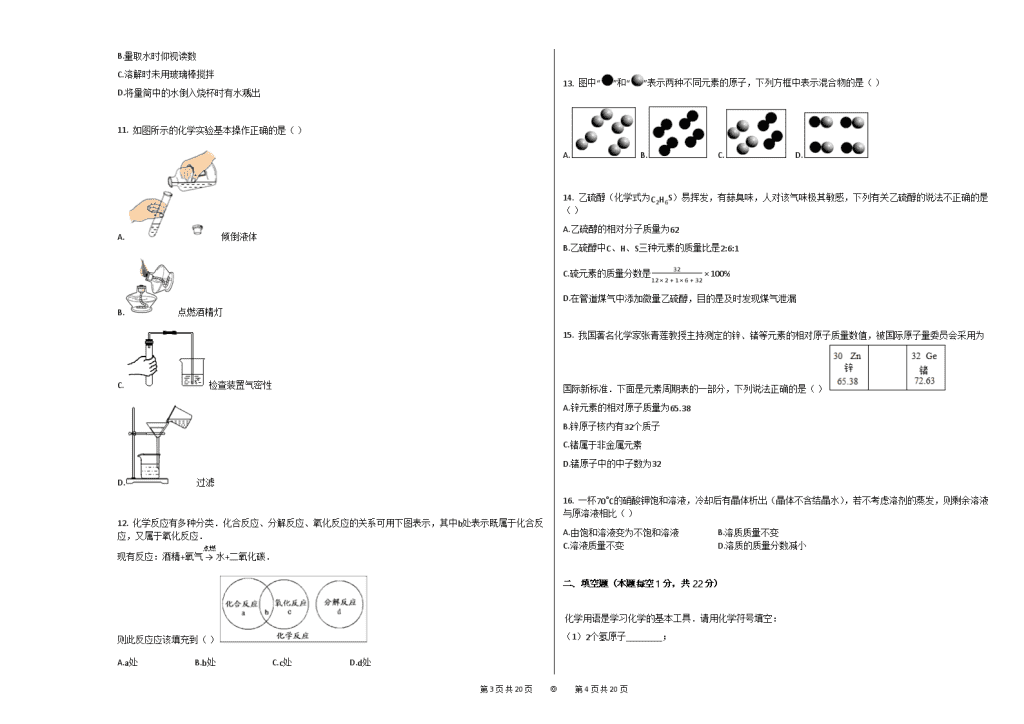
A.绳锯木断 B.滴水成冰 C.死灰复燃 D.聚沙成塔
4. 碘酸钙是一种补碘、补钙的添加剂,其化学式为 Ca(IO3)2,碘酸钙中碘元素的化合价是( )
A.+5 B.+1 C.−1 D.+7
5. 图为某原子结构模型的示意图,其中a、b、c是构成该原子的三种不同粒子,下列说法正确的是( )
A.决定该原子种类的粒子是b
B.原子中b与c的数目一定相同
C.原子中a与c的数目一定相同
D.原子的质量集中在a和c上
6. 食醋是厨房中常用的调味品,它的主要成分是乙酸,乙酸分子的模型如图所示,其中代表一个氧原子,代表一个氢原子,代表一个碳原子.下列说法不正确的是( )
A.乙酸是一种化合物
B.乙酸的化学式为C2H4O2
C.乙酸中碳元素的质量分数为60%
D.乙酸分子中的碳原子、氢原子、氧原子的个数比为1:2:1
7. 建立宏观与微观的联系是化学学科特有的思维方式。下列对于宏观现象的微观解释中,错误的是( )
A.水通直流电分解——是因为水分子被破坏,形成新的分子
B.“酒香不怕巷子深”——说明了分子在不断运动
C.水和过氧化氢具有不同的化学性质——是因为构成它们的分子不同
D.20mL水与20mL酒精混合后体积小于40mL——是因为分子数目减少
8. 下列物质的用途主要利用其化学性质的是( )
A.铜丝作导线 B.干冰用于人工降雨
C.天然气作燃料 D.金刚石用于切割玻璃
9. 下列化学用语与所表达的意义对应错误的是( )
A.Mg−金属镁
B.-镁原子
C.Mg+2O−氧化镁中镁元素为+2价
D.N2−1个氮分子由2个氮原子构成
10. 配制50g质量分数为10%的氢氧化钠溶液,下列失误会导致所配溶液溶质质量分数偏大的是( )
A.装瓶时,有溶液洒出
第17页 共20页 ◎ 第18页 共20页
B.量取水时仰视读数
C.溶解时未用玻璃棒搅拌
D.将量筒中的水倒入烧杯时有水溅出
11. 如图所示的化学实验基本操作正确的是( )
A. 倾倒液体
B. 点燃酒精灯
C. 检查装置气密性
D. 过滤
12. 化学反应有多种分类.化合反应、分解反应、氧化反应的关系可用下图表示,其中b处表示既属于化合反应,又属于氧化反应.
现有反应:酒精+氧气→点燃 水+二氧化碳.
则此反应应该填充到( )
A.a处 B.b处 C.c处 D.d处
13. 图中“”和“”表示两种不同元素的原子,下列方框中表示混合物的是( )
A. B. C. D.
14. 乙硫醇(化学式为C2H6S)易挥发,有蒜臭味,人对该气味极其敏感,下列有关乙硫醇的说法不正确的是( )
A.乙硫醇的相对分子质量为62
B.乙硫醇中C、H、S三种元素的质量比是2:6:1
C.硫元素的质量分数是3212×2+1×6+32×100%
D.在管道煤气中添加微量乙硫醇,目的是及时发现煤气泄漏
15. 我国著名化学家张青莲教授主持测定的锌、锗等元素的相对原子质量数值,被国际原子量委员会采用为国际新标准.下面是元素周期表的一部分,下列说法正确的是( )
A.锌元素的相对原子质量为65.38
B.锌原子核内有32个质子
C.锗属于非金属元素
D.锗原子中的中子数为32
16. 一杯70∘C的硝酸钾饱和溶液,冷却后有晶体析出(晶体不含结晶水),若不考虑溶剂的蒸发,则剩余溶液与原溶液相比( )
A.由饱和溶液变为不饱和溶液 B.溶质质量不变
C.溶液质量不变 D.溶质的质量分数减小
二、填空题(本题每空1分,共22分)
化学用语是学习化学的基本工具.请用化学符号填空:
(1)2个氢原子________;
第17页 共20页 ◎ 第18页 共20页
(2)保持氮气化学性质的最小微粒________;
(3)相对分子质量最小的氧化物是________;
(4)氯化钠中的阳离子________.
溱湖又名喜鹊湖,是我市著名的风景区.某实验小组学对溱湖的水样进行了相关的研究.
(1)溱湖水属于________(填“纯净物”或“混合物”);
(2)为了检验湖水是软水还是硬水,可向水样中加入________,搅拌;
(3)某次下雨后该实验小组从溱湖支流中取了水样,观察到:A.水样呈黄色,有异味 B.水样浑浊,有固体小颗粒.他们进行了一系列的净化处理,请回答:
①向水样中加入明矾搅拌溶解,静置一段时间后,进行________(填操作名称),除去固体小颗粒;该操作中必须要使用的玻璃仪器有烧杯、漏斗和________,该仪器的作用是________.
②生活中既能降低水的硬度,又能杀菌消毒的方法是________.
③同学们查阅资料后发现:含氮的物质进入水中会造成水中藻类大量繁殖,使水质恶化.这里的“氮”是指________.
A、元素 B、原子 C、离子 D、分子
(4)注意饮水安全,保证人体健康,在天然水净化过程中,人们常用活性炭去除异味和色素,这是利用活性炭的________性.此外还需加入漂白粉消毒杀菌,其有效成分为Ca(ClO)2,其中氯元素的化合价为________.
在宏观、微观和符号之间建立联系是化学学科的特点。
(1)物质的组成及构成关系如图1所示,图中①表示的是________,②表示的是________。
(2)下列说法正确的是( )(填字母)。
A.氯化氢是由氢、氯两种元素组成的
B.氯化氢是由氢气和氯气混合而成的
C.氯化氢是由一个氢原子和一个氯原子构成的
(3)图2是氧、硫、氯三种元素的原子结构示意图。
①氯原子的结构示意图中x的数值是________。
②氧和硫两种元素的化学性质具有相似性的原因是它们原子的________相同。
③氧和氯两种元素最本质的区别是它们原子中的________不同。
溶液在日常生活、工农业生产和科学研究中具有广泛的用途。
(1)生理盐水是医疗上常用的一种溶液,其溶质是________(填化学式);
(2)在盛有水的烧杯中加入以下某种物质,形成溶液的过程中温度上升,这种物质是________(填字母);
A.氯化钠 B.硝酸铵 C.氢氧化钠
(3)某同学在实验室用氯化钠固体和蒸馏水配制50g质量分数为6%的氯化钠溶液时,涉及以下实验步骤:
①溶解,②称量和量取,③计算,④装入试剂瓶贴好标签。
配制上述溶液正确的实验步骤顺序是________(填序号);
(4)某注射用药液的配制方法如下:
①把1.0g药品溶于水配制成4.0mL溶液a;
②取0.1mL溶液a,加水稀释至1.0mL,得溶液b;
③取0.1mL溶液b,加水稀释至1.0mL,得溶液c;
④取0.4mL溶液c,加水稀释至1.0mL,得溶液d。
由于在整个配制过程中药液很稀,其密度都可近似看做1g/cm3,则最终得到的药液(溶液d)中溶质的质量分数为________。
三、实验与探究(每空1分,本题共20分)
实验是科学探究的重要途径,请根据如图回答相关问题:
(1)正确选择实验仪器是实验成功的重要保证.常用于保存液体药品的是________;用作反应容器且能够直接加热的是________.(填①∼⑦序号)
(2)实验时要掌握正确的实验技能.
第17页 共20页 ◎ 第18页 共20页
①图甲所示的蒸发操作中,实验结束要等________时,再熄灭酒精灯;
②图乙表示称量固体氢氧化钠的质量,出现的错误是________.
请根据下列各实验装置图,回答:
(1)写出如图所示装置中标有序号的仪器名称:①________②________.
(2)实验室中用过氧化氢溶液与二氧化锰混合制取氧气,选择的发生装置________;发生反应的符号表达式为:________;制取气体时,组装好仪器后,应先________,再添加药品.
(3)要收集到较纯净的氧气,应该选用的收集装置是________,若用该装置收集的氧气也不纯,原因可能是________.
(4)如果用F装置收集氧气,则氧气由________端通入,此时如何验满________;如果将F装置装满水时收集氧气由________端通入(填“a”或“b”).
(5)甲烷在实验室里可用排水法或向下排空气法收集,请你根据甲烷的收集方法,推测该气体具有的性质是________、________.
(6)氧气是一种化学性质比较活泼的气体,它可以和许多物质发生反应.
①下述三个反应的相同点是________(多选,填序号).
A.都是化合反应 B.都是氧化反应 C.生成物都是固体 D.都需要点燃 E.都是非金属与氧气反应
②在做甲、丙两个实验时,事先都需在集气瓶底部装有少量水.丙中的水吸收生成的气体,避免污染空气,甲中的水作用是:________.
③请写出符号表达式:
铁丝燃烧________;红磷燃烧________.
四、计算题(本题共10分)
牛奶是我们日常生活中一种营养丰富的饮品,每天饮用可补充人们对钙等营养物质的需求.其中营养成分的具体含量如下表所示.牛奶营养成分表
项目
每100mL
能量
272kJ
蛋白质
3.2g
脂肪
3.8g
碳水化合物
4.5g
钠
60mg
钙
110mg
非脂乳固体
≥8.1%
请根据资料回答下列问题:
(1)牛奶中的钙主要以磷酸钙[Ca3(PO4)2]的形式存在,它磷酸钙的相对分子质量为310,其计算式为________.
(2)磷酸钙中钙、磷、氧三种元素的质量比为________;其中钙元素的质量分数为________(计算结果保留至0.1%).
(3)通常中学生每天需从牛奶中补充550mg的钙,若一盒牛奶为250mL,则理论上每天应喝________盒牛奶.
农业生产中通常用溶质质量分数为10%∼20%的食盐溶液来选种。
(1)现要配制120kg溶质质量分数为20%的食盐溶液,需要取用固体食盐________kg;
(2)用60kg溶质质量分数为20%的食盐溶液,可稀释成12%的食盐溶液________kg。
第17页 共20页 ◎ 第18页 共20页
参考答案与试题解析
2016-2017学年山东省枣庄市薛城区九年级(上)期中化学试卷
一、单项选择题(每小题3分,共48分)
1.
【答案】
A
【考点】
化学的历史发展过程
【解析】
根据科学家们各自在科学上做出的贡献进行分析解答本题.
【解答】
解:A、门捷列夫在化学上的主要贡献是发现了元素周期律,并编制出元素周期表,故选项正确.
B、达尔文发现了生物进化论,故选项错误.
C、拉瓦锡首先通过实验得出空气是由氮气和氧气组成的结论,故选项错误.
D、牛顿发现了万有引力定律,故选项错误.
故选A.
2.
【答案】
C
【考点】
空气污染的危害及防治措施
【解析】
此题暂无解析
【解答】
属于空气污染物的是烟尘、二氧化氮、二氧化硫、一氧化碳等,各选项中只有氮气不属于空气污染物;
故选C。
3.
【答案】
C
【考点】
化学变化和物理变化的判别
【解析】
化学变化是指有新物质生成的变化,物理变化是指没有新物质生成的变化,化学变化和物理变化的本质区别是否有新物质生成;据此分析判断。
【解答】
A、绳锯木断过程中只是形状发生改变,没有新物质生成,属于物理变化。
B、滴水成冰过程中只是状态发生改变,没有新物质生成,属于物理变化。
C、死灰复燃过程中有新物质二氧化碳等生成,属于化学变化。
D、聚沙成塔过程中没有新物质生成,属于物理变化。
4.
【答案】
A
【考点】
有关元素化合价的计算
【解析】
根据在化合物中正负化合价代数和为零进行解答.
【解答】
钙显+2价,氧显−2价,根据在化合物中正负化合价代数和为零,可设碘酸钙中碘元素的化合价为x,则:(+2)+2x+(−2)×3×2=0,解得x=+5;
5.
【答案】
C
【考点】
原子的定义与构成
【解析】
A、根据质子数和中子数决定原子的种类解答;
B、根据在原子中质子数和中子数不一定相等解答;
C、根据原子中质子数=电子数解答;
D、根据原子的质量主要集中在原子核上解答。
【解答】
A.质子数和中子数决定原子的种类,所以决定该原子种类的粒子是b和c,故错误;
B.质子数和中子数不一定相等,原子中b与c的数目不一定相同,故错误;
C.原子中质子数=电子数,a与c的数目一定相同,故正确;
D.原子的质量主要集中在原子核上,集中在b和c上,故错误;
故选C。
6.
【答案】
C
【考点】
化学式的书写及意义
单质和化合物的概念及判别
元素的质量分数计算
【解析】
由乙酸的分子的模型图,1个乙酸分子是由2个碳原子、4个氢原子和2个氧原子构成的,其化学式为:C2H4O2.
A、由不同种元素组成的纯净物是化合物.
B、根据分子结构进行分析判断.
C、根据化合物中元素的质量分数进行分析判断.
D、根据1个乙酸分子的构成,进行分析判断ξ
【解答】
解:由乙酸的分子的模型图,1个乙酸分子是由2个碳原子、4个氢原子和2个氧原子构成的,其化学式为:C2H4O2.
A.乙酸是由碳、氢、氧三种元素组成的纯净物,故选项说法正确;
B.由乙酸的分子的模型图,1个乙酸分子是由2个碳原子、4个氢原子和2个氧原子构成的,其化学式为:C2H4O2,故选项说法正确;
C.乙酸中碳元素的质量分数为:12×212×2+1×4+16×2×100%=40%,故选项说法错误.
D.1个乙酸分子是由2个碳原子、4个氢原子和2个氧原子构成的,则乙酸分子中的碳原子、氢原子、氧原子的个数比为2:4:2=1:2:1
第17页 共20页 ◎ 第18页 共20页
,故选项说法正确.
故选:C.
7.
【答案】
D
【考点】
利用分子与原子的性质分析和解决问题
【解析】
根据分子的基本特征:分子质量和体积都很小;分子之间有间隔;分子是在不断运动的;同种的分子性质相同,不同种的分子性质不同,可以简记为:“两小运间,同同不不”,结合事实进行分析判断即可.
【解答】
解:A.水通直流电分解,是因为水分子分裂成了氢原子和氧原子,然后氢原子、氧原子分别重新组合形成氢分子、氧分子,大量的氢分子、氧分子分别聚集成氢气、氧气,该事实说明分子是可以再分的,故A正确;
B."酒香不怕巷子深",是因为酒精中含有的分子是在不断运动的,向四周扩散,使人们闻到酒香,故B正确;
C.水和过氧化氢具有不同的化学性质,是因为它们分子的构成不同,不同种的分子性质不同,故C正确;
D.20mL水与20mL酒精混合后体积小于40mL,是因为分子之间有间隔,一部分水分子和酒精分子会互相占据分子之间的间隔,故D错误;
故选D。
8.
【答案】
C
【考点】
化学性质与物理性质的差别及应用
【解析】
物质的化学性质是指在化学变化中表现出来的性质,物质的物理性质是指不需要通过化学变化表现出来的性质,据此进行分析判断。
【解答】
A、铜丝作导线,是利用了铜的导电性,不需要发生化学变化就能表现出来,是利用了其物理性质;
B、干冰用于人工降雨是利用干冰易升华吸热,使周围空气中温度降低,空气中水蒸气冷凝成水滴,不需要发生化学变化就能表现出来,是利用了其物理性质;
C、天然气作燃料,是利用了天然气的可燃性,需要通过化学变化才表现出来,是利用了其化学性质;
D、金刚石切割玻璃,是利用了金刚石硬度大,不需要发生化学变化就能表现出来,是利用了其物理性质;
9.
【答案】
B
【考点】
原子结构示意图与离子结构示意图
化学符号及其周围数字的意义
【解析】
本题考查化学用语的意义及书写,解题关键是分清化学用语所表达的对象是分子、原子、离子还是化合价,才能在化学符号前或其它位置加上适当的计量数来完整地表达其意义,并能根据物质化学式的书写规则正确书写物质的化学式,才能熟练准确的解答此类题目。
【解答】
A、金属元素的元素符号可表示这种物质,故Mg可表示为金属镁,故正确;
B、由原子结构示意图的意义可知,该微粒核内质子数为12,核外电子数为10,故为镁离子,故错误;
C、元素化合价的表示方法:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,所以氧化镁中镁元素为+2价,故可表示为:Mg+2O;故正确;
D、根据化学式的意义可知,N2可表示1个氮分子由2个氮原子构成,故正确;
10.
【答案】
A
【考点】
一定溶质质量分数的溶液的配制
【解析】
溶质质量分数变大,则可能是溶质质量偏大或溶剂质量偏小,可以分析出可能造成这两个方面错误的原因进行分析判断即可。
【解答】
A、量取水时,仰视量筒读数,读数比实际液体体积小,会造成实际量取的水的体积偏大,则使溶质质量分数偏小,故选项正确;
B、将量筒中的水倒入烧杯时有水溅出,会造成实际水的体积偏小,则使溶质质量分数偏大,故选项错误;
C、将水倒入烧杯时,有少量水溅出,会造成实际所取的水的体积偏小,会使溶质质量分数偏大,故选项错误;
D、溶解时未用玻璃棒搅拌,会影响溶解的速率,而不会影响溶质的质量分数,故选项错误;
故选:A。
11.
【答案】
C
【考点】
检查装置的气密性
酒精灯的使用
液体药品的取用
过滤的原理、方法及其应用
【解析】
A、根据液体药品的取用方法进行分析判断;
B、根据酒精灯的使用方法进行分析判断;
C、根据检查装置气密性的方法进行分析判断;
D、根据过滤液体时,要注意“一贴、二低、三靠”的原则进行分析判断.
【解答】
A、取用液体药品时,瓶塞要倒放,标签要对准手心,瓶口紧挨;图中所示操作错误;
B、使用酒精灯时要注意“两查、两禁、一不可”,点燃酒精灯要用火柴点燃,禁止用一酒精灯去引燃另一酒精灯,图中所示操作错误;
C、检查装置气密性的方法:把导管的一端浸没在水里,双手紧贴容器外壁,若导管口有气泡冒出,装置不漏气;图中所示操作正确;
D、过滤液体时,要注意“一贴、二低、三靠”的原则,图中缺少玻璃棒引流,图中所示操作错误。
12.
【答案】
C
【考点】
第17页 共20页 ◎ 第18页 共20页
反应类型的判定
【解析】
化合反应:两种或两种以上物质反应后生成一种物质的反应,其特点可总结为“多变一”;物质与氧发生的化学反应是氧化反应;分解反应:一种物质反应后生成两种或两种以上的物质,其特点可总结为“一变多”;据此进行分析判断.
【解答】
解:乙醇+氧气======点燃水+二氧化碳该反应的反应物和生成物都是两种,不符合“多变一”和“一变多”的特征,不属于化合反应,也不属于分解反应,是物质与氧发生的反应,属于氧化反应,c处可表示的化学反应是氧化反应.
故选:C
13.
【答案】
C
【考点】
纯净物和混合物的概念及判别
【解析】
依据混合物有多种分子构成,纯净物由一种分子构成分析解答
【解答】
A、表示的是一种分子,属于纯净物,由一种元素组成,属于单质;
B、表示的是一种分子,属于纯净物,由一种元素组成,属于单质;
C、含有两种分子,所以C中含有两种物质是混合物;
D、表示的是一种分子,属于纯净物,由两种元素组成,属于化合物.
故选C.
14.
【答案】
B
【考点】
元素质量比的计算
元素的质量分数计算
相对分子质量的概念及其计算
【解析】
A、根据相对分子质量为构成分子的各原子的相对原子质量之和,进行分析判断.
B、根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析判断.
C、根据化合物中元素的质量分数=××100%,进行分析判断.
D、根据乙硫醇易挥发,有蒜臭味,人对该气味极其敏感,进行分析判断.
【解答】
A、乙硫醇的相对分子质量为12×2+1×6+32=62,故选项说法正确。
B、乙硫醇中C、H、S三种元素的质量比是(12×2):(1×6):(32×1)≠2:6:1,故选项说法错误。
C、硫元素的质量分数是3212×2+1×6+32×100%,故选项说法正确。
D、乙硫醇易挥发,有蒜臭味,人对该气味极其敏感,在管道煤气中添加微量乙硫醇,目的是及时发现煤气泄漏,故选项说法正确。
故选:B。
15.
【答案】
A
【考点】
元素周期表的特点及其应用
【解析】
原子中,核电荷数=核内质子数=核外电子数=原子序数;
相对原子质量=质子数+中子数.
【解答】
解:A、由元素周期表中的信息可知,锌元素的相对原子质量为65.38,该选项说法正确;
B、由元素周期表中的信息可知,锌原子核内有30个质子,该选项说法不正确;
C、锗属于金属元素,该选项说法不正确;
D、锗原子中的中子数为:73−32=41,该选项说法不正确.
故选:A.
16.
【答案】
D
【考点】
溶质的质量分数
晶体和结晶的概念与现象
【解析】
根据题意,一杯70∘C的硝酸钾饱和溶液,冷却后有晶体析出(晶体不含结晶水),不考虑溶剂的蒸发,则所得溶液中溶质的质量减少、溶剂的质量不变,结合饱和溶液与不饱和溶液的特征、溶质的质量分数等,进行分析判断。
【解答】
A、一杯70∘C的硝酸钾饱和溶液,冷却后有晶体析出,剩余溶液不能继续溶解硝酸钾,仍为饱和溶液,故选项说法错误。
B、一杯70∘C的硝酸钾饱和溶液,冷却后有晶体析出,溶质的质量减少,故选项说法错误。
C、一杯70∘C的硝酸钾饱和溶液,冷却后有晶体析出,溶质的质量减少,溶剂的质量不变,则溶液质量减少,故选项说法错误。
D、一杯70∘C的硝酸钾饱和溶液,冷却后有晶体析出,溶质的质量减少,溶剂的质量不变,则溶质的质量分数减小,故选项说法正确。
故选:D。
二、填空题(本题每空1分,共22分)
【答案】
2H
N2
H2O
Na+
【考点】
化学符号及其周围数字的意义
【解析】
第17页 共20页 ◎ 第18页 共20页
本题考查化学用语的意义及书写,解题关键是分清化学用语所表达的对象是分子、原子、离子还是化合价,才能在化学符号前或其它位置加上适当的计量数来完整地表达其意义,并能根据物质化学式的书写规则正确书写物质的化学式,才能熟练准确的解答此类题目.
【解答】
解:(1)原子的表示方法就是用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字.所以2个氢原子,就可表示为:2H;
(2)保持氮气化学性质的最小微粒是氮分子,其化学式为:N2;
(3)相对分子质量最小的氧化物是水,其化学式为:H2O;
(4)氯化钠中的阳离子是钠离子,根据离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.故钠离子可表示为:Na+;
【答案】
混合物
肥皂水
过滤,玻璃棒,引流,煮沸,氮元素
吸附,+1
【考点】
硬水与软水
过滤的原理、方法及其应用
水的净化
纯净物和混合物的概念及判别
有关元素化合价的计算
【解析】
(1)根据湖水、河水、海水等自然界中的水都是混合物解答;
(2)根据硬水和软水的区分方法解答;
(3)①根据过滤可以把不溶于水的物质除去和过滤所需的玻璃仪器,活性炭具有吸附作用,能够吸收色素和异味解答;
②根据煮沸能降低水的硬度解答;
③根据元素的知识解答;
(4)根据吸附作用和根据化学式求某元素的化合价解答.
【解答】
解:(1)湖水、河水、海水等自然界中的水都是混合物;
(2)硬水和软水的区分方法是加入肥皂水易产生泡沫的是软水,不易产生泡沫的是硬水;
(3)①向水样中加入明矾搅拌溶解,静置一段时间后,进行过滤,除去固体小颗粒,过滤要用到烧杯、漏斗和玻璃棒三种玻璃仪器,玻璃棒起引流作用;
②煮沸能降低水的硬度;
③含氮的物质进入水中会造成水中藻类大量繁殖,使水质恶化.这里的“氮”是指氮元素;
(4)向滤液中加入活性炭,利用其吸附性除去水样中的颜色和异味;设Ca(ClO)2中氯元素的化合价为x,则+2+[x+(−2)]=0,x=+1;
【答案】
原子,分子
A
7,最外层电子数,质子数
【考点】
元素的概念
原子结构示意图与离子结构示意图
分子、原子、离子、元素与物质之间的关系
核外电子在化学反应中的作用
【解析】
(1)根据汞属于金属,是由原子构成的,水是由水分子构成解答;
(2)A、根据物质是由元素组成进行解答;
B、根据氯化氢属于纯净物进行解答;
C、根据物质是由元素组成,分子是由原子构成进行解答;
(3)
①根据“原子序数=核内质子数=核外电子数”,可求x的数值。
②根据元素的化学性质跟它的原子的最外层电子数目关系非常密切,进行分析解答。
③根据质子数决定元素的种类解答。
【解答】
汞属于金属,是由原子构成的,水是由水分子构成;
A、氯化氢是由氢、氯两种元素组成的,故A正确;
B、氯化氢属于纯净物,是由氢、氯两种元素组成的,故B错误;
C、氯化氢是由氢、氯两种元素组成的,一个氯化氢分子是由一个氢原子和一个氯原子构成的,故C错误;
①根据“原子序数=核内质子数=核外电子数”,则17=2+8+x,解得x=7;
②元素的化学性质跟它的原子的最外层电子数目关系非常密切,最外层电子数相同的元素化学性质相似,氧元素和硫元素化学性质相似的原因是它们的原子的最外层电子数相同;
③氧和氯两种元素最本质的区别是它们原子中的质子数不同。
【答案】
(1)NaCl
(2)C
(3)③①②④
(4)0.1%
【考点】
一定溶质质量分数的溶液的配制
溶液、溶质和溶剂的相互关系与判断
溶解时的吸热或放热现象
有关溶质质量分数的综合计算
【解析】
此题暂无解析
【解答】
(1)氯化钠常用于配制生理盐水,其溶质是NaCl。
第17页 共20页 ◎ 第18页 共20页
(2)质溶于水分为两个过程,向水中扩散的过程吸收热量,与水分子结合形成水合分子的过程放出热量,如果吸收热量大于放出热量,就表现为吸热,如果吸收热量小于放出热量,就表现为放热,如果相等就表现为既不放热,也不吸热;
A.氯化钠溶于水溶液温度基本不变,故错误;
B.硝酸铵溶于水吸收热量,溶液温度降低,故错误;
C.氢氧化钠溶于水放出热量,溶液温度升高,故正确。
故选C。
(3)配制50g溶质质量分数为6%的NaCl溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解、装瓶,故正确的操作顺序是③①②④。
(4)因为溶液的密度是1g/cm3,所以可直接看成毫升数即是物质的克数,然后利用溶质的质量分数=溶质质量溶液质量×100%计算即可;
溶质的质量=1.0g;
溶液的质量=4.0mL×1g/cm3=4.0cm3×1g/cm3=4.0g;
所以,溶液a中溶质的质量分数=1.0g4.0g×100%=25%;
溶液b的质量分数=0.1×25%1=2.5%;
溶液c的质量分数=0.1×2.5%1=0.25%;
溶液d的质量分数=0.4×0.25%1=0.1%。
三、实验与探究(每空1分,本题共20分)
【答案】
⑤,①
蒸发皿内出现大量固体,氢氧化钠和砝码位置放反了
【考点】
托盘天平的使用
蒸发与蒸馏操作
常用仪器的名称和选用
【解析】
(1)细口瓶常用于液体药品的保存;试管用作反应容器且能够直接加热;
(2)根据蒸发、托盘天平的使用方法分析解答.
【解答】
细口瓶常用于液体药品的保存;故填:⑤;试管用作反应容器且能够直接加热;故填:①;
①图甲所示的蒸发操作中,实验结束要等蒸发皿内出现大量固体时,再熄灭酒精灯,利用蒸发皿的余热蒸干;
②图乙表示称量固体氢氧化钠的质量,出现的错误是氢氧化钠和砝码的位置放反了,会导致称量的氢氧化钠质量减小;
故答案为:(1)⑤;①;(1)①蒸发皿内出现大量固体;②氢氧化钠和砝码位置放反了.
【答案】
试管,集气瓶
B,2H2O2======MnO22H2O+O2↑,检查装置的气密性
D,没有等到导管口有连续均匀的气泡产生就开始收集(或集气瓶装水时留有气泡)
a,将带火星的木条放于b导管口处,若木条复燃则满,b
难溶于水,密度比空气小
ABD,防止熔化物溅落到瓶底,炸裂瓶底,Fe+O2→点燃 Fe3O4,P+O2→点燃 P2O5
【考点】
氧气的制取装置
氧气的化学性质
氧气的收集方法
书写化学方程式、文字表达式
【解析】
(1)根据常用仪器的名称、用途和使用方法进行分析;
(2)通常情况下,过氧化氢在二氧化锰的催化作用下,分解生成水和氧气;凡是有气体参加或产生的实验,实验前一定要检查装置的气密性,以防装置漏气影响实验结果;
(3)收集较纯净的气体通常用排水法,并据排水法收集气体的注意事项分析解答;
(4)氧气密度比空气大,所以应从长管进气,将带火星的木条放于短管处,观察木条是否复燃进行验满;氧气密度比水小,应从短管进气,长管便于排水;
(5)可用排水法或向下排空气法收集,说明其难溶于水、密度比空气小;
(6)①根据反应的特点进行解答反应的相同点;
②根据铁丝、硫在氧气中燃烧的实验操作步骤及注意事项,进行解答;
③根据反应物、生成物进行书写即可.
【解答】
解:(1)图中所示装置中标有序号的仪器名称为:①是试管,常用作反应容器;②是集气瓶,常用来收集气体;
(2)实验室中用过氧化氢溶液与二氧化锰混合制取氧气不需要加热,应该用B装置作为发生装置;过氧化氢在二氧化锰的催化作用下生成水和氧气,反应的符号表达式为:2H2O2======MnO22H2O+O2↑;制取气体时,组装好仪器后,应先检查装置的气密性,再添加药品;
(3)因为氧气的密度比空气大,可以用向上排空气法收集,即用C装置收集,氧气不易溶于水,可以用排水法收集,即用D装置收集,用排水法收集的氧气比用排空气法收集的氧气纯净;如果导管口刚出现气泡就开始收集,或集气瓶装水时留有气泡,都能够导致收集的氧气不纯;
(4)氧气密度比空气大,所以应从长管进气;将带火星的木条放于短管处,观察木条是否复燃进行验满;氧气密度比水小,应从短管进气,长管便于排水;
(5)可用排水法或向下排空气法收集,说明其难溶于水、密度比空气小;
(6)
第17页 共20页 ◎ 第18页 共20页
①铁与氧气反应生成四氧化三铁固体,磷与氧气反应生成五氧化二磷固体,硫与氧气反应生成二氧化硫气体,这三个反应都是化合反应,都是与氧气反应,是氧化反应,反应都需要点燃,都有发光放热现象,故ABD;
四、计算题(本题共10分)
【答案】
40×3+(31+16×4)×2
60:31:64,38.7%
2
【考点】
标签上标示的物质成分及其含量
相对分子质量的概念及其计算
元素质量比的计算
元素的质量分数计算
【解析】
(1)根据相对分子质量为构成分子的各原子的相对原子质量之和,进行分析解答.
(2)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,化合物中元素的质量分数=相对原子质量×原子个数相对分子质量×100%,进行分析解答.
(3)通常中学生每天需从牛奶中补充550mg的钙,若一盒牛奶为250mL,由标签,每100mL含钙110mg,据此进行分析解答.
【解答】
解:(1)磷酸钙的相对分子质量为310,其计算式为40×3+(31+16×4)×2.
(2)磷酸钙中钙、磷、氧三种元素的质量比为(40×2):(31×2):(16×4×2)=60:31:64.
其中钙元素的质量分数为40×2310×100%≈38.7%.
(3)通常中学生每天需从牛奶中补充550mg的钙,若一盒牛奶为250mL,由标签,每100mL含钙110mg,则理论上每天应喝550mg÷110mg/mL÷250mL=2盒.
【答案】
(1)24
(2)100
【考点】
有关溶质质量分数的综合计算
用水稀释改变浓度的方法
【解析】
此题暂无解析
【解答】
(1)溶质质量=溶液质量×溶质的质量分数,配制120kg溶质质量分数为20%的食盐溶液,需要取用固体食盐的质量为120kg×20%=24kg。
(2)设稀释成12%的食盐溶液的质量为x,根据溶液稀释前后,溶质的质量不变,
则60kg×20%=x×12% x=100kg。
第17页 共20页 ◎ 第18页 共20页
您可能关注的文档
相关文档
- 【物理】广东省深圳外国语学校20192021-04-16 10:54:4711页
- 2020年安徽省中考语文试题卷及答案2021-04-16 10:54:1911页
- 2018-2019学年广东省佛山市第一中2021-04-16 10:54:018页
- 济南市初三年级学业水平考试物理部2021-04-16 10:53:275页
- 【物理】湖北省随州一中2019-20202021-04-16 10:53:2317页
- 【语文】山西省2019-2020学年高二2021-04-16 10:53:0622页
- 【2020年中考化学,含答案,word版,可再2021-04-16 10:52:2811页
- 广东省中考语文古诗文默写及答案2021-04-16 10:52:0611页
- 数学卷·2019届陕西省渭南市尚德中2021-04-16 10:50:3013页
- 中考总复习质量守恒定律和化学方程2021-04-16 10:50:176页