- 673.52 KB
- 2021-04-15 发布
化学试卷第1页共 8 页
2020 年天津市十二区县重点学校高三毕业班联考(二)
化学试卷
本试卷分为第 I 卷(选择题)和第 II 卷(非选择题)两部分,共 100 分,考试用时 60
分钟。第 I 卷 1 至 4 页,第 II 卷 5 至 8 页。
答卷前,考生务必将自己的姓名、考生号填写在答题卡上,并在规定位置粘贴考试用
条形码。答题时,考生务必将答案涂写在答题卡上,答在试卷上的无效。
祝各位考生考试顺利!
第 I 卷
注意事项:
1.每题选出答案后,用铅笔将答题卡上对应题目的答案标号涂黑。如需改动,用
橡皮擦干净后,再选涂其他答案标号。
2.本卷共 12 题,每题 3 分,共 36 分。在每题给出的四个选项中,只有一项是最
符合题目要求的。
以下数据可供解题时参考:
相对原子质量:H:1 C:12 N:14 O:16 P:31 S:32 Cl:35.5 Zn:65
1. 我国在很多工程领域取得了举世瞩目的成就,以下使用的材料中属于有机高分子的是
A.“玉兔”月球车太
阳能电池帆板——硅
B.高铁轨道与地基
之间填隙减震——
聚氨酯
C.港珠澳大桥桥墩
——混凝土
D.“人造太阳”核聚
变实验装置——钨
合金
2.2019 年 8 月《Science》杂志报道,化学家首次成功合成具有半导体特性的环状 C18 分
子(结构如图),关于 C18 说法正确的是
A.与石墨互为同位素
B.属于烃类
C.是原子晶体
D.能与氢气在一定条件下反应
化学试卷第2页共 8 页
3.下列各项表达中正确的是
A.N2H4 的结构式
B.已知 SCN-中每个原子都达到 8 电子结构,则其电子式为
C.比例模型 可以表示二氧化碳分子,也可以表示二氧化硫分子
D.全降解塑料 可由环氧丙烷( )和 CO2 缩聚制得
4.下列有关物质性质与用途具有对应关系的是
A.SO2 既可以杀菌又具有还原性,在葡萄酒中可以微量添加
B.Na2SiO3 易溶于水,可用于生产黏合剂和防火剂
C.Al2O3 是两性氧化物,可用作耐高温材料
D.Na2O2 具有强氧化性,可用于饮用水消毒
5.下列叙述正确的是
A.第一电离能:Al>Mg>Na B.离子半径:Na+>Al3+>S2-
C.沸点: HF>H2O>H2S D.酸性:HClO4>HClO3>HClO
6.下列离子方程式书写正确的是
A.氢氧化钙溶液与碳酸氢镁溶液反应:
HCO3-+Ca2++OH-=CaCO3↓+H2O
B.向酸性 KMnO4 溶液中加入 NaHSO3 溶液,溶液紫色褪去:
2MnO4
-+5SO32-+6H+===2Mn2++5SO42-+3H2O
C.[Ag(NH3)2]OH 与足量盐酸反应生成 AgCl:
[Ag(NH3)2]++OH-+3H++Cl-=AgCl↓+2NH4++H2O
D.用 KSCN 溶液检验某溶液中含有 Fe3+:Fe3++3SCN-=Fe(SCN)3↓
7.下列说法正确的是
A.标准状况下,5.6L 由 CH4 与 C2H4 组成的混合气体中含有的氢原子数目约为 6.02×1023
B.常温下,将稀 CH3COONa 溶液加水稀释后,n(H+)·n(OH-)不变
C.合成氨生产中将 NH3 液化分离,可加快正反应速率,提高 H2 的转化率
D.久置的油脂变味不能食用,是由于油脂发生了水解反应
化学试卷第3页共 8 页
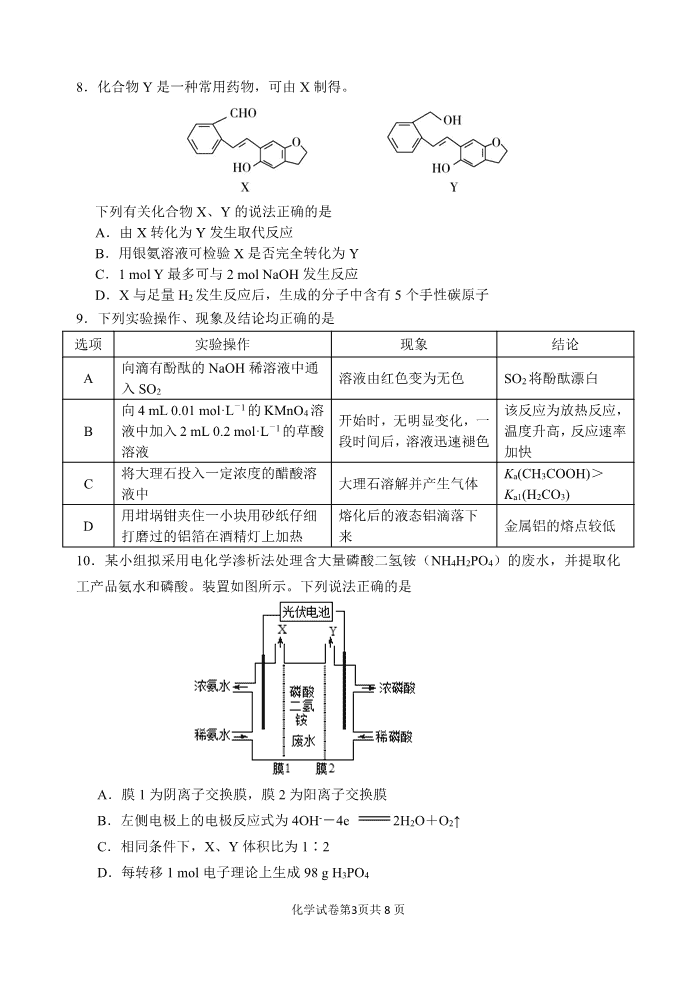
8.化合物 Y 是一种常用药物,可由 X 制得。
下列有关化合物 X、Y 的说法正确的是
A.由 X 转化为 Y 发生取代反应
B.用银氨溶液可检验 X 是否完全转化为 Y
C.1 mol Y 最多可与 2 mol NaOH 发生反应
D.X 与足量 H2 发生反应后,生成的分子中含有 5 个手性碳原子
9.下列实验操作、现象及结论均正确的是
选项 实验操作 现象 结论
A
向滴有酚酞的 NaOH 稀溶液中通
入 SO2
溶液由红色变为无色 SO2 将酚酞漂白
B
向 4 mL 0.01 mol·L-1 的 KMnO4 溶
液中加入 2 mL 0.2 mol·L-1 的草酸
溶液
开始时,无明显变化,一
段时间后,溶液迅速褪色
该反应为放热反应,
温度升高,反应速率
加快
C
将大理石投入一定浓度的醋酸溶
液中 大理石溶解并产生气体 Ka(CH3COOH)>
Ka1(H2CO3)
D
用坩埚钳夹住一小块用砂纸仔细
打磨过的铝箔在酒精灯上加热
熔化后的液态铝滴落下
来 金属铝的熔点较低
10.某小组拟采用电化学渗析法处理含大量磷酸二氢铵(NH4H2PO4)的废水,并提取化
工产品氨水和磷酸。装置如图所示。下列说法正确的是
A.膜 1 为阴离子交换膜,膜 2 为阳离子交换膜
B.左侧电极上的电极反应式为 4OH--4e 2H2O+O2↑
C.相同条件下,X、Y 体积比为 1∶2
D.每转移 1 mol 电子理论上生成 98 g H3PO4
化学试卷第4页共 8 页
11.常温下,几种弱电解质的电离平衡常数如表所示,向 20 mL 0.1 mol/L 的盐酸溶液中逐
滴滴加 0.1 mol/L 的氨水,溶液的 pH 变化曲线如图所示。
下列说法正确的是
A.CH3COONH4 溶液中 c(OH-)=c(H+)≠10-7 mol/L
B.NH+
4 和HCO-
3 能发生彻底水解反应
C.曲线上水的电离程度最大的点为 b 点
D.d 点时,c(OH-)-c(H+)= )]OHNH(2)NH([3
1
234 cc
12.氯化氢直接氧化法制氯气的反应是 4HCl(g)+O2(g)
⇌
2Cl2(g)+2H2O(g)。刚性容器中,进
料浓度比 c(HCl)∶c(O2)分别等于 1∶1、4∶1、7∶1 时,HCl 平衡转化率随温度变化的关
系如图所示。下列说法不正确...的是
A.K(300℃)>K(400℃)
B.增大反应体系的压强和及时分离出氯气都可以提高氯化氢的平衡转化率
C.当 c(HCl)∶c(O2)进料比过低时,HCl 的转化率较低,且不利于分离 O2 和 Cl2
D.若 HCl 的初始浓度为 c,进料比为 1∶1 时,K(500℃)=
2 2
4
(0.36) (0.36)
(1-0.72) (1-0.18)c
化学试卷第5页共 8 页
图 2
图 1
第 II 卷
注意事项:
1.用黑色墨水的钢笔或签字笔将答案写在答题卡上。
2.本卷共 4 题,共 64 分。
13.(14 分)利用物质的结构与性质对周期表进行研究,有助于我们更好地掌握同类知识。
(1)基态砷原子中,价电子占用________个原子轨道;雌黄分子式为 As2S3,
分子结构如图 1 所示,则砷原子的杂化方式为________。
(2)现代化学中,常利用_________上的特征谱线来鉴定元素。Ga 的价层
电子排布式为:_____________。
(3)Cu2+能与乙二胺(H2N—CH2—CH2—NH2)形成配
离子如右图,该配离子中含有的化学键类型有______(填
字母序号)。
A.配位键 B.极性键 C.离子键 D.非极性键
(4)元素的基态气态原子得到一个电子形成气态﹣1 价离子时所放出的能量称作第一电子
亲和能(E),﹣1 价阴离子再获得一个电子的能量变化叫做第二电子亲和能,部分元素或
离子的电子亲和能数据如表所示。
元素 C1 Br I O O—
电子亲和能(kJ/mol) 349 343 295 141 ﹣780
下列说法正确的是 。
A.电子亲和能越大,说明越难得到电子
B.一个基态的气态氧原子得到一个电子成为 O—时放出 141kJ 的能量
C.氧元素的第二电子亲和能是﹣780kJ/mol
D.基态的气态氧原子得到两个电子成为 O2—需要吸收能量
(5)铁和氨气在 640℃可发生置换反应,产物之-的晶胞结构如图 2 所示,写出该反应的
化学方程式______________________。
(6)立方硫化锌晶胞与金刚石晶胞类似,结构如图 3 其中 a 代表 S2-,b 代表 Zn2+。则该
晶胞中 S2-的配位数为______,若晶体的密度为ρg·cm-3,则晶胞的体积为___________cm3。
图 3
化学试卷第6页共 8 页
14.(17 分) 3,4―二羟基肉桂酸乙酯(I)具有抗炎作用和治疗自身免疫性疾病的潜力。由
化合物 A 制备该物质合成路线如下:
已知:
回答下列问题:
(1)A 的结构简式为_________,3,4―二羟基肉桂酸乙酯中含氧官能团的名称是_________。
(2)E 生成 F 的反应类型为_________。
(3)下列有关 H 的说法中,不正确的是_________。
a.能使酸性高锰酸钾溶液褪色
b.1mol H 最多能和 3mol Br2 反应
c.H 分子中最多有 9 个碳原子共平面
d.1mol H 分别与足量 NaOH、NaHCO3 反应时,消耗的 NaOH、NaHCO3 的物质的
量之比为 1:1
(4)写出 F→G 过程中 ①的化学方程式__________________。
(5)已知 W 是 H 的同分异构体,符合下列条件的 W 结构共有___________种。
①属于芳香族化合物。
②1molW 与足量 NaHCO3 溶液反应生成气体 44.8L(标准状况)。
其中,核磁共振氢谱有 4 组吸收峰,且峰面积比为 1∶2∶2∶3 的结构简式为:__________
(写一个即可)
(6)季戊四醇( )是合成高效润滑剂、增塑剂、表面活性剂等的原料。设计由
甲醛和乙醇为原料制备季戊四醇的合成路线(无机试剂任选)。
___________________________________________________________________。
15.(17 分)DCCNa (二氯异氰尿酸钠)固体是一种高效、安全的消毒剂,20℃以上易溶于
水。(CNO)3H3 (氰尿酸)为三元弱酸。
I.制备 DCCA (二氯异氰尿酸)装置如图。主要反应有:
化学试卷第7页共 8 页
碱溶 (CNO)3H3+ 2NaOH
⇌
(CNO)3Na2H + 2H2O ∆H<0
氯化 (CNO)3Na2H +2Cl2
⇌
(CNO)3Cl2H + 2NaCl ∆H<0
回答下列问题:
(1)装置 C 中的溶液是______________,作用为______________。
(2)装置 A 中反应的离子方程式为_______________。
(3)装置 B 用冰水浴的原因是__________,碱溶时若氢氧化钠过量,(CNO)3Na2H 中可能混有
的杂质是__________。
Ⅱ.制备 DCCNa
(4)步骤 II 中过滤洗盐”洗去的盐是__________________。
(5)“中和”反应的化学方程式为_________________。
(6)氯元素含量的测定:称取 0. 1000 g DCCNa 样品,加入一定量醋酸溶液溶解,样品中的氯
元素全部转化成 HClO,再加入足量的 KI 溶液,用淀粉作指示剂,用 0.1000 mol·L-1Na2S2O3
标准溶液滴定生成的碘,消耗标准液 VmL。已知: I2+2S2O32-=2I-+S4O62-,样品中氯元素的
质量分数=__________%
(7)下列操作可能使氯元素的质量分数测定结果偏低的是_______(填字母)。
a.滴定前滴定管未排气泡,滴定后气泡消失
b.滴定后,滴定管尖嘴外还悬着一滴液体
c.锥形瓶内溶液蓝色消失后立即读数
d.读数时,滴定前平视,滴定后俯视
16.(16 分)大气环境中 NOx 的减量化排放受到国内外广泛关注。利用碳还原 NO 的反应
为: 2NO(g)+C(s)
⇌
N2(g)+CO2(g) 。回答下列问题:
(1)该反应在常温下可以自发进行,则反应的∆H________0(填“ ”“ ”或“ ”),有利于提高
NO 平衡转化率的条件是________(任写一条)。
化学试卷第8页共 8 页
(2)以上反应可分为如下四步反应历程,写出其中第三步的反应:
第一步: 2NO= (NO) 2 第二步: (NO) 2+C=N2O+C(O)
第三步:___________ ___ 第四步: 2 C(O)= C+CO2
(3)对比研究活性炭负载钙、镧氧化物的反应活性。在三个反应器中分别加入 C、CaO/C、
La2O3/C,通入 NO 使其浓度达到 0.1mol/L。不同温度下,测得第 2 小时 NO 去除率如图 1
所示:
①据图分析,温度 490℃以下,三种情况下反应的活化能最小的是________(用 a、b、c 表
示);CaO/C、La2O3/C 去除 NO 效果比 C 更好,其依据是________(写一条)。
②上述实验中,490℃时,若测得 CaO/C 对 NO 的去除率为 60%,则可能采取的措施是
________。
A.及时分离出 CO2 B.压缩体积
C.恒容下,向体系中通入氮气 D.改良优化了催化剂
③在 CaO/C 、490℃条件下 0~2h 内的平均反应速率 v(NO)=________ 1 1moL L h ,该
温度下此反应的平衡常数为 121,则反应达平衡时 NO 的去除率为________(保留二位有效
数字)。
(4)利用电化学原理处理 NOx 也是重要的研究方向,装置图 2 中正极的电极反应式为:
__________________________。
相关文档
- 2017-2018学年安徽省师大附中高二2021-04-15 17:09:2010页
- 吉林省辉煌联盟九校2020届高三上学2021-04-15 17:09:2022页
- 2018-2019学年安徽省黄山市徽州区2021-04-15 17:09:088页
- 2018-2019学年吉林省辽源市田家炳2021-04-15 17:08:5911页
- 2017-2018学年广西桂林阳朔中学高2021-04-15 17:08:488页
- 山西省晋中市和诚中学2019-2020学2021-04-15 17:08:3915页
- 北京市朝阳区2021届高三上学期期中2021-04-15 17:08:3531页
- 内蒙古呼和浩特市土默特左旗第一中2021-04-15 17:08:3422页
- 2020年4月普通高等学校招生全国统2021-04-15 17:08:2623页
- 2017-2018学年福建省福建师范大学2021-04-15 17:08:1929页