- 540.00 KB
- 2021-04-15 发布
长沙市第一中学2016-2017学年高二上学期第二次阶段性检测
化学
一、选择题(本題共16小题,每小题3分,共48分,在每小題给出的四个选项中,只有一项是符合題目要求的)
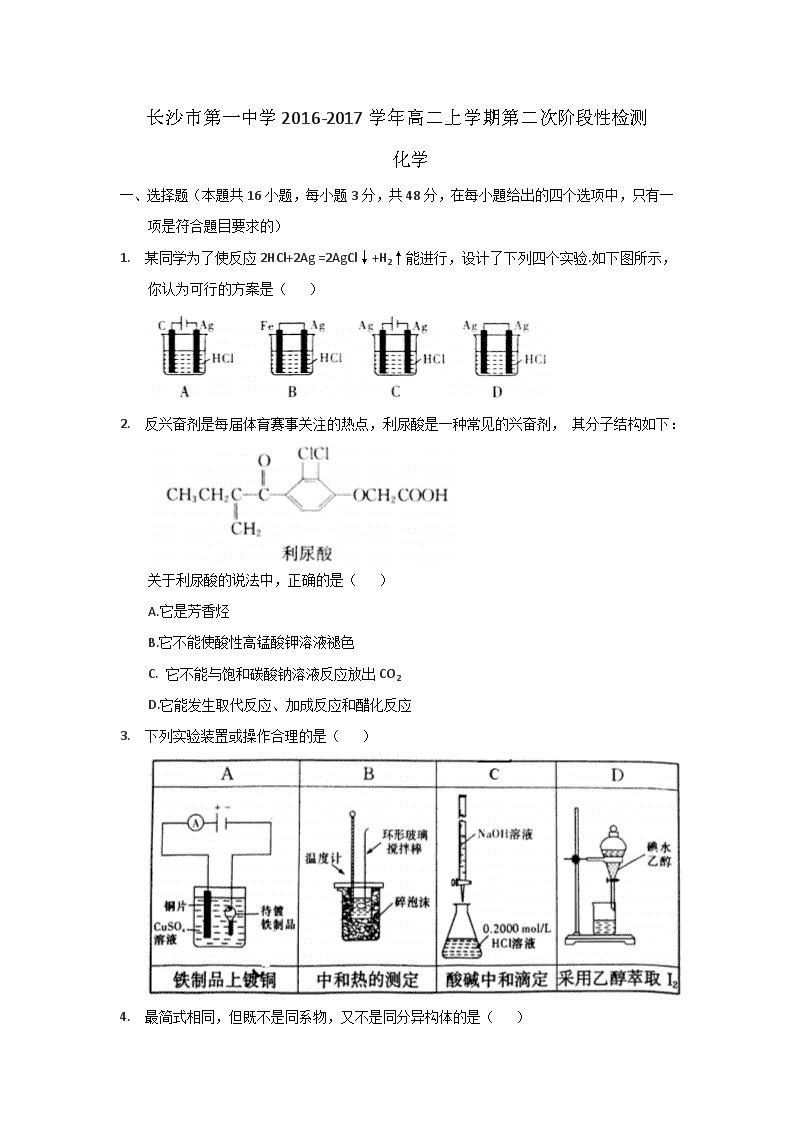
1. 某同学为了使反应2HCl+2Ag =2AgCl↓+H2↑能进行,设计了下列四个实验.如下图所示,你认为可行的方案是( )
2. 反兴奋剂是每届体育赛事关注的热点,利尿酸是一种常见的兴奋剂, 其分子结构如下:
关于利尿酸的说法中,正确的是( )
A.它是芳香烃
B.它不能使酸性高锰酸钾溶液褪色
C. 它不能与饱和碳酸钠溶液反应放出CO2
D.它能发生取代反应、加成反应和醋化反应
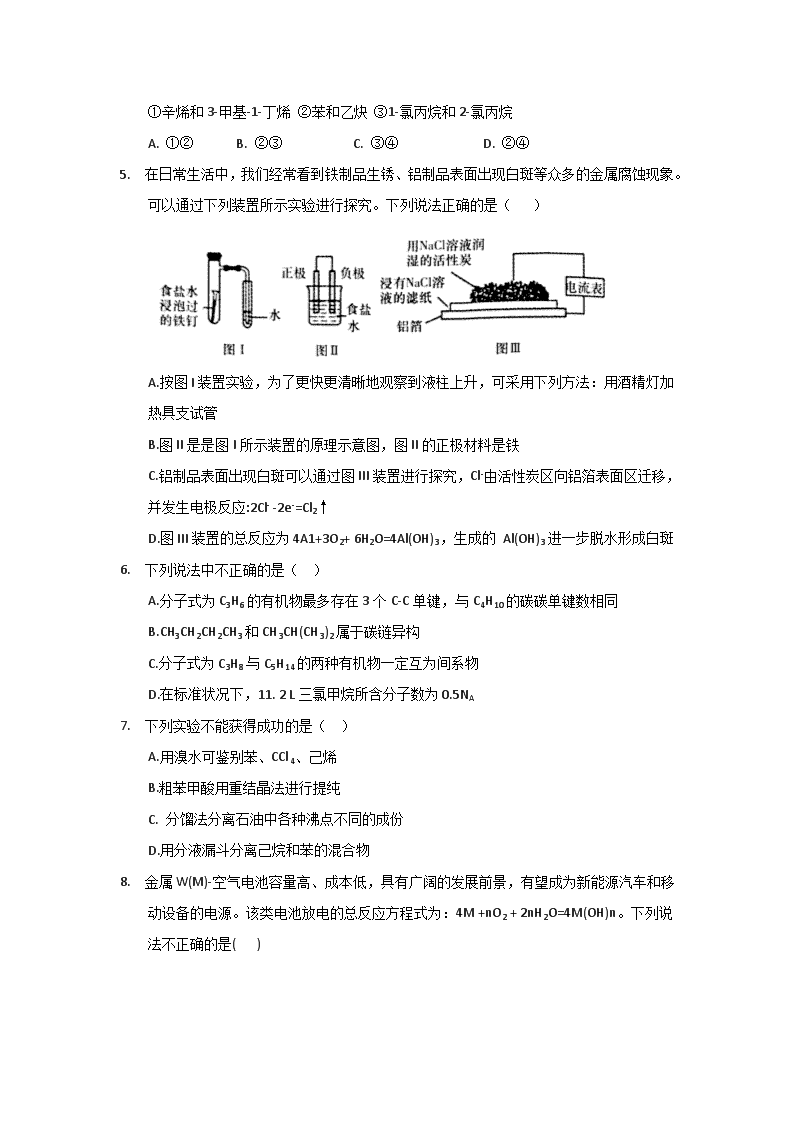
3. 下列实验装置或操作合理的是( )
4. 最简式相同,但既不是同系物,又不是同分异构体的是( )
①辛烯和3-甲基-1-丁烯 ②苯和乙炔 ③1-氯丙烷和2-氯丙烷
A. ①② B. ②③ C. ③④ D. ②④
5. 在日常生活中,我们经常看到铁制品生锈、铝制品表面出现白斑等众多的金属腐蚀现象。可以通过下列装置所示实验进行探究。下列说法正确的是( )
A.按图I装置实验,为了更快更清晰地观察到液柱上升,可采用下列方法:用酒精灯加热具支试管
B.图II是是图I所示装置的原理示意图,图II的正极材料是铁
C.铝制品表面出现白斑可以通过图III装置进行探究,Cl-由活性炭区向铝箔表面区迁移,并发生电极反应:2Cl- -2e-=Cl2↑
D.图III装置的总反应为4A1+3O2+ 6H2O=4Al(OH)3,生成的 Al(OH)3进一步脱水形成白斑
6. 下列说法中不正确的是( )
A.分子式为C3H6的有机物最多存在3个C-C单键,与C4H10的碳碳单键数相同
B.CH3CH2CH2CH3和CH3CH(CH3)2属于碳链异构
C.分子式为C3H8与C5H14的两种有机物一定互为间系物
D.在标准状况下,11. 2 L三氯甲烷所含分子数为0.5NA
7. 下列实验不能获得成功的是( )
A.用溴水可鉴别苯、CCl4、己烯
B.粗苯甲酸用重结晶法进行提纯
C. 分馏法分离石油中各种沸点不同的成份
D.用分液漏斗分离己烷和苯的混合物
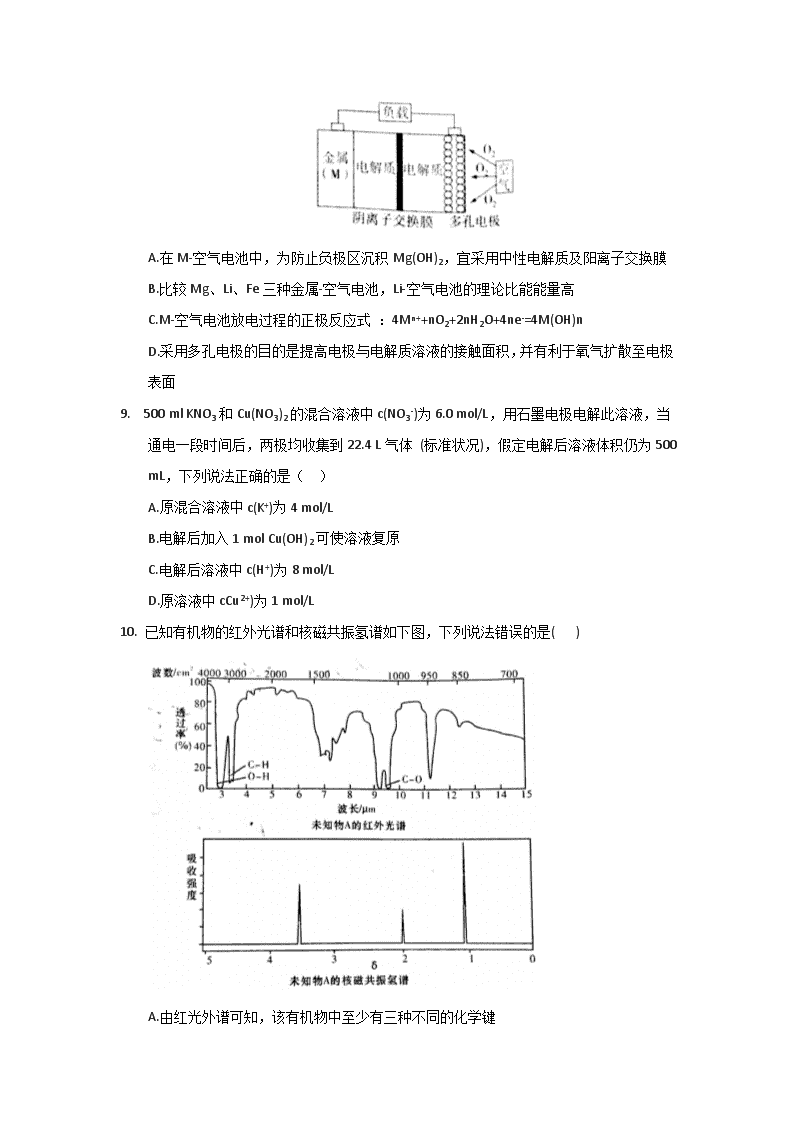
8. 金属W(M)-空气电池容量高、成本低,具有广阔的发展前景,有望成为新能源汽车和移动设备的电源。该类电池放电的总反应方程式为:4M +nO2 + 2nH2O=4M(OH)n。下列说法不正确的是( )
A.在M-空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
B.比较Mg、Li、Fe三种金属-空气电池,Li-空气电池的理论比能能量高
C.M-空气电池放电过程的正极反应式 :4Mn++nO2+2nH2O+4ne-=4M(OH)n
D.采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
9. 500 ml KNO3和Cu(NO3)2的混合溶液中c(NO3-)为6.0 mol/L,用石墨电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体 (标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
A.原混合溶液中c(K+)为4 mol/L
B.电解后加入1 mol Cu(OH)2可使溶液复原
C.电解后溶液中c(H+)为8 mol/L
D.原溶液中cCu2+)为1 mol/L
10. 已知有机物的红外光谱和核磁共振氢谱如下图,下列说法错误的是( )
A.由红光外谱可知,该有机物中至少有三种不同的化学键
B.由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子
C.仅由其核磁共振氢谱无法得知其分子中的氢原子总数
D.若A的化学式为C3H6O,则其结构简式为CH3COCH3
11. 下列说法不正确的是( )
A. 名称为对二甲苯
B.室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液pH<7
C.钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其腐蚀
D.CH3OH可看成是由-CH3和-OH两种官能团组成
12. 下列说法正确的是( )
A. 的一溴代物和一溴代物都有4种(考虑立体异构)
B. CH3CH=CHCH3分子中的所有原子在同一平面上
C.等物质的量的乙炔、乙醛、HOCH2CH2OH完全燃烧时耗氧量不相等
D. 与互为同系物
13. 卤素互化物与卤素单质性质相似。已知CH2 = CH—CH=CH2(1,3-丁二烯)与氯气发生加成反应,产物有三种:
①CH2Cl—CHC1—CH=CH2 (1,2-加成)
②CH2Cl—CH=CH—CH2C1 (1,4-加成)
③CH2C1—CHC1—CHCl-CH2Cl(完全加成)
据此推测CH2=C(CH3)-CH=CH2(异戊二稀)与卤素互化物BrCl的加成产物有几种(不考虑立体异构)
A.6 种 B. 10种 C.12 种 D. 14种
14. 下图是某学习小组设计的一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。下列有关说法正确的是( )
A.图1把化学能转化势电能,图2把电能转化为化学能,水得到了循环使用
B.当有0.1 mol电子转移时,b极产生0.56 LO2
C.c极上发生的电极反应是:O2+4e-+4H+=2H2O
D.图2中电子从c极流向d极,提供电能
15. 丙烷的分子结构可简写成键线式结构,有机物A的键线式结构为,有机物B与等物质的量的H2发生加成反应可得到有机物A,下列有关说法错误的是( )
A.有机物A的分子式为C8H18
B.用系统命名法命名有机物A,名称为2,2,3-三甲基戊烷
C. 的名称为2,4,4-三甲基戊烷
D B的结构可能有3种,其中一种的名称为3,4,4-三甲基-2-戊烯
16. 如图所示,装置(I)是一种可充电电池的示意图,装置(II)为电解池的示意图装置;(I)的离子交换膜只允许Na+通过。电池充、放电的化学方程式为:2Na2S2+NaBr3Na2S4+3NaBr。当闭合K时,X极附近溶液先变红色。下列说法正确的是( )
A.装置(I)中Na+从右到左通过离子交换膜
B.A电极的电极反应式为NaBr3+2Na++2e-=3NaBr
C.X电极的电极反应式为2C1- -2e-=Cl2↑
D.每有0.1 mol Na+通过离子交换膜,X电极上就析出标准状况下的气体1.12 L
(1)某学生认为,铁电极可能参与反应,并对产物作出假设:
假设1:铁参与反应,被氧化生成Fe2+;
假设2:铁参与反应,被氧化生成Fe3+;
假设3:______________。
(2)为了探究假设1、2,他采取如下操作:
①取0.01 mol/L FeCl3溶液2 mL于试管中,加入过量铁粉;
②取操作①试管的上层清液加入2滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③取少量正极附近溶液加入2滴K3[Fe(CN)6]溶液,未见蓝色沉淀生成;
④取少量正极附近溶液加入2滴KSCN溶液,未见溶液变红。
据②、③、④现象得出的结论是___________。
(3)该实验原理可应用于防护钢铁腐蚀,请再举一例防护钢铁腐蚀的措施_______。
II.(4)为了提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通
入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-。电池工作时正极反应式为___________________。
18. (12分)请按要求填空:
(1)甲基的电子式:_______。
(2)写出下列各种有机物的结构简式:
①2,3-二甲基-4-乙基己烷:_____________
②支链只有一个乙基且相对分子质量最小的烷烃:___________。
(3)充分燃烧2. 8 g某有机物A,生成8. 8gCO2和3. 6gH2O,这种有机物蒸气的相对密度是相同条件下N2的2倍。
①该有机物的分子式为________。
②该有机物链状同分异构体(不考虑立体异构)的结构简式为:________。
(4)已知乳酸的结构简式为:。乳酸分子中含有_______ 和_____两种官能团(填官能团名称)。
19. (12分)很多电解过程都会产生氢气。
(1) 在25℃时,用石墨电极电解一定量的饱和Na2CO3溶液,则阳极电极反应式为______,溶液pH________(填“增大”、“减小”或“不变”)。
(2)电解法制取Na2FeO4,同时可获得氢气:Fe+2H2O+2OH-FeO42-+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42-,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知Na2FeO4只在强碱性条件下稳定,易被H2还原
①阳极电极反应式_______,电解一段时间后,c(OH-)降低的区域在_______(填“阴极室”或
“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是:________。
③c(Na2FeO4)随初始c(NaOH)的变化如图2,分析N点c(Na2FeO4)低于最高值的原因 _____________。
20.(12分)目前人们对环境保护、新能源开发很重视。
(1) 用于发射“天宫一号”的长征二号火箭的燃料是液态偏二甲肼(CH3)2N—NH2,氧化剂是液态四氧化二氮,二者在反应过程中放出大量能量,同时生成无毒、无污染的气体。已知室温下, 0.1 mol燃料完全燃烧释放出的能量为255 kJ,请写出该反应的热化学方程式 :_________。
(2) 汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体。
4CO(g)+2NO2(g)4CO2(g)+N2(g) △H=-1200 kJ • mor-1。
对于该反应,温度不同(T2>T1),其他条件相同时,下列图像正确的是_____(填代号)。
(3)体积为l0mL PH=2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程pH变化如图,则HX的电离平衡常数_____(填“大于”、“等于”或“小于”)醋酸的平衡常数,稀释后,HX 溶液中水电离出来的c(H+)______醋酸溶液中水电离出来的c(H+)(填“大于” “等于”或“小于”)。
(4)已知常温下Kw[Fe(OH)3] = 4.0×10-38,在FeCl3溶液中加入NaHCO3溶液,发生反应的离子方程式为__________。若所得悬浊液的pH调整为4,则溶液中Fe3+的浓度为
______mol/L。
21.(8分)富铁铝土矿(主要含有Al2O3、Fe2O3、FeO和SiO2)可制备新型净水剂液体聚合硫酸铝铁[AlaFeb(OH)m(SO4)n]。研究发现,当a=b时净水效果最好。工艺流程如图(部分操作和产物略):
(1) Al2O3与H2SO4发生反应的离子方程式是 _____________。
(2) 将溶液A电解得到液体聚合硫酸铝铁。装罝如图所示(阴离子交换膜只允许阴离子通过,电极为惰性电极)
① 阴极室的电极反应式是____________。
② 电解过程阳极室溶液pH的变化是________(填“增大”、“减小”或“不变”)。
③ 简述在反应室中生成液体聚合硫酸铝铁的原理_________________。