- 433.50 KB
- 2021-04-15 发布
1
专题强化训练(十三)
能力练(20 分钟)
1.(2019·洛阳第二次统考)工业上常从一种合成气(主要成分为 CO2、H2)中分离合成甲
醇所需的氢气。H2 提纯过程示意图如图所示:
(1)吸收池中发生反应的离子方程式是_________。
(2) 用 电 极 反 应 式 和 离 子 方 程 式 表 示 K2CO3 溶 液 的 再 生 原 理
_______________________________________。
[解析] (1)结合题图可知,在吸收池中,K2CO3 溶液吸收合成气的 CO2 生成 KHCO3,其
离子方程式为 CO2-3 +CO2+H2O===2HCO-3 。(2)用惰性电极电解 KHCO3 溶液时,阴极反应为 2H2O
+2e-===H2↑+2OH-,OH-与 KHCO3 反应,使 K2CO3 溶液再生。
[答案] (1)CO2+H2O+CO2-3 ===2HCO-3
(2)2H2O+2e-===H2↑+2OH-
HCO-3 +OH-===CO2-3 +H2O
2.(2019·山东师大附中二模)(1)水合肼(N2H4·H2O)是一种重要的化工原料,在医药、
农业及燃料上都有着广泛的应用。目前,我国生产水合肼均采用尿素法,即利用 NaClO 溶液、
NaOH 溶 液 与 尿 素 [CO(NH2)2] 反 应 制 得 粗 肼 (N2H4) 。 生 成 粗 肼 反 应 的 化 学 方 程 式 为
_______________________________。
(2)火箭发射时可用肼(N2H4)作燃料,二氧化氮作氧化剂,生成无毒害的物质,写出反
应方程式:_____________________。
[解析] (1)[CO(NH2)2]中氮元素为-3 价,N2H4 中氮元素为-2 价,结合 NaClO 有强氧
化性就可以理解该反应的原理:NaClO 把[CO(NH2)2]氧化为 N2H4,而 NaClO 一般被还原为 Cl
-,CO(NH2)2 中的+4 价碳元素在碱性条件下以 CO 2-3 存在;结合原子守恒可得出反应方程式:
NaClO+CO(NH2)2+2NaOH===N2H4+H2O+Na2CO3+NaCl。
(2)N2H4、NO2 中氮元素分别为-2、+4 价,两者发生归中反应生成对环境无害的 N2,根
据电子守恒可写出方程式:2N2H4+2NO2===3N2+4H2O。
[答案] (1)NaClO+CO(NH2)2+2NaOH===N2H4+H2O+Na2CO3+NaCl
(2)2N2H4+2NO2===3N2+4H2O
3.(2019·石家庄一模)一种从石煤(含 SiO2、V2O3、V2O5 和少量 Fe2O3)中提取 V2O5 的流
程如下:
2
(1)酸浸时生成 VO2+的反应的离子方程式为_________________。
(2)氧化时发生反应的离子方程式为_______________。
(3)全钒液流储能电池的工作原理为:VO2++V3++H2O
充电
放电 VO+2 +V2++2H+。充电时,
阳极的电极反应式为_________;两极区被质子交换膜隔开,放电时,若外电路通过 2 mol e
-,则正极区溶液中 n(H+)________(填“增加”或“减少”)________mol。
[解析] (1)酸浸时,加入硫酸并通入氧气,显然 V2O5 转化为 VO+2 ,而 VO2+是 V2O3 被 O2
氧化的产物,由 V2O3→2VO2+失 2e-、O2→2H2O 得 4e-,根据得失电子守恒可知,V2O3、O2 的
化学计量数之比为 2∶1,再根据电荷守恒和原子守恒配平离子方程式。
(2)分析工艺流程知,氧化的目的是将 VO2+氧化为 VO+2 ,由 VO2+→VO +2 失 e-,ClO-3 →Cl
-得 6e-,根据得失电子守恒,可知 6VO2++ClO-3 ―→6VO+2 +Cl-,再根据电荷守恒和原子
守恒,配平离子方程式为:6VO2++ClO-3 +3H2O===6VO+2 +Cl-+6H+。
(3)根据电池工作原理可知,充电时阳极上发生氧化反应,VO2+转化为 VO+2 ,电极反应
式为:VO2+-e-+H2O===VO+2 +2H+。放电时,正极反应式为:VO+2 +2H++e-===VO2++H2O,
外电路通过 2 mol e-时,正极区消耗 4 mol H+,同时负极区有 2 mol H+通过质子交换膜进入
正极区,故正极区溶液中减少 2 mol H+。
[答案] (1)2V2O3+8H++O2===4VO2++4H2O
(2)6VO2++ClO-3 +3H2O===6VO+2 +Cl-+6H+
(3)VO2+-e-+H2O===VO+2 +2H+ 减少 2
4.按要求完成下列方程式。
(1)(2019·河南周口模拟)已知在酸性介质中 FeSO4 能将+6 价铬还原成+3 价铬。写出
Cr2O 2-7 与 FeSO4 溶 液 在 酸 性 条 件 下 反 应 的 离 子 方 程 式 :
_______________________________________。
3
(2)(2019·广东湛江一调)用 NaClO—NaOH 溶液氧化 AgNO3,制得高纯度的纳米级 Ag2O2。
写出该反应的离子方程式:
__________________________________________。
(3)(2019·宁夏银川一中模拟)KMnO 4 氧化废水中 Mn2 + 生成 MnO2 的离子方程式为
________________________________。
(4)(2019·云南昆明测试)将过碳酸钠(2Na2CO3·3H2O2)溶于水配成溶液,加入适量稀硫
酸,再加入足量 KI,充分反应后加入少量淀粉试剂,溶液呈蓝色,其反应的化学方程式为
___________________________________。
[答案] (1)Cr2O2-7 +6Fe2++14H+===2Cr3++6Fe3++7H2O
(2)2Ag++ClO-+2OH-===Ag2O2↓+Cl-+H2O
(3)3Mn2++2MnO-4 +2H2O===5MnO2↓+4H+
(4)H2O2+2KI+H2SO4===I2+K2SO4+2H2O
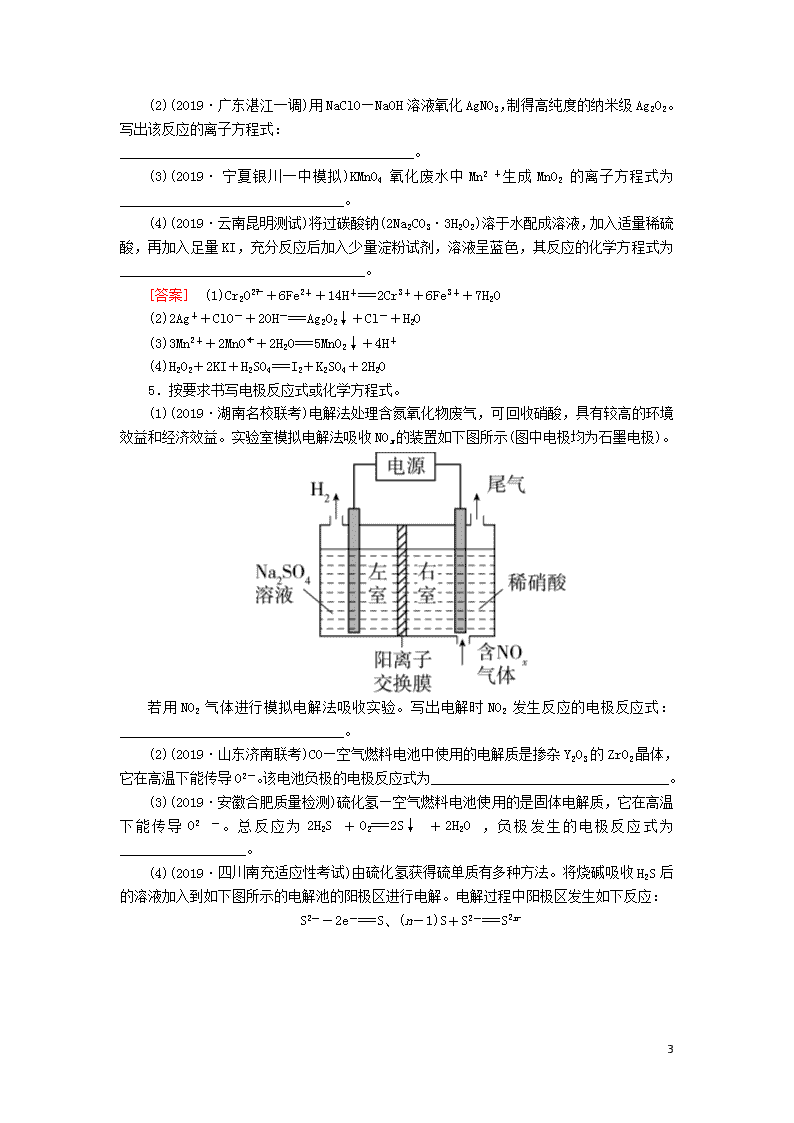
5.按要求书写电极反应式或化学方程式。
(1)(2019·湖南名校联考)电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境
效益和经济效益。实验室模拟电解法吸收 NOx 的装置如下图所示(图中电极均为石墨电极)。
若用 NO2 气体进行模拟电解法吸收实验。写出电解时 NO2 发生反应的电极反应式:
________________________________。
(2)(2019·山东济南联考)CO—空气燃料电池中使用的电解质是掺杂 Y2O3 的 ZrO2 晶体,
它在高温下能传导 O2-。该电池负极的电极反应式为__________________________________。
(3)(2019·安徽合肥质量检测)硫化氢—空气燃料电池使用的是固体电解质,它在高温
下 能 传 导 O2 - 。 总 反 应 为 2H2S + O2===2S↓ + 2H2O , 负 极 发 生 的 电 极 反 应 式 为
__________________。
(4)(2019·四川南充适应性考试)由硫化氢获得硫单质有多种方法。将烧碱吸收 H2S 后
的溶液加入到如下图所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:
S2--2e-===S、(n-1)S+S2-===S2-n
4
①写出电解时阴极的电极反应式:________________。
② 电 解 后 阳 极 区 的 溶 液 用 稀 硫 酸 酸 化 得 到 硫 单 质 , 其 离 子 方 程 式 可 写 成 :
____________________________________。
[答案] (1)NO2-e-+H2O===NO-3 +2H+
(2)CO-2e-+O2-===CO2
(3)H2S+O2--2e-===S↓+H2O
(4)①2H2O+2e-===H2↑+2OH-
②S2-n +2H+===(n-1)S↓+H2S↑
拔高练(25 分钟)
1.(2019·贵州模拟)利用钛矿的酸性废液(含 TiO2+、Fe2+、Fe3+、SO 2-4 等),可回收
获得 FeS2 纳米材料、Fe2O3 和 TiO2·nH2O 等产品,流程如下:
(1)TiO2+中钛元素的化合价为________价。TiO2+只能存在于强酸性溶液中,因为 TiO2
+ 易 水 解 生 成 TiO2·nH2O , 写 出 水 解 的 离 子 方 程 式 :
____________________________________。
(2)向富含 TiO2+的酸性溶液中加入 Na2CO3 粉末能得到固体 TiO2·nH2O。请用化学反应
原理解释:________________。
(3)NH4HCO3 溶液与 FeSO4 溶液反应的离子方程式为
____________________________________。
5
[解析] (2)含有 TiO2+的酸性溶液中,存在平衡 TiO2++(n+1)H2OTiO2·nH2O+2H
+,向溶液中加入 Na2CO3 粉末,Na2CO3 消耗 H+,c(H+)减小,使水解平衡向右移动。
(3)要充分考虑 H+与 HCO -3 不共存,HCO -3 与 Fe2+产生 FeCO3 和 H+,会继续与 HCO -3 反
应产生 CO2 气体。
[答案] (1)+4 TiO2++(n+1)H2OTiO2·nH2O+2H+
(2)Na2CO3 消耗 H+,c(H+)减少,使 TiO2+水解平衡向生成 TiO2·nH2O 方向移动
(3)Fe2++2HCO-3 ===FeCO3↓+CO2↑+H2O
2.(2019·安徽江南十校联考)软锰矿(主要成分是 MnO2,含有少量 Fe2O3、Al2O3、SiO2)
制备高纯金属锰和纯 MnO2 的工艺流程如下。
(1)经检测硫酸锰粗液中无 Fe2+,得到硫酸锰粗液时 MnO2 发生反应的离子方程式为
_______________。
(2)硫酸锰粗液中加入碳酸钠溶液的目的是_____________,生成碳酸锰沉淀的离子方程
式为_________________________________。
(3)电解酸化的硫酸锰溶液制得金属锰,电解总反应为_____________,制得 110 g 金属
锰转移的电子数目为________。
(4)煅烧碳酸锰制得二氧化锰的化学方程式为_____________,粗二氧化锰中含有 MnO 杂
质 , 由 粗 二 氧 化 锰 制 备 纯 二 氧 化 锰 发 生 反 应 的 离 子 方 程 式 为
________________________________。
(5)流程中多次用到过滤操作,实验室中过滤操作用到的玻璃仪器有玻璃棒、
________________。
(6)已知 MnCO3 的 Ksp=2.24×10-11,MnS 的 Ksp=4.65×10-14,向碳酸锰饱和溶液中加
入饱和硫化钠溶液,反应的离子方程式为_____________________________________。
[解析] (1)硫酸锰粗液中无 Fe2+,说明酸性条件下,二氧化锰与硫酸亚铁发生氧化还
原反应,二氧化锰被还原为硫酸锰,硫酸亚铁被氧化为硫酸铁,反应的离子方程式为 MnO2+
2Fe2++4H+===Mn2++2Fe3++2H2O。(2)由流程图可知,向硫酸锰粗液中加入碳酸钠溶液,
调节溶液 pH 得到硫酸锰溶液,说明加入碳酸钠溶液的目的是使 Fe3+、Al3+转化为沉淀而除
去;向硫酸锰溶液中加入碳酸氢铵溶液反应生成硫酸铵、碳酸锰沉淀、水和二氧化碳,反应
的离子方程式为 Mn2++2HCO-3 ===MnCO3↓+H2O+CO2↑。(3)酸性条件下电解硫酸锰溶液,阳
极为 H2O 失电子产生 O2 和 H+,阴极为 Mn2+得电子转化为 Mn,电解总反应为 2MnSO4+2H2O
6
=====
通电
2Mn+O2↑+2H2SO4,电解得到 110 g(即 2 mol)金属锰,转移电子数目为 4NA。(4)在
空气中煅烧碳酸锰时,锰元素被空气中的氧气氧化成二氧化锰,反应的化学方程式为 2MnCO3
+O2 =====
煅烧
2MnO2+2CO2;部分碳酸锰分解生成氧化锰,向粗二氧化锰中加入氯酸钠和稀硫
酸,氧化锰被氧化成二氧化锰,反应的离子方程式为 3MnO+ClO-3 ===3MnO2+Cl-。(5)过滤
所用到的玻璃仪器有玻璃棒、漏斗和烧杯。(6)由于硫化锰溶度积小于碳酸锰,向碳酸锰饱
和溶液中加入饱和硫化钠溶液,碳酸锰会转化为溶解度更小的硫化锰,反应的离子方程式为
MnCO3(s)+S2-(aq)===MnS(s)+CO2-3 (aq)。
[答案] (1)MnO2+2Fe2++4H+===Mn2++2Fe3++2H2O
(2)调节 pH,除去溶液中的 Fe3+、Al3+
Mn2++2HCO-3 ===MnCO3↓+H2O+CO2↑
(3)2MnSO4+2H2O =====
通电
2Mn+O2↑+2H2SO4 4NA
(4)2MnCO3+O2 =====
煅烧
2MnO2+2CO2
3MnO+ClO-3 ===3MnO2+Cl-
(5)漏斗、烧杯
(6)MnCO3(s)+S2-(aq)===MnS(s)+CO2-3 (aq)
3.(2019·湖北荆州联考)元素铬(Cr)的化合物有多种,其转化关系如下,回答下列问
题:
(1)交警检测醉驾的原理之一:乙醇在稀硫酸中被 CrO3 氧化为 CO2,发生了①的转化。
请写出该检测醉驾原理的化学方程式:__________________________________。
(2)转化②所用的试剂是硫酸酸化的 H2O2,写出转化②的离子方程式[已知 Cr2(SO4)3 是
可溶于水的强电解质]:______________。
(3) 在 硫 酸 酸 化 的 条 件 下 可 实 现 ③ 的 转 化 , 写 出 转 化 的 离 子 方 程 式 :
________________________________。
[答案] (1)4CrO3+C2H5OH+6H2SO4===
2Cr2(SO4)3+2CO2↑+9H2O
(2)Cr2O2-7 +3H2O2+8H+===2Cr3++3O2↑+7H2O
(3)2CrO2-4 +2H+===Cr2O2-7 +H2O
4.(2019·长沙模拟)SO2 是主要的大气污染气体,利用化学反应原理是治理污染的重要
方法。工业上用 Na2SO3 吸收尾气中 SO2 使之转化为 NaHSO3,再以 SO2 为原料设计原电池,然
后电解(惰性电极)NaHSO3 制取 H2SO4,装置如下:
7
(1)甲图中 A 电极上的反应式为__________________。
(2)甲图中 B 与乙图________(填“C”或“D”)极相连,进行电解时乙图 Z 中 Na +向
________(填“Y”或“W”)中移动。
(3)该电解池阴极的电极反应式为____________________;阳极的电极反应式为
_______________。
[解析] (1)从题目信息可知,SO2 反应生成 H2SO4,所以 SO2 作负极,失去电子和水结
合生成硫酸。(2)甲中 A 为负极,B 为正极,因为乙中 C 极附近加入 NaHSO3 得到 Na2SO3,说
明 H 元素化合价降低生成 H2,在阴极反应,所以连接电源的负极,即 B 连接 D;进行电解时
乙图中 Na+向阴极移动,即向 Y 中移动。(3)阴极是 HSO -3 反应生成 SO 2-3 和 H2,右侧为阳极
室,据此写出对应的电极反应式。
[答案] (1)SO2+2H2O-2e-===4H++SO2-4
(2)D Y
(3)2HSO-3 +2e-===2SO2-3 +H2↑
HSO-3 +H2O-2e-===SO2-4 +3H+
相关文档
- 浙江专用2020高考数学二轮复习专题2021-04-14 22:18:059页
- 2020版高考化学二轮复习专题强化训2021-04-14 19:21:318页
- 2020版高考物理大二轮复习专题强化2021-04-14 16:10:467页
- 浙江专用2020高考数学二轮复习专题2021-04-14 15:30:207页
- 2020高中数学 专题强化训练1 导数2021-04-14 13:07:485页
- 2020版高考化学二轮复习专题强化训2021-04-14 09:48:317页
- 浙江专用2020高考数学二轮复习专题2021-04-13 23:57:218页
- 新课标2020高考物理二轮复习专题强2021-04-13 22:04:337页
- 2020高中数学 专题强化训练4 框图 2021-04-13 20:05:596页
- 浙江专用2020高考数学二轮复习专题2021-04-13 10:37:0513页