- 212.00 KB
- 2021-04-15 发布
河南省洛阳名校2017-2018学年高二上学期第二次联考
化学
可能用到的相对原子质量: H-1 C-12 O-16 Na-23 Mg-24 Al-27 S- 32 Mn-55 Fe-56
一、选择题(本题有18小题,每小题3分,共54分,每小题只有一个正确答案)
1.下列有关说法正确的是( )
A.CH3Cl(g)+Cl2(g)= CH2Cl2(1) +HCl(g)能自发进行,则该反应的△H>0
B.在向含有BaSO4沉淀的溶液中加入Na2SO4 固体,c (Ba2+) 增大
C.加热0.1mol/LNa2CO3溶液,CO32- 的水解程度和溶液的pH 均增大
D.对于乙酸与乙醇的酯化反应(△H<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大
2.为了配制NH4+的浓度与Cl- 的浓度比为l∶1的溶液,可在NH4Cl 溶液中加入( )
①适量的HCl2②适量的NaCl3③适量的氨水④NaOH
A.①② B.③ C.③④ D.④
3.已知反应mX(g)+nY(g)=-qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
A.X 的正反应速率是Y 的逆反应速率的m/n倍
B.通入稀有气体He使体系压强增大,平衡将正向移动
C.降低温度,混合气体的平均相对分子质量变小
D.增加X 的物质的量,Y 的转化率降低
4.已知: 2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+O2(g)△H=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
A.CO 的燃烧热为566kJ/mol
B.上图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) △H<-452 kJ/mol
D.CO2(g)与Na2O2(s)反应放出452kJ 热量时,电子转移数为1.204>1024 (个)
5.I2在KI溶液中存在下列平衡: I2(aq)+I-(aq)一I3-(aq),某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是( )
A.反应I2(aq)+ I-(aq)= I3-(aq) △H<0
B.若温度为T1、T2反应的平衡常数分别为K1、K2,则K1 >K2
C.若反应进行到状态D时,一定有v正 >v逆
D.状态A 与状态B相比,状态A 的c(I2)大
6.常温下,下列有关溶液组成的描述合理的是( )
A.水电离的c (H+)=1×10-13溶液中可能大量存在Al3+、NH4+、Cl-、S2-
B.Kw/ c (H+)= 1×10-13溶液中可能大量存在Na+、ClO-、SO42-、I-
C.pH=8的溶液中可能大量存在Na+、K+、Cl-、HCO3-
D.pH=7 的溶液中可能大量存在Fe3+、K+、Cl-、SO42-
7.向20mL0.1mol/ LNH4HSO4溶液中滴入0.1mol/LNaOH 溶液至恰好反应完全,下列说法正确的是( )
A.整个反应过程中: c(H+)+ c(Na+)+ c(NH4+)-=c(OH-)+ c(SO42-)
B.当滴入30mLNaOH 溶液时(pH>7) :c(NH4+)>c(NH3·H2O)>c(OH-)>c(H+)
C.当滴入20mL NaOH 溶液时:2c(SO42-)=c(NH3·H2O)+ c(NH4+')
D.当溶液星中性时: c(NH4+)>c(SO42-)>c(Na+)>c(H+)= c(OH-)
8.把分别盛有熔融的氯化钠、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钠、镁、铝的物质的量之比为( )
A.1∶2∶3 B.3∶2∶ 1 C.6∶3∶1 D.6∶3∶2
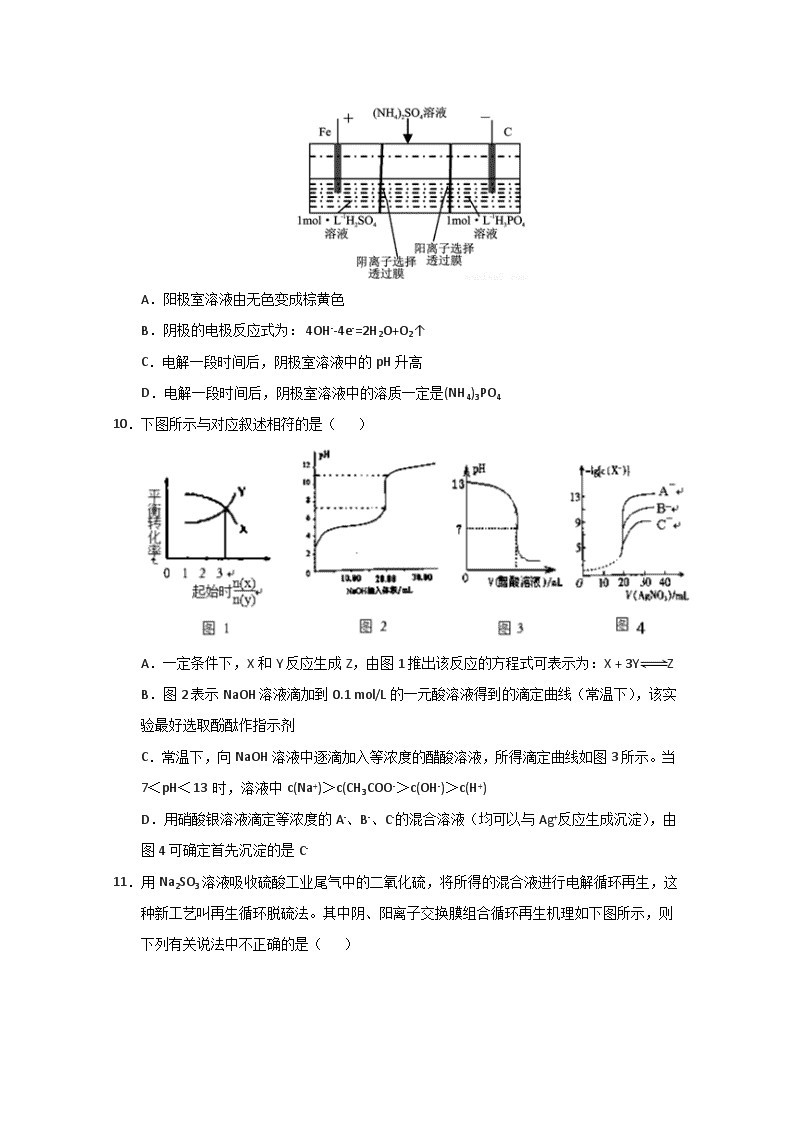
9.用一种阴、阳离子双隔膜三室电解槽处理废水中的NH4+,模拟装置如图所示。下列说法正确的是( )
A.阳极室溶液由无色变成棕黄色
B.阴极的电极反应式为: 4OH--4e-=2H2O+O2↑
C.电解一段时间后,阴极室溶液中的pH 升高
D.电解一段时间后,阴极室溶液中的溶质一定是(NH4)3PO4
10.下图所示与对应叙述相符的是( )
A.一定条件下,X和Y反应生成Z,由图1推出该反应的方程式可表示为:X + 3YZ
B.图2表示NaOH溶液滴加到0.1 mol/L的一元酸溶液得到的滴定曲线(常温下),该实验最好选取酚酞作指示剂
C.常温下,向NaOH溶液中逐滴加入等浓度的醋酸溶液,所得滴定曲线如图3所示。当7<pH<13 时,溶液中c(Na+)>c(CH3COO->c(OH-)>c(H+)
D.用硝酸银溶液滴定等浓度的A-、B-、C-的混合溶液(均可以与Ag+反应生成沉淀),由图4可确定首先沉淀的是C-
11.用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴、阳离子交换膜组合循环再生机理如下图所示,则下列有关说法中不正确的是( )
A.X为直流电源的负极,Y为直流电源的正极 B.阳极区pH增大
C.图中的b>a D.该过程中的产品主要为H2SO4和H2
12.水的电离平衡曲线如下图所示,下 列说法中正确的是( )
A.图中A、B、D三点处KW 间的关系: B>A>D
B.100℃,向pH=2 的稀硫酸中逐滴加入等体积pH=10 的稀氨水,溶液中c(NH4+)/c(NH3•H2O)减小,充分反应后,溶液到达B 点
C.温度不变,在水中加入适量NH4Cl 固体,可从A 点变化到C点
D.加热浓缩A 点所示溶液,可从A点变化到B 点
13.下列各项叙述中,正确的是( )
A.Na 的简化电子排布式: [Na]3s1
B.价电子排布为4s24p3的元素位于第四周期第VA族,是p区元素
C.2P和3P轨道形状均为哑铃形,能量也相等
D.氮原子的最外层电子轨道表示式:
14.以下有关元素性质的说法不正确的是( )
A.具有下列电子排布式的原子中,①1s22s22p63s23p2②1s22s22p3③1s22s22p2④1s22s22p63s23p4,原子半径最大的是①
B.具有下列最外层电子排布式的原子中,①3s23p1②s23p2③3s23p3 ④3s23p4,第一电离能最大的是③
C.①Na、K、Rb ②N、P、As ③O、S、Se ④Na、P、Cl,元素的电负性随原子序数的增加而递增的是④
D.某元素气态基态原子的逐级电离能分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X3+
l5.下列分子中的中心原子杂化轨道的类型相同的是( )
A.SO3 与SO2 B.BF3 与NH3 C.BeCl2与SCl2 D.H2O 与SO2
16.下列说法中错误的是( )
A.SO2、SO3都是极性分子 B.热稳定性: HF>H2O>NH3
C.一个N2分子中有 一个σ键,2个π键 D.NH4+ 为正四面体结构,可推测PH4+ 也为正四面体结构
17.某物质的实验式为PtCl4·2NH3,其水溶液不导电,加入AgNO3溶液反应也不产生沉淀,以强碱处理并没有NH3放出,则关于此化合物的说法中正确的是( )
A.配合物中中心原子的电荷数和配位数均为6 B.该配合物可能是平面正方形结构
C.Cl- 和NH3分子均与Pt4+配位 D.配合物中Cl- 与Pt4+配位,而NH3分子不配位
18.下列各项表述中,两个粒子一定不属于同种元素原子的是( )
A.3p能级有一个空轨道的基态原子和核外电子排布为1s22s22p63s23p2的原子
B.2p能级无空轨道,且有一个未成对电子的基态原子和原子的最外层电子排布为2s22p5的原子
C.M层全充满而N层排布为4s2的原子和核外电子排布为1s22s22p63s23p64s2的原子
D.最外层电子数是核外电子总数1/5的原子和最外层电子排布为4s24p5的原子
二、非选择题(共46分)
19.(12 分)Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。
(1)该电池的负极材料是 _。电池工作时,电子流向 (填“正极”或“负极”)。
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是 。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
a.NaOH b.Zn c.Fe d.NH3·H2O
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是 。若电解电路中通过2 mol电子,MnO2的理论产量为 。
(4)用间接电化学法除去NO的过程,如下图所示:
已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式: 。
用离子方程式表示吸收池中除去NO的原理: 。
20.(12分)已知I、II反应在一定条件节焓变及平衡常数如下:
2H2(g)+S2(g)2H2S(g) K 1 △H1 (1)
3H2(g)+SO2(g)2H2O(g)+H2(g) K2 △H2 (2)
(1)用△Hl、△H2表示反应4H2(g)+2SO2(g)S2(g)+4H2O(g)的△H= 。
(2)回答下列反应(1)的相关问题:
①温度为T1,在1L恒容容器中加入1.8mol H2、1.2mol S2,l0min时反应达到平衡.此时测得l0min内V(H2S)=0.08mol•L-1•min-l,若此时再向容器中充入H2、S2、H2S各0.8mol,则平衡移动方向为 (填“正向”、“逆向”或“不移动”);
②温度为T2时(T2>Tl),在1L恒容容器中也加入1.8mol H2、1.2mol S2,建立平衡时测得S2的转化率为25%,据此判断△H1 0(填“>”或“<”);
(3)常温下,用SO2与NaOH溶液反应可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液显碱性,原因是 (写出主要反应的离子方程式),该溶液中,[Na+] 2[SO32-]+[HSO3-](填“>”、“<”或“=‘’)。
②在某NaHSO3、Na2SO3混合溶液中HSO3-、SO32-物质的量分数随pH变化曲线如图所示(部分):根据图示,求SO32-的水解平衡常数= mol•L-1。
21.(10分) I、已知:常温下,A酸的溶液pH=a,B碱的溶液pH=b。
(1)若A为醋酸,且a=4,那么A溶液中水电离出的氢离子浓度为 mol/ L。
(2)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显酸性。则混合溶液中必定有一种离子能发生水解, 该离子为 (填离子符号);
混合后的溶液中,下列微粒浓度大小关系一定正确的是 (填序号)。
①c(MOH)>c(M+)e(R-)>c(H+)>c(OH-)
②c(HR)>c(M+)>c(R-)>c(OH-)>c(H+)
③c(R-)>c(M+)>c(H+) >c(OH-)
④c(M+)>c(R-)>c(OH-)>c(H+)
⑤c(M+)+ c(H+)=c(R-)+c(OH-)
Ⅱ.难溶电解质的溶解平衡属于化学平衡的一种。
(1)已知H2A在水中存在以下平衡:H2AH++HA-,HA-H++A2-。常温下CaA的饱和溶液中存在以下平衡:CaA(s)Ca2+(aq)+A2-(aq) ΔH>0,则该饱和溶液呈 性(填“酸”、“碱”或“中”),将溶液放入冰水浴中,则CaA的Ksp将 (填“增大”、“减小”或“不变”)。
(2)含有Cr2O72-的废水毒性较大,某工厂废水中含5.00×10-3 mol·L-1的Cr2O72-。为使废水能达标排放,做如下处理:Cr2O72- Cr3+、Fe3+Cr(OH)3、Fe(OH)3。欲使10 L该废水中的Cr2O72-完全转化为Cr3+,则理论上需要加入 g FeSO4·7H2O。若处理后的废水中残留的c(Fe3+)=2×10-13 mol·L-1,则残留的Cr3+的浓度为 mol·L-1(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)。
22.(12 分)X、Y、Z、W是元素周期表前四周期中原子序数依次增大的四种常见元素,基态X原子核外有2个未成对电子,基态Z原子最外层电子排布式为nsnnpn+2,W的核电荷数等于X与Y的核电荷数之和的2倍。
(1)Z在元素周期表中的位置为 ,W的元素基态原子的电子排布式是 。
(2)X、Y、Z三种元素的第一电离能的大小顺序为 (用元素符号表示,下同);H-X、 H-Y、H-Z三种共价键中,键长最长的是 。
(3)Y的最简单氢化物的空间构型是 。
(4)CH3+、—CH3( 甲基)、CH3-都是重要的有机反应中间体,有关它们的说法正确的是 。
A.它们均由甲烷去掉一个氢原子所得
B.它们互为等电子体,碳原子均采取sp2杂化
C.CH3-与NH3、H3O+互为等电子体,几何构型均为三角锥形
D.CH3+中的碳原子采取sp2杂化,所有原子均共面
E .两个—CH3( 甲基)或一个CH3+和一个CH3-结合均可得到CH3CH3
一、选择题(每小题只有一个选项符合题意。3分×18=54分)
1~5 CBADD 6~10 CBDCB 11~15 BDBDA 16~18ACC
二、 非选择题(共46分)
19.(12分)
(1)Zn(或锌) (1分)正极(1分)
(2)Zn与Cu2+反应生成Cu,Zn与Cu构成原电池,加快反应速率 (1分) b(1分)
(3)2H++2e-=H2↑(2分) 87g (2分)
(4)2HSO3- + 2e- + 2H+ === S2O42- + 2H2O(2分)
2NO + 2S2O42- +2H2O === N2 + 4HSO3-(2分)
20.(12分)(1)△H=2△H2-△H1,(2分)
(2)①正向(2分);②<(2分)
(3)①SO32-+H2OHSO3-+OH-(2分);>(2分);
②10-6.8(2分)
21.(10分)Ⅰ、
(1)10-10(1分)
(2)(2)R-(1分) ③⑤(2分)
Ⅱ、
(1)碱(1分) 减小(1分)
(2)83.4(2分) 3×10-6(2分)
22.(12分)
(1)第二周期ⅥA族(2分);1s22s22p63s23p63d64s2(或[Ar]3d64s2) (2分)
(2)N>O>C (2分); H-C (2分)
(3)三角锥形(2分)
(4)CDE (2分)