- 649.00 KB
- 2021-04-15 发布
江苏省启东中学2017~2018学年度第二学期学测模拟测试
高二化学(2018.3.10)
本试卷分Ⅰ卷(选择题)和Ⅱ卷(非选择题)两部分,共100分。考试时间75分钟。
可能用到的相对原子质量:H-1 N-14 O-16 Cl-35.5 Mg-24 Al-27 Cu-64 Ag-108
Mn-55 I-127 Na-23 S-32
第Ⅰ卷(选择题 共69分)
单项选择题:在每题的4个选项中,只有1个选项符合要求(本部分23题,每题3分,共69分)。
1.“保护环境”是我国的基本国策。下列做法不应该提倡的是
A.对生活废弃物进行分类处置 B.过度开发资源促进经济发展
C.煤炭燃烧时安装“固硫”装置 D.宣传“低碳”出行
2.下列化学用语的表达正确的是
A.H2O2的电子式: B.乙酸的结构简式:C2H4O2
C.中子数为20的氯原子: D.CH4的球棍模型:
3.下列变化属于物理变化的是
A.用石油分馏炼制汽油 B.用煤干馏制备焦炭
C.电解饱和食盐水制烧碱 D.用海带提取碘单质
4.工业上铁的冶炼是在炼铁高炉中进行的,发生的反应是:Fe2O3+3CO =2Fe+3CO2 ,对
于该反应,下列说法正确的是
A.反应中转移3个电子 B.Fe2O3发生还原反应
C.CO被还原 D.CO为氧化剂
5.某溶液中存在大量的K+、OHˉ、CO32ˉ,该溶液中还可能大量存在的离子是
A. Al3+ B.NH4+ C.Fe3+ D.SO42ˉ
6.乙醇和乙酸是生活中两种常见的有机物。下列说法正确的是
A.乙醇、乙酸互为同分异构体 B.乙醇、乙酸都能与钠反应
C.乙醇、乙酸都能与NaOH溶液反应 D.乙醇、乙酸都能使紫色石蕊试液变红色
7.下列物质均可用于漂白,漂白原理不同于其它的是
A.次氯酸钙 B.次氯酸钠 C.氯水 D.活性炭
8.以下食品中的有机成分属于高分子化合物的是
A.植物油、动物脂肪中含有的油脂 B.谷类中含有的淀粉
C.食醋中含有的醋酸 D.酒中含有的酒精
9.下列选项描述的过程能实现化学能转化为热能的是
A.光合作用 B.烧炭取暖 C.风力发电 D.电解冶炼
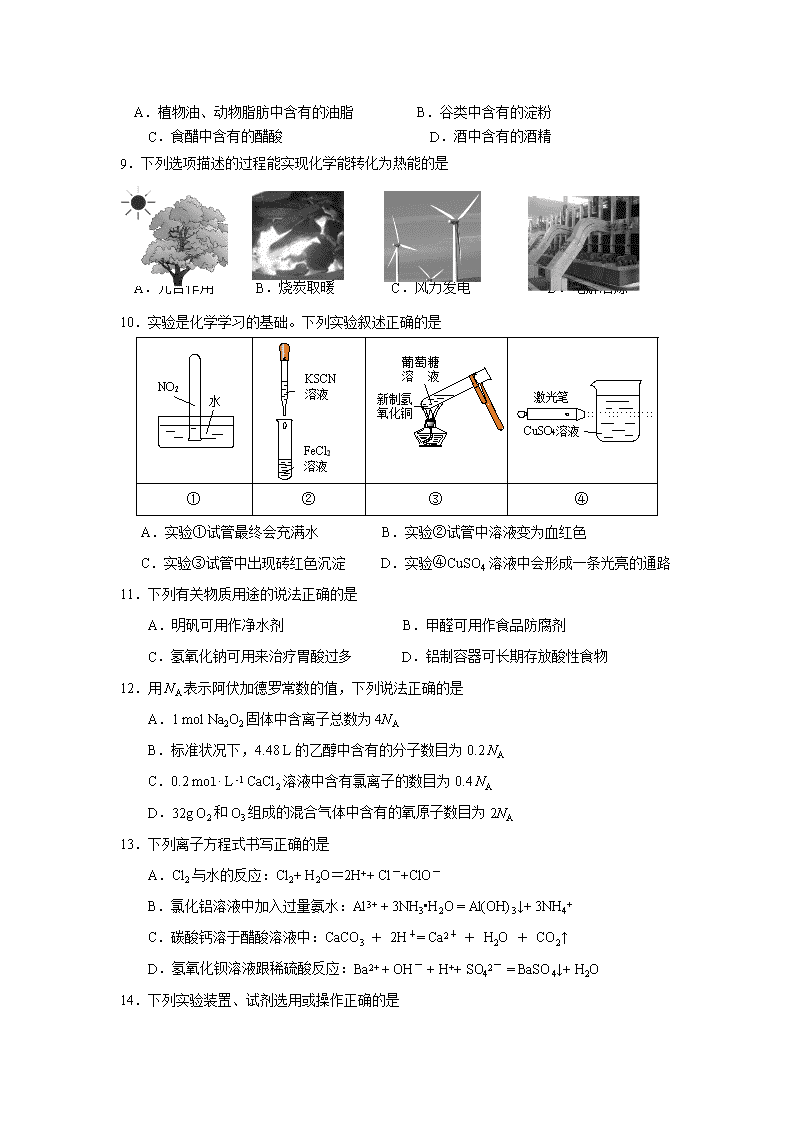
10.实验是化学学习的基础。下列实验叙述正确的是
FeCl2
溶液
KSCN
溶液
①
②
③
④
A.实验①试管最终会充满水 B.实验②试管中溶液变为血红色
C.实验③试管中出现砖红色沉淀 D.实验④CuSO4溶液中会形成一条光亮的通路
11.下列有关物质用途的说法正确的是
A.明矾可用作净水剂 B.甲醛可用作食品防腐剂
C.氢氧化钠可用来治疗胃酸过多 D.铝制容器可长期存放酸性食物
12.用NA表示阿伏加德罗常数的值,下列说法正确的是
A.1 mol Na2O2固体中含离子总数为4NA
B.标准状况下,4.48 L的乙醇中含有的分子数目为0.2 NA
C.0.2 mol· L -1 CaCl2溶液中含有氯离子的数目为0.4 NA
D.32g O2和O3组成的混合气体中含有的氧原子数目为2NA
13.下列离子方程式书写正确的是
A.Cl2与水的反应:Cl2+ H2O=2H++ Cl-+ClO-
B.氯化铝溶液中加入过量氨水:Al3+ + 3NH3•H2O = Al(OH)3↓+ 3NH4+
C.碳酸钙溶于醋酸溶液中:CaCO3 + 2H+= Ca2+ + H2O + CO2↑
D.氢氧化钡溶液跟稀硫酸反应:Ba2+ + OH- + H++ SO42- = BaSO4↓+ H2O
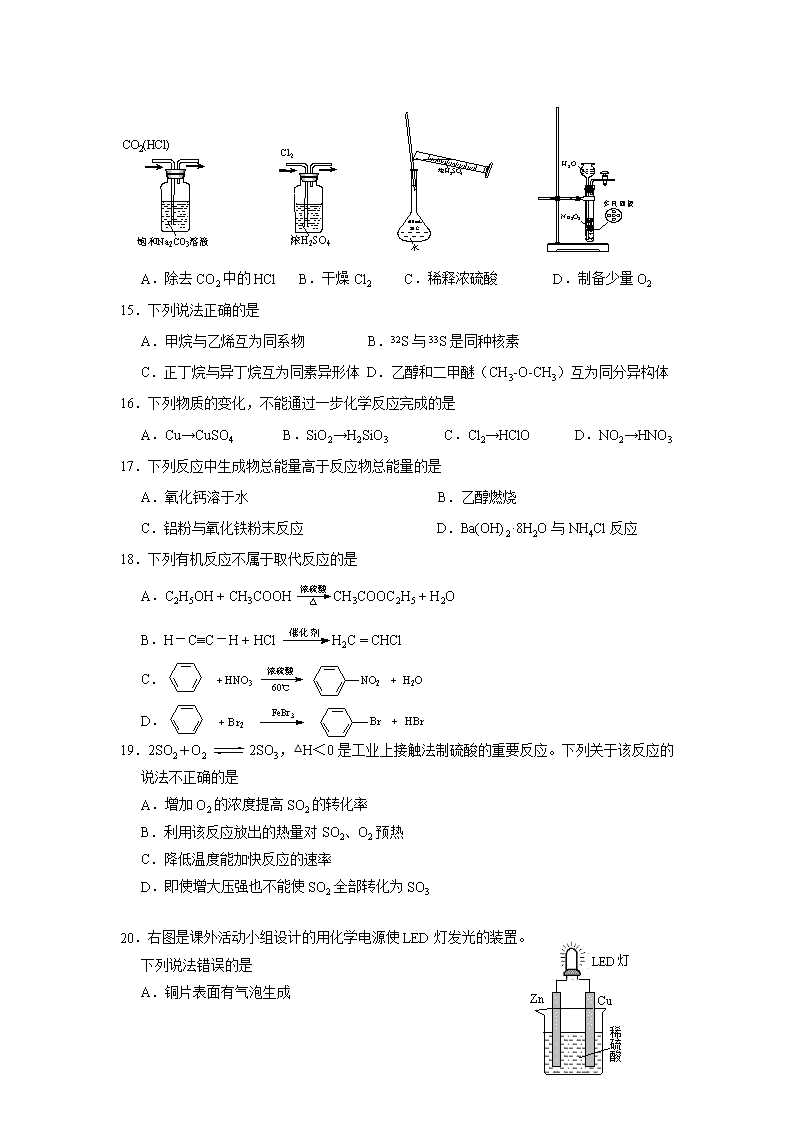
14.下列实验装置、试剂选用或操作正确的是
A.除去CO2中的HCl B.干燥Cl2 C.稀释浓硫酸 D.制备少量O2[
15.下列说法正确的是
A.甲烷与乙烯互为同系物 B.32S与33S是同种核素
C.正丁烷与异丁烷互为同素异形体 D.乙醇和二甲醚(CH3-O-CH3)互为同分异构体
16.下列物质的变化,不能通过一步化学反应完成的是
A.Cu→CuSO4 B.SiO2→H2SiO3 C.Cl2→HClO D.NO2→HNO3
17.下列反应中生成物总能量高于反应物总能量的是
A.氧化钙溶于水 B.乙醇燃烧
C.铝粉与氧化铁粉末反应 D.Ba(OH)2·8H2O与NH4Cl反应
18.下列有机反应不属于取代反应的是
A.C2H5OH + CH3COOHCH3COOC2H5 + H2O
B.H-C≡C-H + HClH2C = CHCl
C.
D.
19.2SO2+O22SO3,△H<0是工业上接触法制硫酸的重要反应。下列关于该反应的说法不正确的是
A.增加O2的浓度提高SO2的转化率
B.利用该反应放出的热量对SO2、O2预热
C.降低温度能加快反应的速率
D.即使增大压强也不能使SO2全部转化为SO3
Zn
Cu
LED灯
稀硫酸
20.右图是课外活动小组设计的用化学电源使LED灯发光的装置。
下列说法错误的是
A.铜片表面有气泡生成
B.装置中存在“化学能→电能→光能”的转换
C.如果将硫酸换成柠檬汁,导线中不会有电子流动
D.如果将锌片换成铁片,电路中的电流方向不变
21.常温下,下列各组物质中,Y既能与X反应又能与Z反应的是
X
Y
Z
①
NaOH溶液
Al(OH)3
稀硫酸
②
KOH溶液
SiO2
稀盐酸
③
O2
N2
H2
④
FeCl3溶液
Cu
浓硝酸
A.①③ B.①④ C.②④ D.②③
22.短周期元素A、B、C、D、E,原子序数依次增大。已知元素A的气态氢化物和A的
最高价氧化物对应的水化物反应生成盐;B、E为同主族元素,B元素原子最外层电子
数是次外层的3倍;D是地壳中含量最多的金属元素;C是短周期中与水反应最激烈
的金属元素。下列叙述不正确的是
A.元素A的氧化物常温下一般均为无色无味气体
B.元素C、D、E的最高价氧化物对应的水化物两两之间能发生反应
C.原子半径:C>D>B
D.元素B的气态氢化物的沸点比元素E气态氢化物的沸点高
23.某溶液中可能含有下列5种离子中的几种:Na+、NH4+、Mg2+、Al3+、Cl-。为确认该溶液组成进行如下实验:①取20.0 mL该溶液,加入32.5 mL 4.00 mol•L-1 NaOH溶液加热,有白色沉淀产生,无刺激气味气体生成.过滤、洗涤、干燥,得沉淀2.03 g。再将滤液稀释至100mL,测得滤液中c(OH-)=0.2 mol•L-1;②另取20.0 mL该溶液,加入足量的AgNO3溶液,生成白色沉淀14.35 g。关于原溶液组成结论正确的是
A.一定含有Mg2+、Al3+、Cl-,不含有Na+、NH4+
B.一定含有Na+、Mg2+、Cl-,不含有NH4+、可能含有Al3+
C.c(Mg2+)为1.75 mol•L-1,c(Na+)为1.50 mol•L-1
D.c(Cl-)为5.00 mol•L-1,c(Al3+)为1.00 mol•L-1
第Ⅱ卷(非选择题 共31分)
二、非选择题(本部分4题,共31分)
24.(15分)《化学与生活》
(1)(3分)食物是人类赖以生存的物质基础。
① 食物中含有的蛋白质、油脂、淀粉都是人体所需的营养素。蛋白质在人体中完全水解的产物是____________(填名称),淀粉在人体内水解的最终产物是葡萄糖,葡萄糖的结构简式为_______________________________。
② 市场上销售的食盐品种很多。下列食盐中,所添加的元素不属于人体必需微量元素的是________(填字母)。
a.加锌盐 b.加碘盐 c.加钙盐
(2)(5分)为加强南海建设,我国对南海多个岛屿进行了“吹埋扩建”。
① 海岛生态环境十分脆弱,下列做法不利于海岛环境保护的是________(填字母)。
a.在海岛上植树造林,加强绿化
b.建设海水淡化厂,减少对海岛地下水的开采
c.在海岛上开展风力发电,减少燃油发电机的使用
d.将生活垃圾运离海岛,就近抛入大海
② 建设岛屿时需用大量水泥、玻璃,它们属于________(填字母)。
a.金属材料 b.无机非金属材料 c.有机高分子材料
③ 建设岛屿的工程机械易生锈受损,下列措施中不能减缓工程机械生锈受损的是________(填字母)
a.对机械配件进行发蓝处理 b.机械停用后及时擦干涂油
c.在机械表面刷上油漆 d.在机械表面上附着多块铜板
④ 海岛上往往缺少新鲜蔬菜,建岛工人需服用含______(填字母)的营养剂,以防止患上“坏血病”。
a.维生素A b.维生素B c.维生素C d.维生素D
⑤ 海岛上生存环境恶劣,工人需准备一些常用药物,可选用_____(填字母)进行解热镇痛。
a.阿司匹林 b.青霉素 c.胃舒平 d.吗啡
(3)(7分)受经济结构转型以及大气环保压力的抑制,2017年我国对煤炭需求明显减少。
① 煤炭直接燃烧会引起多种环境问题。正常雨水的pH______7(填>、=或<),燃煤产生的SO2增加了________型酸雨形成的可能;在燃煤中加入石灰石,可减少SO2的排放,写出相关反应方程式:________________________________________。
② 治理被酸雨侵蚀过的酸性土壤,可以加入适量的_____________(填字母)。
a.Ca(OH)2 b.KNO3 c.SiO2 d.NaCl
③ 处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S,发生反应的化学方程式为______________________________________________。
25.(6分)下列框图所示的物质转化关系中,甲是日常生活中常见的金属,乙、丙、丁是
常见的气体单质。气体B与气体C相遇产生大量的白烟,D是日常生活中常见的盐(部
分反应物和生成物及溶剂水已略去)。请回答下列问题:
(1)甲元素在周期表中的位置 ▲ 。
(2)B的电子式为 ▲ 。
(3)写出A溶液和甲反应的离子方程式 ▲ 。
(4)写出A和E反应的化学方程式 ▲ 。
26.(10分)工业上用软锰矿(主要成分MnO2,杂质金属元素Fe、Al等) 制备MnSO4·H2O 的一种工艺流程如下:
已知:
①浸出过程中发生的主要反应化学方程式为:MnO2+SO2 = MnSO4
②浸出液中阳离子主要有Mn2+、Fe2+、Al3+等
回答下列问题:
(1)物质X最好选用 ▲ 。
a.盐酸 b.硫酸 c.硝酸
(2)酸浸时SO2的吸收效率与pH、温度的关系如下图所示,为提高SO2的吸收效率,酸浸适宜的条件是 ▲ 。
(3)流程中“氧化”步骤主要反应的离子方程式是 ▲ 。
(4)加入石灰浆调节pH,可将氧化后的浸出液中Fe3+、Al3+形成氢氧化物除去。检验Fe3+是否除尽的最佳方法是 ▲ 。
(5)用MnSO4可测定水中溶解氧,方法是:取100 mL 水样,迅速加入足量MnSO4溶液及含有NaOH的KI溶液,立即塞上塞子、振荡,使之充分反应;打开塞子,迅速加入适量的稀硫酸,此时有I2生成;再用5.00×10-3 mol·L-1 Na2S2O3溶液和I2反应,当消耗Na2S2O3溶液 12.0 mL时反应完全。有关化学反应方程式如下:
① 2Mn2++O2+4OH-=2MnO(OH)2(反应很快);
② MnO(OH)2+2I-+4H+=Mn2++I2+3H2O;
③ I2+2S2O32-=S4O62-+2I-。
计算水样中溶解氧的浓度(以mg·L-1为单位),写出计算过程。 ▲
江苏省启东中学2017-2018学年度学测最后一考
参考答案
一、选择题
题号
1
2
3
4
5
6
7
8
9
10
11
12
答案
B
A
A
B
D
B
D
B
B
C
A
D
题号
13
14
15
16
17
18
19
20
21
22
23
答案
B
B
D
B
D
B
C
C
B
A
A
二、非选择题
24.(15分)《化学与生活》
(1)(3分)① 氨基酸(1分), CH2OH(CHOH)4CHO(1分)。 ② c(1分)
(2)(5分)① d ② b ③d ④ c ⑤ a(各1分)
(3)(7分) ① <(1分) , 硫酸(1分); 2CaCO3+2SO2+O22CaSO4+2CO2(2分)
② a(1分) ③ 2CO+SO22CO2+S (2分)。
25.(6分)
(1)第三周期ⅢA族 (1分) (2) (1分)
(3)2Al + 2OHˉ+ 2H2O = 2AlO2ˉ+ 3 H2 (2分)
(4)NaOH+NH4Cl NaCl+NH3↑+H2O (2分)
26.(10分)(1) b ( 1分)
(2)pH控制在3左右,温度控制在40℃左右。( 2分)
(3) MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O ( 2分)
(4)取上层清液少许,向其中滴加少许KSCN溶液,若溶液未出现血红色,则Fe3+除尽。
( 2分)
(5) n(S2O32-)= 5.00×10-3mol·L-1 × 12.0 mL× 10-3L/mL= 6.00×10-5 mol ( 1分)
O2 ~ 4 S2O32-
1 mol 4 mol
n(O2) 6.00×10-5 mol
n(O2)=1.50×10-5 mol ( 1分)
水样中溶解氧的浓度=1.50×10-5 mol × 32 g·mol-1×1000mg/g÷0.1L=4.80 mg·L-1 ( 1分)
【来源:全,品…中&高*考+网】