- 332.50 KB
- 2021-04-14 发布
第五章 原子结构 元素周期律
第三节 化学键
一、化学键的含义与类型
1.含义: 的相互作用。存在于 内或晶体内。
2. 化学键变化与化学反应的本质:反应物中 断裂和生成物中的 形成。其中,断键与成键的种类是 (一定相同、一定不相同、不一定相同)的。
3. 形成过程:主要通过原子的价电子间的得失或共用来形成,通过电子得失形成 ,通过共用形成 。
4.化学键的常见分类:离子键、共价键、金属键(不作要求)。
二、共价键
1.共价键的概念: 称为共价键。
2. 成键元素:多为 元素(也有少数金属元素如AlCl3), 是非极性共价键; 是极性共价键。
3. 用电子式和结构式表示HCl分子的形成过程: 。
4.写出下列物质的电子式
①H2O: ;②N2: ;③H2O2: ;
④CO2: ;⑤HClO: ;⑥C2H2: 。
5.写出下列物质的结构式
①N2: ;②H2O: ;③CO2: 。
6.共价化合物: 形成的化合物(不能含有离子键)。
三、离子键
1.离子键的概念: 形成的化学键。
2.成键元素:一般存在于 元素之间。
3.用电子式表示离子化合物MgCl2的形成过程: 。
4.写出下列物质的电子式
①NH4Cl: ;②Na2O2: ;
③NaOH: ;④CaC2: 。
5.离子化合物: 形成的化合物。化合物中一定含有离子键,也有可能含有共价键。
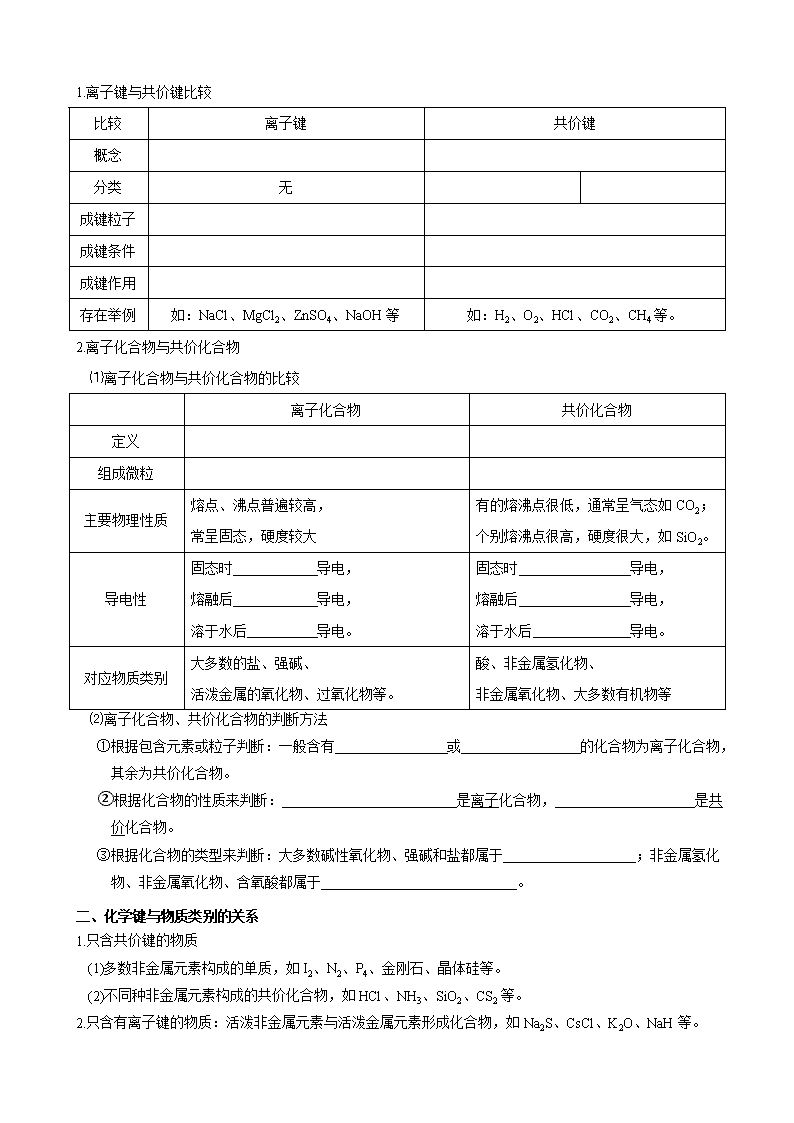
一、离子键与共价键、离子化合物与共价化合物的比较一般判断方法:
1.离子键与共价键比较
比较
离子键
共价键
概念
分类
无
成键粒子
成键条件
成键作用
存在举例
如:NaCl、MgCl2、ZnSO4、NaOH等
如:H2、O2、HCl、CO2、CH4等。
2.离子化合物与共价化合物
⑴离子化合物与共价化合物的比较
离子化合物
共价化合物
定义
组成微粒
主要物理性质
熔点、沸点普遍较高,
常呈固态,硬度较大
有的熔沸点很低,通常呈气态如CO2;
个别熔沸点很高,硬度很大,如SiO2。
导电性
固态时 导电,
熔融后 导电,
溶于水后 导电。
固态时 导电,
熔融后 导电,
溶于水后 导电。
对应物质类别
大多数的盐、强碱、
活泼金属的氧化物、过氧化物等。
酸、非金属氢化物、
非金属氧化物、大多数有机物等
⑵离子化合物、共价化合物的判断方法
①根据包含元素或粒子判断:一般含有 或 的化合物为离子化合物,其余为共价化合物。
②根据化合物的性质来判断: 是离子化合物, 是共价化合物。
③根据化合物的类型来判断:大多数碱性氧化物、强碱和盐都属于 ;非金属氢化物、非金属氧化物、含氧酸都属于 。
二、化学键与物质类别的关系
1.只含共价键的物质
(1)多数非金属元素构成的单质,如I2、N2、P4、金刚石、晶体硅等。
(2)不同种非金属元素构成的共价化合物,如HCl、NH3、SiO2、CS2等。
2.只含有离子键的物质:活泼非金属元素与活泼金属元素形成化合物,如Na2S、CsCl、K2O、NaH等。
3.既含有离子键又含有共价键的物质,均是含有 的化合物。如Na2O2、CaC2、NH4Cl、NaOH、Na2SO4等。
4.不含任何化学键的物质,如稀有气体单质,He、Ne、Ar等。
1.下列有关化学键与物质说法正确的是( )
①含有阴离子的化合物一定有阳离子。②非金属元素组成的化合物一定是共价化合物。③不同元素组成的多原子分子中的化学键一定是极性键。④NaHSO4中含有离子键和共价键。
A.①④ B.②④ C.①③ D.②③
2.下列有关化学键与物质说法正确的是( )
A非金属元素的原子只能形成共价化合物,不能够形成离子化合物。
B离子化合物是强电解质,共价化合物也可能是强电解质。
C有化学键断裂和生成的过程一定是化学变化。
D含有活泼金属的化合物,一定是离子化合物。
参考答案
【基础落实】
一、化学键的含义与类型
1. 相邻的两个或多个原子间强烈 物质分子
2. 旧化学键 新化学键 不相同
3. 离子键 共价键
二、共价键
1. 原子之间通过共用电子对形成的化学键
2. 非金属 由同种元素形成的共价键 由不同元素形成的共价键
3.
4. ①H2O:H
H
O
;②N2: N N
; ③H2O2:H
H
O
O
;
④CO2: O O
C
;⑤HClO: H
Cl
O
;⑥C2H2:H H
C C
;
5.①N≡N ②H—O—H ③O==C==O 6.只通过共价键
三、离子键
1.阴阳离子之间通过静电作用 2.活泼金属 和非金属
3. Cl
Cl
Mg2+
Cl
Mg
Cl
+
+
4. N
H
H
H
H
Cl
O O 2-
Na+
Na+
Na+
O H —
Ca2+
C C
2-
5. 通过离子键
【规律总结】
一、离子键与共价键、离子化合物与共价化合物的比较
1.
比较
离子键
共价键
概念
使阴、阳离子结合成化合物的静电作用
原子之间通过共用电子对 所形成的相互作用
分类
无
极性键
非极性键
成键粒子
阴、阳离子
原子
成键条件
活泼金属 元素与活泼非金属 元素之间
一般在非金属 原子之间
成键作用
静电作用
共用电子对
存在举例
2. ⑴阴阳离子 间以离子键 相结合的化合物 原子间以共用电子对 形成的化合物
阴离子和阳离子 原子或分子 不 能 能 不 不 不一定
⑵活泼金属 铵根离子 熔融状态下能导电的化合物 熔融状态下不导电的化合物 离子化合物 共价化合物
二、化学键与物质类别的关系 3.原子团离子
【对点训练】
1. A 2.B
相关文档
- 2021届高考化学一轮复习化学平衡图2021-04-14 10:24:5312页
- 2021届高考化学一轮复习化学键作业2021-04-14 09:52:014页
- 2021版高考化学一轮复习化学反应速2021-04-14 03:29:5716页
- 2021版高考化学一轮复习化学平衡常2021-04-13 21:10:2815页
- 2020届高考化学一轮复习化学反应速2021-04-13 19:56:5412页
- 2019届高考化学一轮复习化学反应的2021-04-13 19:38:145页
- 高考化学一轮复习化学平衡常数与平2021-04-13 15:09:0916页
- 2020届高考化学一轮复习化学平衡的2021-04-13 14:06:2019页
- 2020届高考化学一轮复习化学平衡常2021-04-13 02:10:2010页
- 通用版高考化学微一轮复习化学能与2021-04-13 01:36:0415页