- 1.25 MB
- 2021-04-13 发布
秘密★启用前
2018年重庆一中高2019级高二上期期末考试
化 学 试 题 卷 2018.1
化学试题共 7 页。满分100 分。时间 120 分钟。
注意事项:
1.答题前,务必将自己的姓名、准考证号填写在答题卡规定的位置上。
2.答选择题时,必须使用2B铅笔将答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦擦干净后,再选涂其他答案标号。
3.答非选择题时,必须使用0.5毫米黑色签字笔,将答案书写在答题卡规定的位置上。
4.所有题目必须在答题卡上作答,在试题卷上答题无效。
可能用到的相对原子质量: H 1 C 12 O 16 Na 23 Cl 35.5
Ⅰ卷(选择题,共42分)
选择题(本题包括21个小题,每小题只有一个选项符合题意,每小题2分,共42分)
1. 下列化学用语表示正确的是
A. 羟基的电子式:
B.乙烷分子的比例模型为:
C.1,1-二溴乙烯的结构式为:
D.CH2=CH—CH=CH2的名称为:1,3-二丁烯
2. 日前,西安交大和新加坡南洋理工大学联合团队在实验室成功合成了一种新型三维碳结构,这种碳被称为T-碳。T-碳与金刚石的关系是
A. 同系物 B. 同素异形体 C. 同分异构体 D. 同位素
3. 下列说法错误的是
A.催化重整是获得芳香烃的主要途径之一
B.重油的催化裂化主要是为提高轻质油的产量
C.“西气东输”工程中输送的气体主要成分为甲烷
D.煤经气化和液化等物理变化过程,可变为清洁能源
4. 下列有机物的沸点最高的是
A.丁烷 B. 2-甲基丙烷 C. 2-甲基丁烷 D. 2,2-二甲基丙烷
浓硫酸
140℃
NO2 + H2O
浓硫酸
∆
5. 下列反应不属于取代反应的是
H2O
∆
A. + HO-NO2
B. ClCH2CH=CH2 + NaOH HOCH2CH=CH2 + NaCl
乙醇
∆
C. 2 CH3CH2OH CH3CH2OCH2CH3+H2O
D. BrCH2CH3 + NaOH CH2 = CH2 ↑+ NaBr +H2O
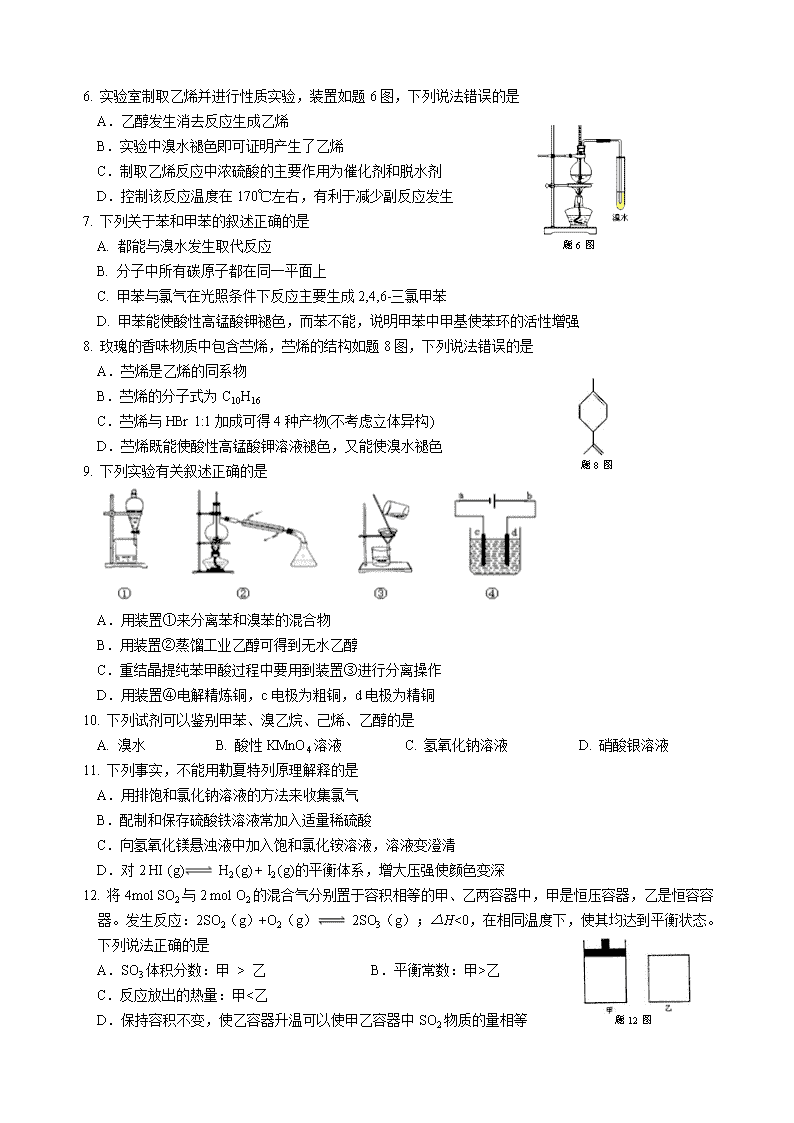
6. 实验室制取乙烯并进行性质实验,装置如题6图,下列说法错误的是
题6 图
A.乙醇发生消去反应生成乙烯
B.实验中溴水褪色即可证明产生了乙烯
C.制取乙烯反应中浓硫酸的主要作用为催化剂和脱水剂
D.控制该反应温度在170℃左右,有利于减少副反应发生
7. 下列关于苯和甲苯的叙述正确的是
A. 都能与溴水发生取代反应
B. 分子中所有碳原子都在同一平面上
C. 甲苯与氯气在光照条件下反应主要生成2,4,6-三氯甲苯
D. 甲苯能使酸性高锰酸钾褪色,而苯不能,说明甲苯中甲基使苯环的活性增强
8. 玫瑰的香味物质中包含苎烯,苎烯的结构如题8图,下列说法错误的是
题8 图
A.苎烯是乙烯的同系物
B.苎烯的分子式为C10H16
C.苎烯与HBr 1:1加成可得4种产物(不考虑立体异构)
D.苎烯既能使酸性高锰酸钾溶液褪色,又能使溴水褪色
9. 下列实验有关叙述正确的是
A.用装置①来分离苯和溴苯的混合物
B.用装置②蒸馏工业乙醇可得到无水乙醇
C.重结晶提纯苯甲酸过程中要用到装置③进行分离操作
D.用装置④电解精炼铜,c电极为粗铜,d电极为精铜
10. 下列试剂可以鉴别甲苯、溴乙烷、己烯、乙醇的是
A. 溴水 B. 酸性KMnO4溶液 C. 氢氧化钠溶液 D. 硝酸银溶液
11. 下列事实,不能用勒夏特列原理解释的是
A.用排饱和氯化钠溶液的方法来收集氯气
B.配制和保存硫酸铁溶液常加入适量稀硫酸
C.向氢氧化镁悬浊液中加入饱和氯化铵溶液,溶液变澄清
D.对2 HI (g) H2 (g) + I2 (g)的平衡体系,增大压强使颜色变深
题12 图
12. 将4mol SO2与2 mol O2的混合气分别置于容积相等的甲、乙两容器中,甲是恒压容器,乙是恒容容器。发生反应:2SO2(g)+O2(g) 2SO3(g);△H<0,在相同温度下,使其均达到平衡状态。下列说法正确的是
A.SO3体积分数:甲 > 乙 B.平衡常数:甲>乙
C.反应放出的热量:甲<乙
D.保持容积不变,使乙容器升温可以使甲乙容器中SO2物质的量相等
题13 图
13. 在恒容密闭容器中通入X并发生反应:2X(g)Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示。下列叙述正确的是
A.M点的 v正小于N点的v逆
B.M点时,升高温度平衡逆向移动
C.T2下,在0-t1时间内,v(X)= mol·L-1·min-1
D.W点时再加入一定量Y,平衡后Y的体积分数减小
14. 室温下,对于pH=11的氨水,下列判断正确的是
A.该氨水的浓度为1.0×10-3mol·L-1
B.加水稀释,溶液中所有离子的浓度均减小
C.加水稀释,溶液中c(NH4+)/c(NH3·H2O)变大
D.与pH=3的盐酸等体积混合,反应后溶液pH=7
15. 关于水的电离平衡,下列叙述正确的是
A.将水加热,pH不变
B.向水中滴入稀醋酸,c(H+)增大
C.恒温下,向水中加入少量硫酸,Kw增大
D.向水中加入少量醋酸铵固体,水的电离程度不变
16. 室温下,将pH=12的NaOH溶液平均分成两份,一份加水V1 L,另一份加入与该NaOH溶液物质的量浓度相等的硫酸V2 L,pH都降低了1,则V1 :V2 为(溶液体积可以叠加)
A.10 : 1 B.11 : 1 C.20 : 1 D.21 : 1
17. 下列应用与盐类的水解无关的是
A.明矾用于净水
B.次氯酸钠常用作消毒剂
C.FeCl3溶液滴入沸水中制Fe(OH)3胶体
D.用碳酸氢钠和硫酸铝两种溶液可制成泡沫灭火剂
18. 已知25℃时,电离常数Ka(HF)=3.6×10-4,溶度积常数Ksp(CaF2)=1.46×10-10。现向1 L 0.1mol·L-1HF溶液中加入0.1 mol CaCl2固体(不考虑溶液体积变化),则下列说法中错误的是
A. 原HF溶液c(H+)约为6×10-3mol·L-1
B. 加入 CaCl2后溶液中有CaF2沉淀产生
C. 加入CaCl2后溶液中的c(H+)浓度不变
D. 2HF(aq)+Ca2+(aq)=CaF2(s)+2H+(aq)的平衡常数为K=8.88×102
19.常温下,下列粒子浓度关系错误的是
A.0.1 mol·L-1CH3COONa溶液中:c(Na +)>c(OH-)>c(CH3COOH)>c(H+)
B.pH=5的CH3COOH和CH3COONa混合溶液中:c(CH3COO-)>c(Na+)
C.将0.2mol·L-1CH3 COOH溶液与0.1mo1·L-1NaOH溶液等体积混合:
c(CH3 COO一)+ c(CH3COOH) = 2c(Na+)
D.向0.10mol·L-1NH4HCO3溶液中通入CO2至中性:c(NH4+) = c(HCO3-)+ c(CO32-)
20.下列说法正确的是
A.能自发进行的反应一定是放热反应
B.能自发进行的反应,反应速率一定很大
C. 任何酸与碱发生中和反应生成1 mol H2O的过程中,反应热均相同
D.已知C(s,石墨)= C(s,金刚石)ΔH= + 1.5 kJ·mol-1 ,则石墨比金刚石稳定
稀溶液
21. 某生产工艺中用惰性电极电解Na2CO3溶液获得NaHCO3和NaOH,其原理如题21图。下列有关说法正确的是
A. a 接外电源负极
B. B出口为H2,C出口为NaHCO3溶液
C. 阳极电极反应为4CO32-+2H2O-4e- = 4HCO3-+O2↑
D. 应选用阳离子交换膜,电解时Na+从右侧往左移动
II卷(客观题,共58分)
2 HC ≡ CH H2C=CH—C ≡ CH
催化剂
22. (9分)乙炔是一种重要的有机化工原料,已知乙炔二聚反应如下:
催化剂
催化剂
HCl
一定条件
催化剂
Cl
B
D
E
A
乙炔
题21 图
三聚同理,现以乙炔为原料在一定条件下发生如下转化:
其中A为乙炔的二聚产物;E为乙炔的三聚产物,E分子中有四个碳原子在一条直线上,高分子D的结构为。 回答下列问题:
(1)乙炔的电子式为 。
(2)用电石制取乙炔的方程式为 。
(3)净化乙炔时,可用 (填试剂)除去其中的H2S、PH3等杂质气体。
(4)B的结构简式为 ,A→B的反应类型为 。
(5)E的结构简式为 。
(6)已知环己烯可由下列物质在一定条件反应下得到:
(也可表示为: )
有机物B在一定条件下反应,生成含六元环的二氯代烃G,G分子式为C8H10Cl2,写出G的结构简式
(任写两种即可)。
23.(13分)烃A是一种重要的有机化工原料,其相对分子质量Mr(A),90、<或=,下同),该反应ΔH 0 。简述理由 。
(4) 甲容器中,0~3s内的平均反应速率v(NO2)= 。
(5) 甲容器中NO2平衡转化率为 ,T1时该反应的平衡常数为 。
Y
题24 图
III. 将NO2(g)转化为N2O4(g),再以N2O4、O2、熔融NaNO3组成的燃料电池装置如题24图所示,在使用过程中石墨I电极反应生成一种氧化物Y。
(6)石墨I为 极(选填正、负),Y化学式为 。
(7)II电极反应式为 。
25. (18分)已知几种酸的电离常数如下:K(CH3COOH)=1.8×10-5;
K1(H2CO3)=4.4×10-7;K2(H2CO3)=4.7×10-11;K(HClO)=4.0×10-8。
I. (1)常温下,0.1mol·L-1的下列三种溶液:①CH3COONa溶液 ②Na2CO3溶液 ③NaClO溶液, 其pH由大到小的顺序是 (填序号);
(2)往NaClO溶液中通入少量CO2的离子反应方程式为 ;
题25 图
II. 常温下,在25.00 mL 0.1000 mol·L-1 Na2CO3溶液中滴加0.1000 mol·L-1盐酸,溶液的pH变化曲线如题25图所示。
(3)a点溶液中c(CO32-) :c(HCO3-) = 。
(4)b点溶液中溶质为 。b点溶液呈碱性的原因为 。
(5)b→c过程中的离子反应方程式为 。
III. 现有某碳酸钠和氢氧化钠的混合溶液,为测定其中各成分的浓度,某实验小组设计了如下方案,步骤如下(结合题25图回答下列问题):
①量取20.00mL样品溶液于锥形瓶中,加入几滴酚酞;
②用c mol·L-1的标准盐酸溶液滴定至终点;
③重复两次实验,消耗盐酸的体积平均值为V1 mL;
④另取20.00mL样品溶液于锥形瓶中,加入几滴甲基橙;
⑤用c mol·L-1的标准盐酸溶液滴定至终点;
⑥重复两次实验,消耗盐酸的体积平均值为V2 mL;
(6)步骤①中量取样品溶液所用仪器为 。
(7)步骤②终点现象为 。
(8)样品溶液中碳酸钠和氢氧化钠物质的量浓度之比为 。(用含c、V1、V2的式子表示)
若步骤⑥中滴定结束时仰视读数,所得c( Na2CO3) (选填“偏大”、“偏小”、“不影响”)。
命题:邹永平
2018年重庆一中高2019级高二上期期末化学答案
C B D C D B B A C A D A B C B D B C D D C
22. (9分)方程式2分,其余每个1分
(1)
(2)CaC2 + 2H2O = Ca(OH)2 + C2H2↑
(3)CuSO4 溶液
(4)H2C=CH—CCl=CH2 加成反应
(5)H2C=CH—C ≡ C—CH=CH2
(6)
23. (13分)方程式2分,其余每个1分
(1) CH 104 碳碳双键
(2) ,加聚反应
(3)
乙醇 ∆
CHBr-CH2Br + 2NaOH +2NaBr + 2H2O
(4)
(5) 4 (2分)
24. (18分)
(1)2NO(g)+2CO(g)N2(g) +2CO2(g) △H=-746.5kJ/mol 2分
(2) ②③ 2分
(3) >(1分),<(1分); T1温度下反应速率更快,所以温度更高,T1>T2;T2条件下平衡时,生成n(O2)更多,说明降温平衡正向移动,所以ΔH<0。 2分
(4) 0.24mol·L-1·s-1 2分
(5) 80% 2分 20 L/mol 2分
(6) 负(1分) N2O5 (1分)
(7) O2 +4e- +2N2O5 =4NO3- 2分
25. (18分)
(1) ②③① (2分)
(2) CO2 + ClO- + H2O = HClO + HCO3- (2分)
(3) 0.47 (2分)
(4) NaHCO3 NaCl (2分) HCO3-水解程度大于其电离程度(2分)
(5) H++ HCO3- = H2O + CO2↑ (2分)
(6) 碱式滴定管 (1分)
(7) 滴入最后一滴盐酸,溶液由红色变为无色 (2分)
(8) (V2-V1)/(2V1-V2) (2分) 偏大(1分)
审题:姜林 成龙