- 1.08 MB
- 2021-04-13 发布
第3节 化学实验方案的设计与评价
考纲定位
全国卷5年考情
1.了解化学实验是科学探究过程中的一种重要方法。
2.根据化学实验目的和要求能做到:
①设计实验方案;
②正确选用实验装置;
③分析或处理实验数据得出合理结论;
④掌握控制实验条件的方法;
⑤评价或改进实验方案。
2017年:Ⅰ卷T26;Ⅱ卷T28;Ⅲ卷T26
2016年:Ⅰ卷T13;Ⅱ卷T10、T26(1);Ⅲ卷T9、T26(6)
2015年:Ⅰ卷T26;Ⅱ卷T28
2014年:Ⅰ卷T26;Ⅱ卷T28
2013年:Ⅰ卷T26;Ⅱ卷T26
考点1| 化学实验方案的设计
(对应学生用书第200页)
[考纲知识整合]
1.基本原则
2.基本思路
了解实验目的→明确实验原理→掌握实验条件→选择仪器药品→设计装置步骤→记录现象数据→分析得出结论。
3.基本内容
4.实验设计的注意事项
(1)实验操作顺序
装置选择与连接→气密性检查→加固体药品→加液体药品→开始实验(按程序)→拆卸仪器→其他处理等。
(2)加热顺序选择
若气体制备实验需加热,应先加热气体发生装置,通入气体排出装置中的空气后,再给实验中需要加热的物质加热。目的:①防止爆炸(如氢气还原氧化铜);②保证产品纯度,防止反应物或生成物与空气中的物质反应。熄灭酒精灯的顺序则相反。
(3)防止试剂变质
①实验中反应物或产物若易吸水、潮解、水解等,要采取措施防止其吸水;
②易挥发的液体产物要及时冷却;
③易挥发的液体反应物需在反应装置中加装冷凝回流装置(如长导管、竖直的干燥管、冷凝管等);
④注意防止倒吸。
(4)画简单装置图
能够绘制和识别典型的实验仪器装置图,一般能画出简单的装置图即可,但要符合要求,例如形状、比例等。
(5)仪器连接问题
注意所选仪器是否恰当,安装顺序是否恰当,接口顺序是否恰当。
[高考命题点突破]
命题点1 物质制备为主体的方案设计
类型一 无机物的制备
[典例导航]
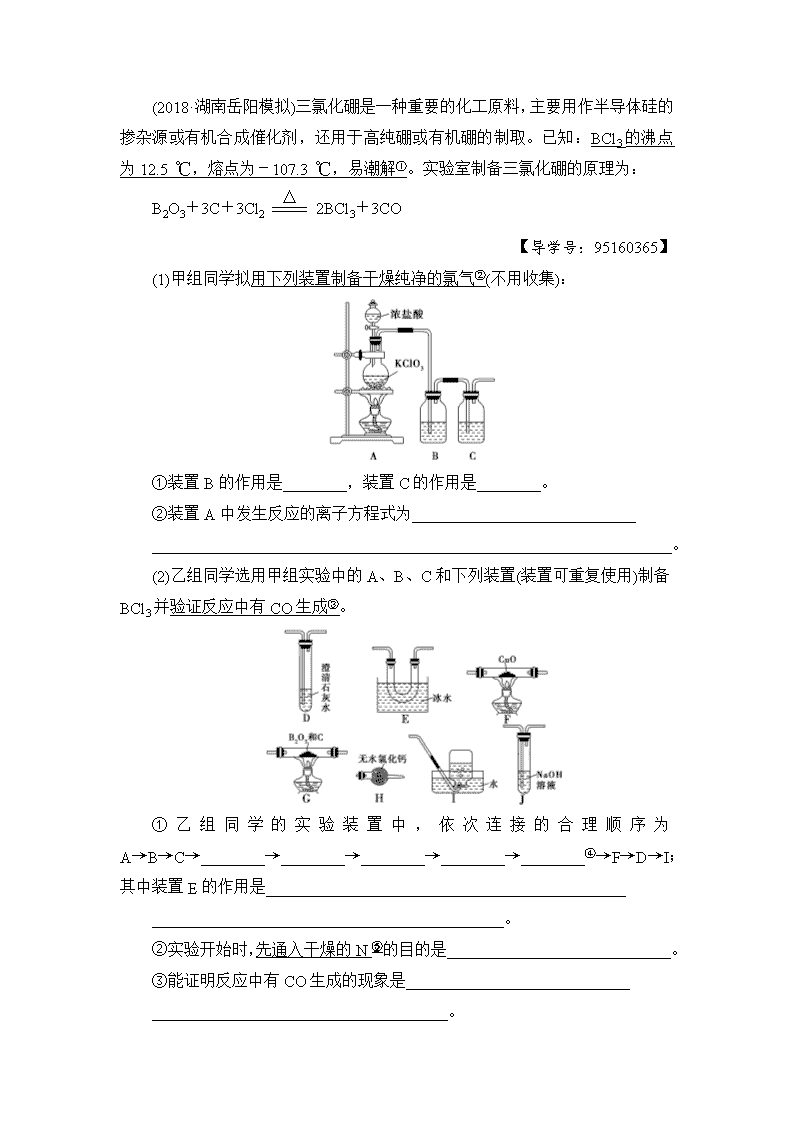
(2018·湖南岳阳模拟)三氯化硼是一种重要的化工原料,主要用作半导体硅的掺杂源或有机合成催化剂,还用于高纯硼或有机硼的制取。已知:BCl3的沸点为12.5_℃,熔点为-107.3_℃,易潮解①。实验室制备三氯化硼的原理为:
B2O3+3C+3Cl22BCl3+3CO
【导学号:95160365】
(1)甲组同学拟用下列装置制备干燥纯净的氯气②(不用收集):
①装置B的作用是________,装置C的作用是________。
②装置A中发生反应的离子方程式为____________________________
_________________________________________________________________。
(2)乙组同学选用甲组实验中的A、B、C和下列装置(装置可重复使用)制备BCl3并验证反应中有CO生成③。
①乙组同学的实验装置中,依次连接的合理顺序为A→B→C→________→________→________→________→________④→F→D→I;其中装置E的作用是_____________________________________________
____________________________________________。
②实验开始时,先通入干燥的N的目的是____________________________。
③能证明反应中有CO生成的现象是____________________________
_____________________________________。
④三氯化硼接触潮湿空气时会形成腐蚀性浓厚白雾⑥,其与水反应的化学方程式为________________________________。
[审题指导] ①根据BCl3的熔、沸点可确定,易液化,可用冷却水冷凝;易潮解要注意BCl3制备时水蒸气的影响,气体要干燥。
②干燥纯净的Cl2制取时注意除杂[杂质HCl、H2O(g)],及除杂的先后顺序为先除HCl再干燥。
③验证CO生成,一般是利用CO的还原性与CuO反应生成CO2,根据CO2存在证明CO的生成,但要注意CO2干扰。
④剩余4个装置,题中留有5个装置空白,说明有一装置重复。
⑤装置中的O2要与C反应,干扰实验,N2排空气,防止O2干扰。
⑥HCl在空气中易形成白雾。
【答案】 (1)①吸收Cl2中的HCl气体 干燥Cl2或吸收Cl2中的H2O(g)
②ClO+5Cl-+6H+3Cl2↑+3H2O
(2)①G、E、H、J、H 冷凝BCl3为液体
②排除装置中的空气,防止O2的干扰
③装置,装置F中黑色粉末变为红色中D澄清石灰水变浑浊
④BCl3+3H2O===H3BO3+3HCl
[题后归纳] 物质制备与提纯的思维流程
[对点训练]
1.(2017·广州一测)高纯MnCO3是广泛用于电子行业的强磁性材料。MnCO3
为白色粉末,不溶于水和乙醇,在潮湿环境下易被氧化,温度高于100 ℃开始分解。
Ⅰ.实验室以MnO2为原料制备MnCO3
(1)制备MnSO4溶液:
①主要反应装置如图所示,缓缓通入经N2稀释的SO2气体,发生反应H2SO3+MnO2===MnSO4+H2O。下列措施中,目的是加快反应速率的是________(填标号)。
A.MnO2加入前先研磨
B.搅拌
C.提高混合气中N2比例
②已知实验室制取SO2的原理是Na2SO3+2H2SO4(浓)===2NaHSO4+SO2↑+H2O。选择下图所示部分装置与上图装置相连制备MnSO4溶液,应选择的装置有________(填标号)。
③若用空气代替N2进行实验,缺点是_____________________________
________________________________________________________________ (酸性环境下Mn2+不易被氧化)。
(2)制备MnCO3固体:
实验步骤:①向MnSO4溶液中边搅拌边加入饱和NH4HCO3溶液生成MnCO3沉淀,反应结束后过滤;
②……
③在70~80 ℃下烘干得到纯净干燥的MnCO3固体。步骤②需要用到的试剂有________。
Ⅱ.设计实验方案
(3)利用沉淀转化的方法证明Ksp(MnCO3)Cl2>Br2。限选试剂:NaBr溶液、KMnO4、浓盐酸、浓硫酸。
装置d中盛放的试剂是________;实验中观察到的现象为_____________________________________;
此实验装置的不足之处是__________________________________________。
【解析】 需要判断氧化性KMnO4>Cl2>Br2,可利用氧化剂的氧化性大于氧化产物的氧化性来进行判断,用KMnO4和浓盐酸反应制取Cl2,用Cl2和NaBr反应制取Br2,装置d中盛放的试剂是NaBr溶液,实验现象为c中有黄绿色气体产生,d中溶液变为棕(橙)黄色;Cl2是有毒气体,需要尾气处理装置。
【答案】 NaBr溶液 c中有黄绿色气体产生,d中溶液变为棕(橙)黄色 没有尾气吸收装置
4.(2018·广西调研)某研究性学习小组的同学为了探究NO的性质,进行了如下实验。
甲 乙
(1)甲同学设计了图甲装置进行实验,观察到集气瓶中收集到无色气体,由此确定铜和稀硝酸反应生成NO气体。甲同学的推断________(填“正确”或“
不正确”),理由是________________________________________________________
________________________________________________________________。
(2)乙同学不同意甲同学的推断,他观察到图甲装置圆底烧瓶中的气体不是无色。为此乙同学设计了图乙装置进行实验,步骤为:
①在大试管中放入适量石灰石,加入过量稀硝酸;
②待石灰石反应完全,将铜丝浸入过量的稀硝酸中;
③一段时间后,观察到大试管中气体始终为无色,收集反应产生的气体;
④待集气瓶充满气体后从水槽中取出,敞口正放在桌面上,观察到瓶口气体颜色有变化,证明稀硝酸与铜反应生成NO。
步骤①的作用是:__________________________;步骤④瓶口气体的颜色变化是________。
(3)当过量的铜与稀硝酸完全反应后,再加入20%的稀硫酸,铜片上又有气泡产生,稀硫酸的作用是________(填正确选项的编号),反应的离子方程式是:_______________________________________________________________。
a.还原剂 b.氧化剂
c.酸化 d.提供热能
【解析】 (2)乙同学的设计中,使稀硝酸先与碳酸钙反应产生CO2将装置内的空气排尽,以避免空气中的氧气对实验产生干扰。(3)过量的铜与稀硝酸完全反应后所得溶液的溶质为硝酸铜,在铜片过量的情况下,再加入稀硫酸,提供了足量的H+,NO在H+存在的情况下继续和铜反应生成NO。
【答案】 (1)不正确 NO2能与水反应生成NO,无论铜与稀硝酸反应生成的是NO还是NO2,集气瓶中收集到的气体都是NO
(2)排净装置内的空气 无色变成红棕色
(3)c 3Cu+2NO+8H+===3Cu2++2NO↑+4H2O
[易错防范] 实验装置需改进的4个角度
(1)无尾气处理装置。
(2)无防倒吸装置。
(3)定量实验时无法排出生成的气体被完全吸收。
(4)易潮解或易被氧化或易与CO2反应的物质制备时,最后没有连防空气进入的装置。
相关文档
- 2021版高考化学一轮复习化学平衡常2021-04-13 21:10:2815页
- 2020届高考化学一轮复习化学反应速2021-04-13 19:56:5412页
- 2019届高考化学一轮复习化学反应的2021-04-13 19:38:145页
- 高考化学一轮复习化学平衡常数与平2021-04-13 15:09:0916页
- 2020届高考化学一轮复习化学平衡的2021-04-13 14:06:2019页
- 2020届高考化学一轮复习化学平衡常2021-04-13 02:10:2010页
- 通用版高考化学微一轮复习化学能与2021-04-13 01:36:0415页
- 2020届高考化学一轮复习化学计量在2021-04-12 23:31:584页
- 2019高考化学一轮复习化学实验综合2021-04-12 21:18:129页
- 2019届高考化学一轮复习化学反应与2021-04-12 13:06:2518页