- 245.78 KB
- 2021-04-13 发布
2018—2019 学年度上学期第二次月考 高二年级化学科试卷
答题时间:90 分钟 满分:100 分 命题人、校对人:高二化学组
可能用到的相对原子质量:Fe-56 Cu-64
一、选择题(本题包括 20 个小题,每题只有一个选项是正确的,每题 3 分,共 60 分)
1.一定温度下反应:A2(g)+3B2(g)⇌2AB3(g)(每生成 2mol AB3 放出 92.4kJ 的热量),在恒温恒压的密闭容器中进行如下实验:①通入 1mol A2 和 3mol B2,达平衡时放出热量为 Q1,
②通入 2mol A2 和 6mol B2,达平衡时放出热量为 Q2,则下列关系正确的是( )
A.Q2=2 Q1 B.2Q1<Q2
C.Q1<Q2<92.4 kJ D.Q1=Q2<92.4 kJ
2. 在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应
A(g)+2B(g) ⇌C(g)+D(g)已达到平衡状态 ( )
①混合气体的压强 ②混合气体的密度 ③B 的物质的量浓度 ④混合气体的总物质的量
⑤混合气体的平均相对分子质量 ⑥v(C)与 v(D)的比值 ⑦混合气体的总质量 ⑧混合气体的总体积 ⑨C、D 的分子数之比为 1∶1
A.①②③④⑤⑥⑦⑧ B.①③④⑤
C.①②③④⑤⑦ D.①③④⑤⑧⑨
3.下列变化不能用勒夏特列原理解释的是( )
A.工业合成氨的反应,往往需要使用催化剂
B.工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率
C.Fe(SCN)3 溶液中加入少量固体 KSCN 后颜色变深
D.实验室用排饱和食盐水的方法收集氯气
4.下列有关问题,与盐的水解有关的是 ( )
①NH4Cl 与 ZnCl2 溶液可作焊接金属中的除锈剂;
②用 NaHCO3 与 Al2(SO4)3 两种溶液可作泡沫灭火剂;
③草木灰(K2CO3)与铵态氮肥不能混合施用
④除去 MgCl2 溶液中的 Fe3+可选用 MgO 固体;
⑤热的纯碱溶液去污效果更好。
A.①②③⑤ B.②③④ C.①②④⑤ D.①②③④⑤
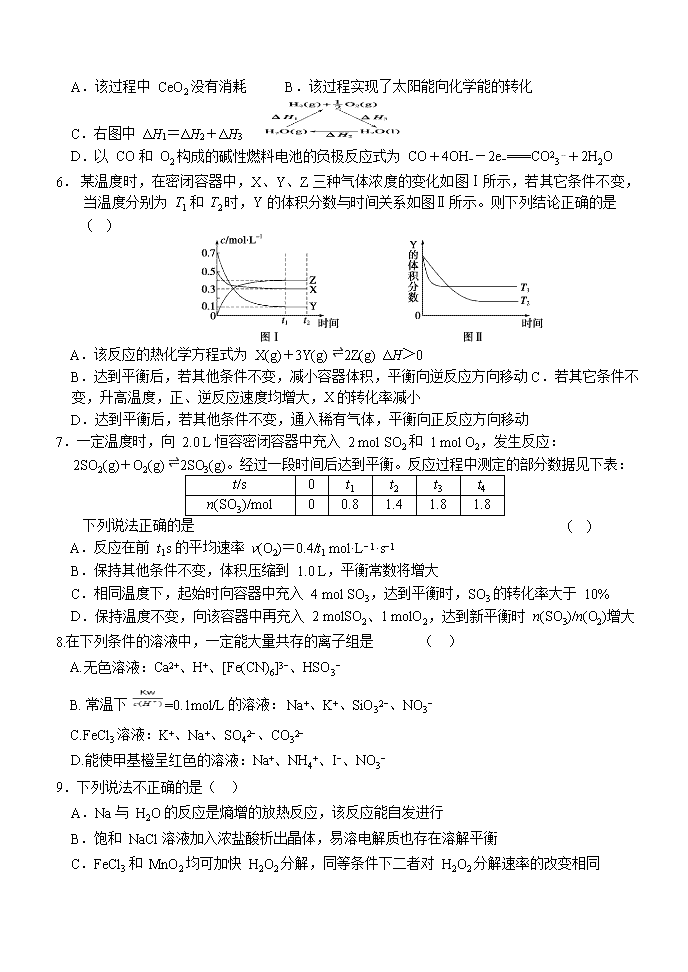
5.某科学家利用二氧化铈(CeO2)在太阳能作用下将 H2O、CO2 转变为 H2、CO。其过程如下: mCeO2(m-x)CeO2·xCe+xO2 (m-x)CeO2·xCe+xH2O+xCO2mCeO2+xH2+xCO 下列说法不正确的是 ( )
A.该过程中 CeO2 没有消耗 B.该过程实现了太阳能向化学能的转化
C.右图中 ΔH1=ΔH2+ΔH3
D.以 CO 和 O2 构成的碱性燃料电池的负极反应式为 CO+4OH−-2e−===CO23-+2H2O
6. 某温度时,在密闭容器中,X、Y、Z 三种气体浓度的变化如图Ⅰ所示,若其它条件不变,当温度分别为 T1 和 T2 时,Y 的体积分数与时间关系如图Ⅱ所示。则下列结论正确的是
( )
A.该反应的热化学方程式为 X(g)+3Y(g) ⇌2Z(g) ΔH>0
B.达到平衡后,若其他条件不变,减小容器体积,平衡向逆反应方向移动 C.若其它条件不变,升高温度,正、逆反应速度均增大,X 的转化率减小
D.达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动
7.一定温度时,向 2.0 L 恒容密闭容器中充入 2 mol SO2 和 1 mol O2,发生反应:
2SO2(g)+O2(g) ⇌2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s
0
t1
t2
t3
t4
n(SO3)/mol
0
0.8
1.4
1.8
1.8
下列说法正确的是 ( )
A.反应在前 t1s 的平均速率 v(O2)=0.4/t1 mol·L−1·s−1
B.保持其他条件不变,体积压缩到 1.0 L,平衡常数将增大
C.相同温度下,起始时向容器中充入 4 mol SO3,达到平衡时,SO3 的转化率大于 10%
D.保持温度不变,向该容器中再充入 2 molSO2、1 molO2,达到新平衡时 n(SO3)/n(O2)增大
8.在下列条件的溶液中,一定能大量共存的离子组是 ( )
A.无色溶液:Ca2+、H+、[Fe(CN)6]3−、HSO3−
B. 常温下=0.1mol/L 的溶液: Na+、K+、SiO32−、NO3−
C.FeCl3 溶液:K+、Na+、SO42−、CO32−
D.能使甲基橙呈红色的溶液:Na+、NH4+、I−、NO3−
9.下列说法不正确的是( )
A.Na 与 H2O 的反应是熵增的放热反应,该反应能自发进行
B.饱和 NaCl 溶液加入浓盐酸析出晶体,易溶电解质也存在溶解平衡
C.FeCl3 和 MnO2 均可加快 H2O2 分解,同等条件下二者对 H2O2 分解速率的改变相同
D.Mg(OH)2 固体在溶液中存在平衡:Mg(OH)2(s)⇌Mg2+(aq)+2OH﹣(aq),该固体可溶于
NH4Cl 溶液
10.下列反应的离子方程式正确的是 ( )
A.用石墨作电极电解 AlC13 溶液:2Cl-+2H2OCl2↑+H2↑+2OH−
B.酸性高锰酸钾溶液与 H2O2 溶液混合:2MnO4−+ 3H2O2 + 6H+ = 2Mn2+ + 4 O2↑+6H2O
C.向硫代硫酸钠溶液中滴加稀硫酸:3S2O32−+2H+=2SO42−+4S↓+H2O
D.向 Mg(HCO3)2 溶液中加入足量 Ca(OH)2 的溶液:
Mg2++2HCO3−+4OH−+2 Ca2+=3H2O+2CaCO3↓+ Mg(OH)2↓
11.如下图所示,隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N 两个容器中均发生反应:
A(g)+3B(g) ⇌2C(g) ΔH=-192 kJ·mol-1。向 M、N 中,分别通入 x mol A 和 y mol B 的
混合气体,初始 M、N 容积相同,保持温度不变。下列说法正确的是 ( )
A.若平衡时 A 气体在两容器中的体积分数相等,则 x 一定等于 y
B.若 x∶y=1∶2,则平衡时,M 中的转化率:A>B
C.若 x∶y=1∶3,当 M 中放出热量 172.8 kJ 时,A 的转化率为 90%
D.若 x=1.2,y=1,N 中达到平衡时体积为 2 L,含有 C 0.4 mol,再通入 0.36 mol A 时, v 正>v 逆
12.下述实验不能..达到预期实验目的的是 ( )
序号
实验内容
实验目的
A
向5mL0.1mol/LK2Cr2O7溶液中滴加5滴浓硫酸
探究反应物浓度增大对化学平衡的影响
B
向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液
说明一种沉淀能转化为另一种溶解度更小的沉淀
C
室温下,用pH计测定浓度为0.1mol·L−1NaClO 溶液和0.1mol·L−1CH3COONa溶液的pH
比较HClO 和CH3COOH的酸性强弱
D
室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸
研究浓度对反应速率的影响
13.下列说法正确的是 ( )
A.反应 2Mg+CO22MgO+C△H<0 从熵变角度看,可自发进行
B.在密闭容器发生可逆反应:2NO(g)+2CO(g)⇌N2(g)+2CO2(g)△H=-113.0 kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,△H 变小
C.根据 HClO 的 Ka=3.0×10−8,H2CO3的 Ka1=4.3×10−7,Ka2=5.6×10−11,可推测相同状况下,等浓度的 NaClO 与 Na2CO3溶液中,pH 前者小于后者
D.已知:Ksp(AgCl)=1.8×10−10,Ksp(Ag2CrO4)=2.0×10−12,将等体积浓度为
1.0×10﹣4mol/L 的 AgNO3溶液滴入到浓度均为 1.0×10﹣4mol/L 的 KCl 和 K2CrO4的混合溶液中产生两种不同沉淀,且 Ag2CrO4沉淀先产生
14.下列关系式中,正确的是 ( )
A.等浓度等体积的 CH3COOH 和 CH3COONa 溶液混合: c(CH3COO−)+c(OH−)=c(H+)+c(CH3COOH) B.常温下,0.1 mol•L−1HA 溶液与 0.1 mol•L−1NaOH 溶液等体积完全反应时,溶液中一定存在:c(Na+)=c(A−)>c(OH−)=c(H+)
C.常温下,0.1 mol•L−1Na2S 溶液中存在:c(OH﹣)=c(H+)+c(HS﹣)+c(H2S) D.常温下,将 0.1 mol•L﹣1 CH3COOH 溶液加水稀释,当溶液的 pH 从 3.0 升到 5.0 时,溶液
中的值增大到原来的 100 倍
15.常温下,向 20.00 mL 0.100 mol·L−1 CH3COONa 溶液中逐滴加入 0.100 0 mol·L-1 盐酸,溶液的 pH 与所加盐酸体积的关系如下图所示(不考虑挥发)。下列说法正确的是( )
A.点①所示溶液中:c(CH3COOH)=c(Cl−)>c(OH−)=c(H+)
B.点②所示溶液中:c(Na+)>c(Cl−)>c(CH3COO−)>c(CH3COOH)
C.点③所示溶液中:c(CH3COOH)>c(Na+)>c(H+)>c(CH3COO−)
D.整个过程中可能出现:c(H+)+c(Na+)=c(CH3COOH)+c(CH3COO−)
16.已知:pKa=−lgKa,25℃时,H2SeO3 的 pKa1=1.34, pKa2=7.34。用 0.1mol•L−1NaOH 溶液滴定 20mL0.1mol•L−1H2SeO3 溶液的滴定曲线如图所示(曲线上的数字为 pH)。下列说法不正确的是 ( )
A.a 点所得溶液中:2c(H2SeO3)+c(SeO32−)<0.1 mol•L−1
B.b 点所得溶液中:c(H2SeO3)+c(H+)=c(SeO32−)+c(OH−)
C.c 点所得溶液中:c(Na+)<3c(HSeO3−)
D.d 点所得溶液中:c(Na+)>c(SeO32−)>c(HSeO3−)
17.如图甲是利用一种微生物将废水中的尿素【CO(NH2)2】的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置的电能在铁上镀铜,下列说法中正确的是( )
A.铜电极应与 X 相连接
B.H 十透过质子交换膜由右向左移动
C.当 N 电极消耗 0.25mol 气体时,则铁电极增重 16g
Fe
(
OH
)
2
+
Ni
(
OH
)
2
;装置(
Ⅱ
)
D.M 电极反应式:H2NCONH2+H2O﹣6e−═CO2↑+N2↑+6H+ 18.装置(Ⅰ)为铁镍(Fe﹣Ni)可充电电池:Fe+NiO2
为电解示意图,当闭合开关 K 时,Y 附近溶液先变红.下列说法正确的是( )
A.闭合 K 时,X 的电极反应式为:2H++2e−═H2↑
B.给装置(Ⅰ)充电时,OH−通过阴离子交换膜,移向 A 电极
C.给装置(Ⅰ)充电时,B 极参与反应的物质被氧化
D.闭合 K 时,A 电极反应式为:NiO2 + 2e− +2H+═Ni(OH)2
19.电解 NaB(OH)4 溶液制备 H3BO3 的原理如下图所示,下列叙述错误的是 ( )
A.M 室发生的电极反应式:2H2O-4e−=O2↑+4H+
B.a、c 为阴离子交换膜,b 为阳离子交换膜
C.N 室中:a%