- 786.50 KB
- 2021-04-13 发布
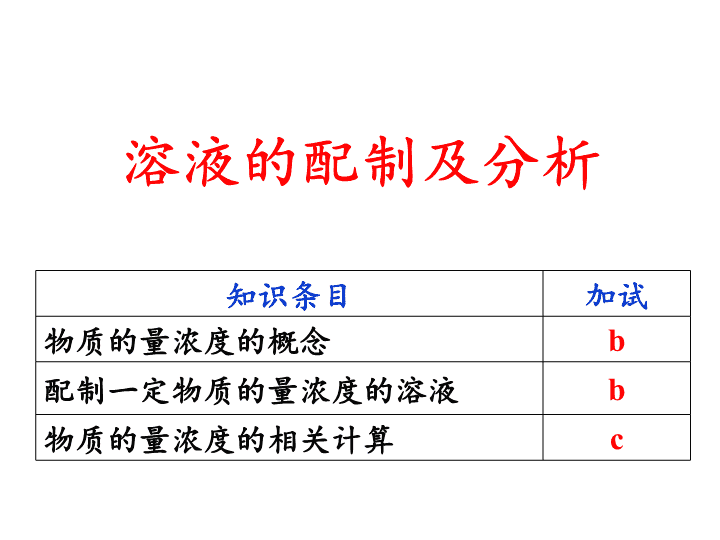
溶液的配制及分析
知识条目
加试
物质的量浓度的概念
b
配制一定物质的量浓度的溶液
b
物质的量浓度的相关计算
c
[
真题回顾
]
[2016-4]
29. Cl
2
与
NaOH
溶液反应可生成
NaCl
、
NaClO
和
NaClO
3
,
c
(Cl
ˉ)
和
c
(ClO
ˉ)
的比值与反应温度有关。用
24 g NaOH
配成的
250 mL
溶液,与
Cl
2
恰好完全反应(忽略
Cl
2
与水的反应、盐类的水解及溶液体积变化)。
(1) NaOH
溶液的物质的量浓度
______
mol·Lˉ
1
。
(2)
某温度下,反应后溶液中
c
(Cl
ˉ)
=
6
c
(ClO
ˉ)
,则溶液中
c
(ClO
ˉ)
=
______
mol·Lˉ
1
。
2.4
0.3
一、物质的量浓度
1
、概念:
单位体积
溶液
中所含
溶质
B
的物质的量
n
B
V
c
B
=
moL·L
-1
[
例
]
(1)
含
N
A
个
Na
+
的
Na
2
O
2
溶解于
1L
水中,
Na
+
的物质的量浓度为
1 mol·L
-1
(2)1L 1mol/L MgCl
2
溶液中
Mg
2
+
的数目小于
N
A
(3)
从
1L 2mol/L
的
H
2
SO
4
溶液中取出
0.5L
,该溶液的浓度为
1mol/L
(4)
从
1L 2mol/L
的
H
2
SO
4
溶液中取出
0.5L
,则剩下溶液中溶质的物质的量为
1mol
[
易错归纳
]
1
、
正确判断溶液的溶质
(1)
与水发生反应生成新的物质,如
Na
、
Na
2
O
、
Na
2
O
2
→
NaOH
;
SO
3
→
H
2
SO
4
;
NO
2
→
HNO
3
。
(2)
特殊物质:如
NH
3
溶于水后溶质为
NH
3
·H
2
O
,但计算浓度时仍以
NH
3
作为溶质。
(3)
含结晶水的物质:
CuSO
4
·5H
2
O→CuSO
4
;
Na
2
CO
3
·10H
2
O→Na
2
CO
3
。
2
、
准确计算溶液的体积
c
=
n/
V
中的
V
是溶液的体积,不是溶剂的体积,也不是溶质和溶剂的体积之和。
3
、
部分与整体的关系
溶质的浓度和离子的浓度不同,要注意根据化学式具体分析,如
1 mol·L
-
1
的
Al
2
(SO
4
)
3
溶液中,
SO
4
2-
的物质的量浓度是
3 mol·L
-
1
。
[
例
]
已知某饱和
NaCl
溶液的体积为
V
mL
,密度为
ρ
g/cm
3
,溶质的质量分数为
w
,物质的量浓度为
c
mol/L
,溶液中含
NaCl
的质量为
m
g
。
(1)
用
m
、
V
表示溶液的物质的量浓度
(2)
用
w
、
ρ
表示溶液的物质的量浓度
(3)
用
c
、
ρ
表示溶质的质量分数
(4)
用
w
表示该温度下
NaCl
的溶解度
2
、有关
物质的量浓度的
表示
牢记定义式,灵活利用守恒推导。
灵活运用假设,注意单位换算
。
[
练习
]
将标准状况下的
a
L
氯化氢气体溶于
100 g
水中,得到的盐酸的密度为
b
g/mL
,则该盐酸的物质的量浓度
(mol/L)
是
[
真题回顾
]
[2015-10]
29.
量取
8.0 mL 5.0 mol·Lˉ
1
H
2
SO
4
溶液,加蒸馏水稀释至
100 mL
,取两份稀释后的
H
2
SO
4
溶液各
25 mL
,分别加入等质量的
Zn
和
Fe
,相同条件下充分反应,产生氢气的体积随时间变化的曲线如图所示
(
氢气体积已折算成标准状况下的体积
)
。
请计算:
(1)
稀释后
H
2
SO
4
溶液的物质的量浓度为
________mol·Lˉ
1
。
(2)
加入
Fe
的质量至少有
________g
。
0.40
0.65
3
、有关溶液稀释或混合的计算
[
例
]
某
Al
2
(SO
4
)
3
溶液
V
mL
中含
ag Al
3+
,取
V
/4 mL
溶液稀释成
4
V
mL
后,
SO
4
2-
的物质的量浓度为
( )
A.125/54
V
B.125a/36
V
C.125a/18
V
D.125a/
V
B
溶液稀释或混合的计算,要活用“守恒思想”
1
、
溶液稀释
前后
溶质的质量
或物质的量
在稀释前后保持不变
,
即
:
m
1
w
1
=
m
2
w
2
或
c
1
V
1
=
c
2
V
2
;
2
、
同溶质溶液的混合
:
c
1
V
1
+
c
2
V
2
=
c
混
V
混
;
3
、质量分数为
a%
的溶液加等体积水稀释后的质量分数大于或小于
0.5a%
?
[2015-10]
24
.下列说法不正确的是
A
.定容时,因不慎使液面高于容量瓶的刻度线,可用滴管将多余液体吸出
B
.焰色反应时,先用稀盐酸洗涤铂丝并在酒精灯火焰上灼烧,然后再进行实验
C
.将新制氯水滴入紫色石蕊溶液中,可以看到石蕊溶液先变红后褪色
D
.取少量晶体放入试管中,再加入适量
NaOH
溶液,加热,在试管口用湿润的红色石蕊试纸检验,若试纸变蓝,则可证明该晶体中含有
NH
4
+
A
[
真题回顾
]
[2016-4]
9
.下列说法正确的是
A
.某试样焰色反应呈黄色,则试样中含有
K
+
B
.广泛
pH
试纸测得某碱性溶液的
pH
为
12.5
C
.容量瓶不能用作溶解物质的容器
D
.粗盐的提纯试验中,滤液在坩埚中加热蒸发结晶
C
[
真题回顾
]
[2017-4]
10
.下列说法不正确的是
A
.实验室应将钠保存在煤油中
B
.分液漏斗和容量瓶在使用前都要检漏
C
.可用酒精代替
CCl
4
萃取碘水中的碘单质
D
.金属镁失火不可用水来灭火
C
[2016-10]
28.
用无水
Na
2
CO
3
固体配制
250 mL 0.1000 mol
·
L
-1
的溶液。
请回答:
(1)
在配制过程中不必要的玻璃仪器是
。
A
.烧杯
B
.量筒
C
.玻璃棒
D
.胶头滴管
E
.容量瓶
(2)
定容时的操作:当液面接近容量瓶刻度线时,
,
再将容量瓶塞盖好,反复上下颠倒,摇匀。
(3)
下列操作会使配得的
Na
2
CO
3
溶液浓度偏低的是
。
A
.称取相同质量的
Na
2
CO
3
·
10H
2
O
固体进行配制
B
.定容时俯视容量瓶的刻度线
C
.摇匀后发现液面低于容量瓶刻度线,再滴加蒸馏水至刻度线
D
.转移洗涤液时洒到容量瓶外,继续用该未清洗的容量瓶重新配制
B
用胶头滴管滴加蒸馏水至溶液凹液面正好与刻度线相切
AC
[
真题回顾
]
二、一定物质的量浓度溶液的配制
1
、配制过程
[
例
]
判断正误。
(1)
容量瓶在使用前应检查是否漏液
(
)
(2)
实验室需要
950mL 0.1 mol/L
的
NaCl
溶液,配制时应选用
1000mL
容量瓶
(
)
(3)
若移液前容量瓶内有少量水,能使所配溶液浓度偏低
(
)
(4)
配制一定物质的量浓度的溶液时,两次用到玻璃棒,其作用分别是搅拌和引流
(
)
√
√
×
√
[
易错归纳
]
1
、
配制一定物质的量浓度的溶液,是
将一定质量或体积的溶质在选定的容量瓶中定容,
不必计量水的用量。
2
、
配制
NaOH
溶液时,必须
用小烧杯快速称量
NaOH
固体
,
不能将
NaOH
直接放在纸上
,因
NaOH
固体易潮解,且易与空气中的
CO
2
反应。
3
、
容量瓶
不能配制任意体积的溶液,不能溶解、稀释和贮存液体,不能用作反应器。
2
、
配制过程中的误差分析
[
例
]
用“偏大”“偏小”或“无影响”填空。
(1)
配制
500mL 1mol/L
的硫酸铜溶液,用托盘天平称取胆矾
80.0g
:
________
。
(2)
用
Na
2
CO
3
·10H
2
O
晶体配制
Na
2
CO
3
溶液,
Na
2
CO
3
晶体已部分失去结晶水,用该晶体所配
Na
2
CO
3
溶液的物质的量浓度:
________
。
(3)
配制
NaOH
溶液时,天平的两个托盘上放两张质量相等的纸片,其他操作均正确:
________
。
(4)
配制
NaOH
溶液时,
NaOH
固体放在烧杯中称量时间过长:
________
。
(5)
配制一定物质的量浓度
NaOH
溶液,需称量
4.4g
,称量时砝码和药品放置颠倒
(
用到游码
)
:
________
。
偏小
偏
大
偏小
偏小
偏小
[
例
]
用“偏大”“偏小”或“无影响”填空。
(6)
用量筒量取浓硫酸倒入小烧杯后,用蒸馏水洗涤量筒并将洗涤液转移至小烧杯中:
_______
。
(7)
用量筒量取浓硫酸时,仰视读数:
_______
。
(8)
配制
NaOH
溶液时,将称好的
NaOH
固体放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容:
_____
。
(9)
转移后,未洗涤小烧杯和玻璃棒,或者未将洗涤液一并转移至容量瓶中:
_______
。
(10)
定容时,加水超过刻度线,用胶头滴管吸取多余的液体至刻度线:
_______
。
偏
大
偏
大
偏
大
偏
小
偏
小
2
、
配制过程中的误差分析
(2)
容量瓶读数所造成的误差图示:
[
例
]
(江苏卷)用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范的是
( )
A
.称量
B
.溶解
C
.转移
D
.定容
B
2
、
配制过程中的误差分析
[
练习
]
实验室需要配制
0.50mol/L NaCl
溶液
480mL
。按下列操作步骤填上适当的文字,以完成整个操作。
(1)
选择仪器。完成本实验所必需的仪器有:托盘天平
(
精确到
0.1 g)
、药匙、烧杯、玻璃棒、
、
以及等质量的几片滤纸。
(2)
计算。配制该溶液需称取
NaCl
的质量为
g
。
(3)
称量。
①天平调平之后,应将天平的游码调至某个位置,请在下图中用一根竖线标出游码左边缘所
处的位置:
②
称量过程中
NaCl
晶体应放于天平
的
______(
填“左
盘
”或“右盘”
)
。
③称量完毕,将药品倒入烧杯中。
(4)
溶解、冷却,该步实验中需要使用玻璃棒,目的是
。
500mL
容量瓶
胶头滴管
14.6
左盘
搅拌,加速溶解
(5)
转移、洗涤。在转移时应使用
引流,洗涤烧杯
2
~
3
次是为了
。
(6)
定容,摇匀。
(7)
在配制过程中,某学生观察定容时液面情况如图所示,所配溶液的浓度会
________(
填“偏高”“偏低”或“无影响”
)
。
玻璃棒
保证溶质全部转移至容量瓶中
偏低