- 297.50 KB
- 2021-04-12 发布
一、选择题(本题包括15小题,每小题2分,共30分。每题只有一个选项最符合题意。)
1、关于浓度均为0.1mol·L-1的三中溶液:①氨水 ②盐酸 ③氯化铵溶液,下面说法不正确的是
A.c(NH4+):③>①
B.水电离出的c(H+):②>①
C.①和②等体积混合后的溶液:c(H+)=c(OH-)+c(NH3·H2O)
D.①和③等体积混合后的溶液:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
2、向含有MgCO3固体的溶液中滴加少许浓盐酸(忽略体积变化),下列数值变小的是
A.c(CO32-) B.c(Mg2+) C.c(H+) D.Ksp(MgCO3)
3、下列图示与对应的叙述不相符合的是
A.图甲表示燃料燃烧反应的能量变化
B.图乙表示酶催化反应的反应速率随反应温度的变化
C.图丙表示弱电解质在水中建立电离平衡的过程
D.图丁表示强碱滴定强酸的滴定曲线
4、盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是
A.向NaHCO3溶液中加入与其等物质的量的NaOH固体,溶液中的阴离子只有CO32-和OH-
B.NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-)
C.10 mL 0.10 mol•L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.完全中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同
5、下列有关说法中错误的是
A.某燃料电池用熔融碳酸盐作电解质,两极分别通入CO和O2,则通入CO的一极为负极,电极反应式为CO - 2e-+CO32-=2CO2
B.Zn粒与稀硫酸反应制氢气时,为加快反应速率,可在反应过程中滴加几滴CuSO4溶液
C.根据自发氧化还原反应Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O设计原电池,可在常温下用铜和铁作电极,使用浓硝酸作电解质溶液
D.原电池中电子从负极出发,经外电路流向正极,再从正极经电解液回到负极构成闭合回路
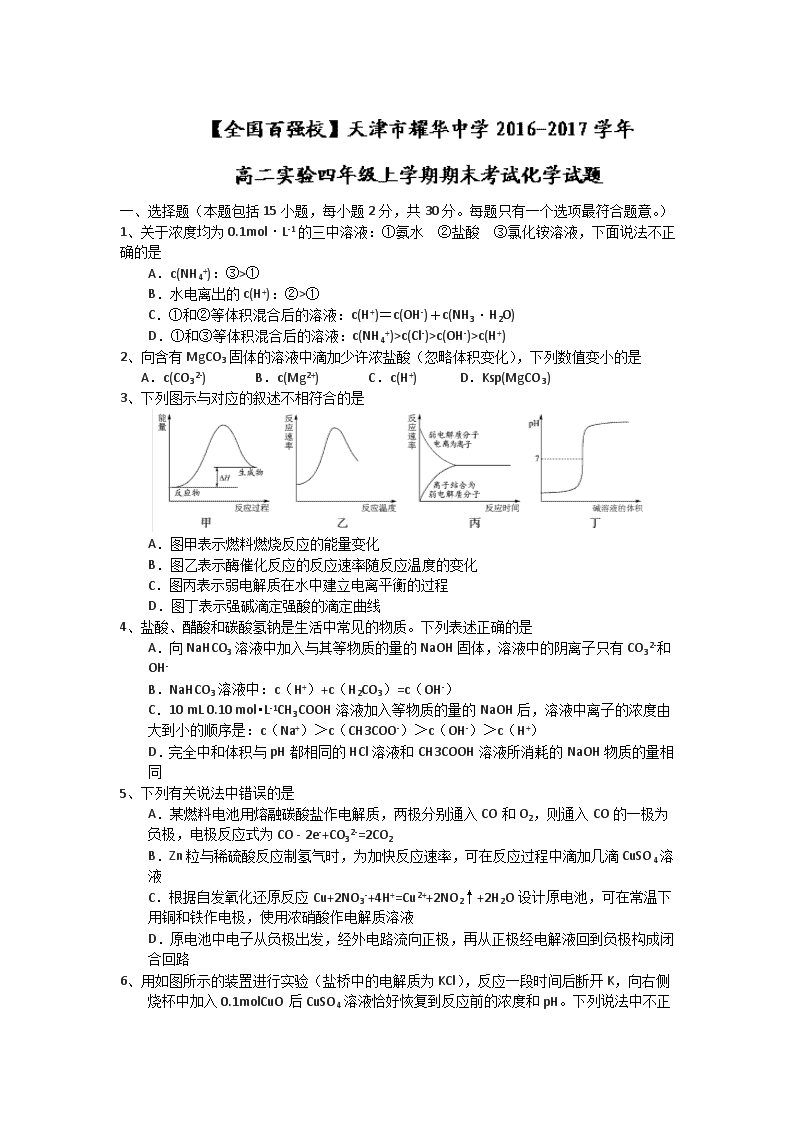
6、用如图所示的装置进行实验(盐桥中的电解质为KCl),反应一段时间后断开K,向右侧烧杯中加入0.1molCuO后CuSO4
溶液恰好恢复到反应前的浓度和pH。下列说法中不正确的是
A.锌棒为负极,其电极反应式为Zn-2e-=Zn2+
B.烧杯右侧碳棒为阴极,其电极表面有红色物质析出
C.盛H2SO4溶液的烧杯质量减少0.2g
D.导线中通过的电子的物质的量为0.2mol
7、25℃,下列各组离子在指定条件下,一定能大量共存的是
A.能使石蕊试液变红色的溶液中:K+、Na+、CO32-、NO3-
B.c(H+)=110-1mol·L-1的溶液中:Cu2+、Al3+、SO42-、NO3-
C.能使淀粉碘化钾试纸变蓝的溶液中:Na+、NH4+、S2-、Br-
D.水电离出的c(H+)=110-12mol·L-1的溶液中:Na+、Mg2+、Cl-、SO42-
8、下列说法正确的是
A.氢氧燃料电池工作时,H2在负极上失去电子
B.0.1mol/LNa2CO3溶液加热后,溶液的c(OH-)减小
C.常温常存下,22.4LCl2中含有的分子数为6.021023个
D.室温下,稀释0.1mol/LCH3COOH溶液,溶液的导电能力增强
9、下列有关电解质溶液的说法正确的是
A.向0.1 mol•L-1CH3COOH溶液中加入少量水,溶液中减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中增大
C.向盐酸中加入氨水至中性,溶液至>1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3固体,溶液中不变
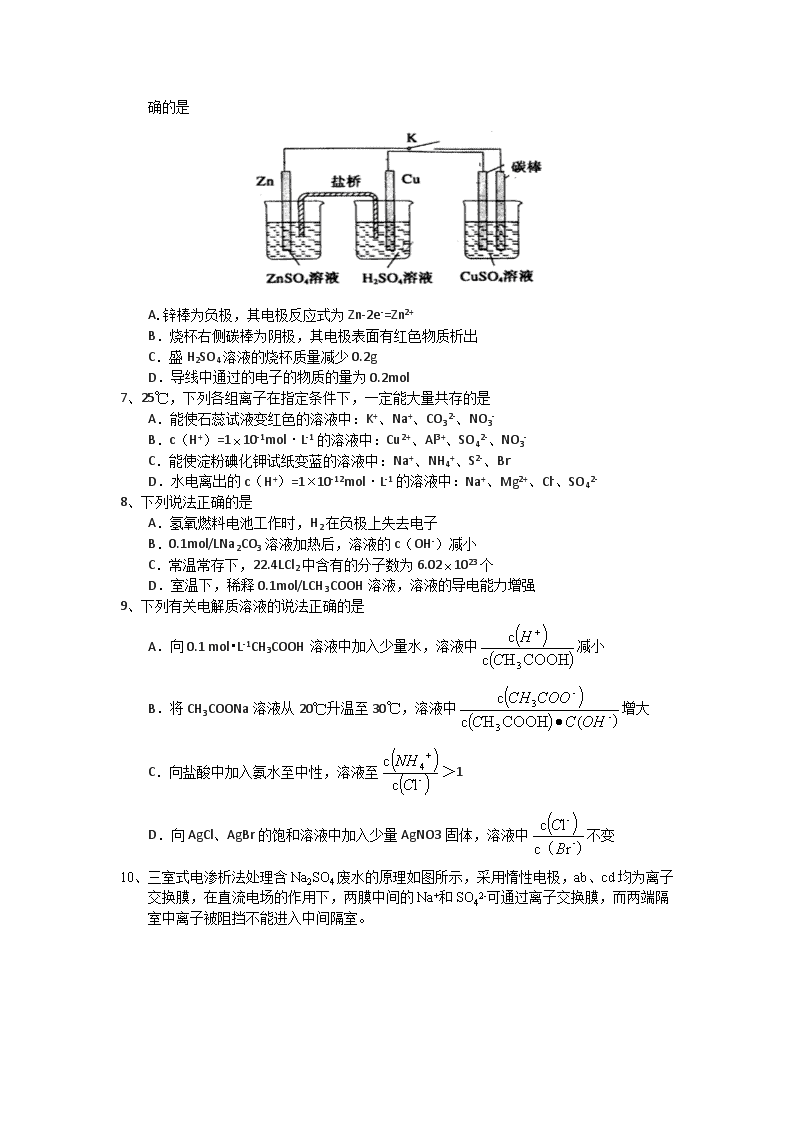
10、三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。
下列叙述正确的是
A.通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C.负极反应为2 H2O–4e–=O2+4H+,负极区溶液pH降低
D.当电路中通过1mol电子的电量时,会有0.5mol的O2生成
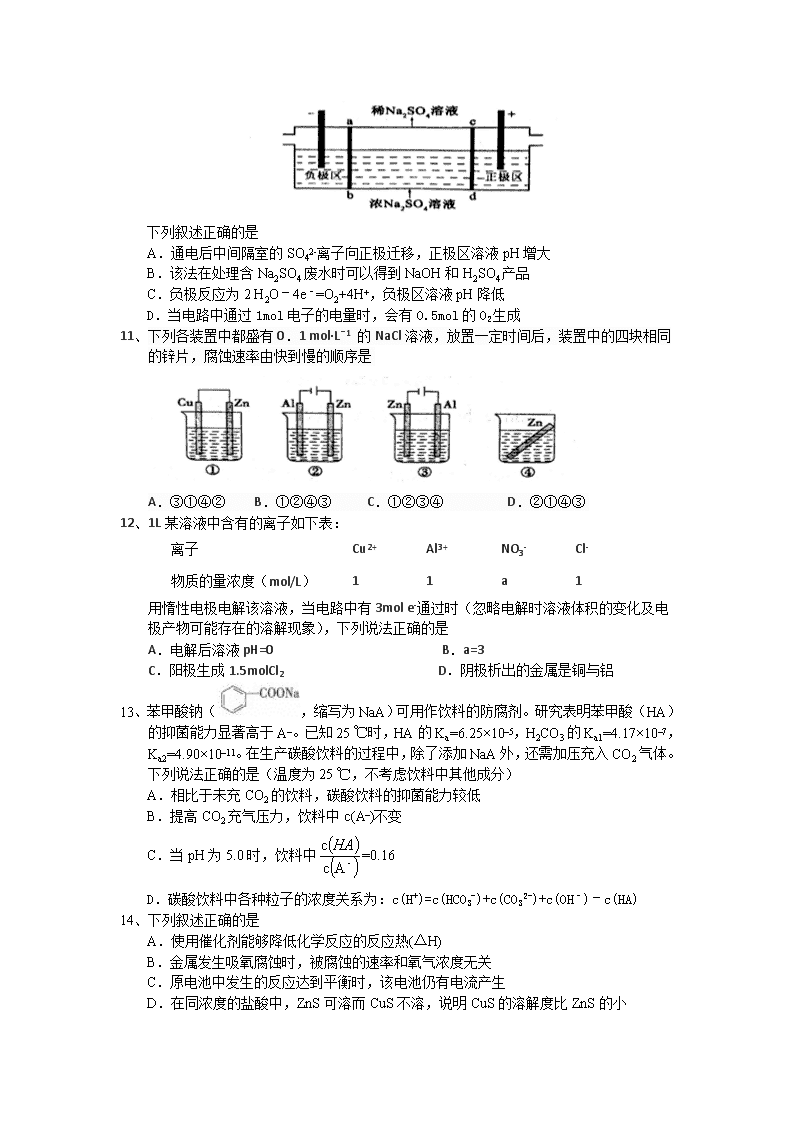
11、下列各装置中都盛有0.1 mol·Lˉ1 的NaCl溶液,放置一定时间后,装置中的四块相同的锌片,腐蚀速率由快到慢的顺序是
A.③①④② B.①②④③ C.①②③④ D.②①④③
12、1L某溶液中含有的离子如下表:
离子
Cu2+
Al3+
NO3-
Cl-
物质的量浓度(mol/L)
1
1
a
1
用惰性电极电解该溶液,当电路中有3mol e-通过时(忽略电解时溶液体积的变化及电极产物可能存在的溶解现象),下列说法正确的是
A.电解后溶液pH=0 B.a=3
C.阳极生成1.5molCl2 D.阴极析出的金属是铜与铝
13、苯甲酸钠(,缩写为NaA)可用作饮料的防腐剂。研究表明苯甲酸(HA)的抑菌能力显著高于A–。已知25 ℃时,HA的Ka=6.25×10–5,H2CO3的Ka1=4.17×10–7,Ka2=4.90×10–11。在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体。下列说法正确的是(温度为25 ℃,不考虑饮料中其他成分)
A.相比于未充CO2的饮料,碳酸饮料的抑菌能力较低
B.提高CO2充气压力,饮料中c(A–)不变
C.当pH为5.0时,饮料中=0.16
D.碳酸饮料中各种粒子的浓度关系为:c(H+)=c(HCO3-)+c(CO32-)+c(OH–)–c(HA)
14、下列叙述正确的是
A.使用催化剂能够降低化学反应的反应热(△H)
B.金属发生吸氧腐蚀时,被腐蚀的速率和氧气浓度无关
C.原电池中发生的反应达到平衡时,该电池仍有电流产生
D.在同浓度的盐酸中,ZnS可溶而CuS不溶,说明CuS的溶解度比ZnS的小
15、金属(M)–空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池放电的总反应方程式为:
4M+nO2+2nH2O=4M(OH) n。已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列说法不正确的是
A.采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B.比较Mg、Al、Zn三种金属–空气电池,Al–空气电池的理论比能量最高
C.M–空气电池放电过程的正极反应式:4Mn++nO2+2nH2O+4ne–=4M(OH)n
D.在Mg–空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
二、选择题(本题包括5小题,每小题3分,共15分。每题有1~2个选项符合题意。)
16、已知一种c(H+)=1.0x10-3 mol·L -1和一种c(OH-)=1.0x10-3 mol·L -1的碱溶液等体积混合后呈酸性,其原因可.
A.浓的强酸和稀的强碱溶液反应 B.浓的弱酸和稀的强碱溶液反应
C.等浓度的强酸和弱碱溶液反应 D.生成了一种强酸弱碱盐
17、 室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )
A.向0.10mol·L -1NH4HCO3中溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-)
B.向0.10 mol·L -1NaHSO3中溶液中通入NH3:c(Na+)>c(SO32-)>c(NH4+)
C.0.10 mol·L -1Na2SO3中溶液中通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+ c(H2SO3)]
D.0.10 mol·L -1CH3COONa中溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-)
18、按下图装置进行实验,若乙中横坐标x表示电路中通过电子的物质的量,纵坐标y表示反应物或生成物的物质的量,下列叙述不正确的是
A.E表示反应生成铜的物质的量
B.E表示反应消耗水的物质的量
C.F表示反应生成氧气的物质的量
D.F表示反应生成硫酸的物质的量
19、某电池以K2FeO4和Zn为电极材料,KOH溶液为电解溶质溶液。下列说法的是
A.Zn为电池的负极
B.正极反应式为2FeO42−+ 10H++6e−=Fe2O3+5H2O
C.该电池放电过程中电解质溶液浓度不变
D.电池工作时OH-向负极迁移
20、 H2C2O4为二元弱酸。20℃时,配制一组c(H2C2O4)+ c(HC2O4-)+ c(C2O42-)=0.100 mol·L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如右图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是
A.pH=2.5的溶液中:c(H2C2O4)+ c(C2O42-)> c(HC2O4-)
B.c(Na+)=0.100 mol·L-1的溶液中:c(H+)+c(H2C2O4)=c(OH-)+ c(C2O42-)
C.c(HC2O4-)= c(C2O42-)的溶液中:c(Na+)>0.100 mol·L-1+ c(HC2O4-)
D.pH=7的溶液中:c(Na+)>2c(C2O42-)
第II卷非选择题(55分)
三、简答题(本大题包括6小题,共55分)
21、(4分)下列叙述正确的是_________________(填序号)
A.常温下向滴有酚酞溶液的氨水加入NH4Cl至溶液恰好无色,则此时溶液的pH<7
B.电解冶炼镁、铝通常电解MgCl2和Al2O3,也可电解MgO和AlCl3。
C.无论在酸溶液中还是碱溶液中,由水电离出的c(H+)=c(OH-)
D.HA比H2B更难电离,则NaA比Na2B的水解能力更强
E.将AlCl3溶液和Na2SO3溶液分别蒸干并灼烧,得到Al2O3和Na2SO3
F.在NaHSO4溶液中,c(H+)=c(OH-)+c(SO42-)
G.同c(NH4+)的溶液:①NH4Al(SO4)2 ②NH4Cl ③NH3·H2O ④CH3COONH4溶液,物质的量浓度最大的是③
H.可将地下输油钢管与外加直流电源的负极相连以保护不受腐蚀
22、(9分)用相应的化学用语回答下列问题:
(1)Al3+与CO32-不共存的原因用离子方程式表示:__________________________________________。
(2)用TiCl4通过水解反应制备TiO2·xH2O的化学方程式:___________________________________。
(3)铅蓄电池的工作原理的化学方程式: ______________________________________________。
(4)Mg(OH)2溶于NH4Cl溶液,离子方程式为:_____________________________________________。
23、(10分)如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将直流电源接通后,向(乙)中滴入酚酞荣特,在F极附近呈红色。
(1)电源B极是_____极(填“正”或“负”)。
(2)(甲)、(乙)装置的C、D、E、F电极均有单质生成,其物质的量比为_____。
(3)写出烧杯乙中发生总反应的离子方程式__________________。
(4)欲用(丙)装置给铜镀银,G应该是_____(填电极材料),电镀液选______溶液。
(5)装置(丁)中X极附近红褐色变浅,说明氢氧化铁胶粒带______电荷(填“正”或“负”)。
(6)室温下,若从电解开始到时间为t时,若(甲)中某一电极郑重0.64g,(乙)溶液的体积为200ml,则(乙)溶液的pH为_______。
24、(14分)回答下列问题:
(1)NH4Cl溶液显酸性,试用离子方程式表示这一原理____________________________________。
(2)液氨的电离类似于水,试写出液氨的电离方程式_______________________________________。
(3)联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,请回答:
①联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为_____(已知:N2H4+H+N2H5+的K=8.7×107;Kw=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为______。
②肼-空气燃料电池是一种碱性燃料电池,生成无污染的物质。电解质溶液是20%~30%的KOH溶液。肼-空气燃料电池放电时:负极的电极反应式是_________________________。
(4)右图是一个电化学过程示意图。
①铂片上发生的电极反应是___________________
②若将上图中的铜电极换成石墨电极,则石墨电极产生的物质为:_______。
25、(10分)某烧碱样品含少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作:
A.在250 mL的容量瓶中定容配成250 mL烧碱溶液
B.用移液管移取25 mL烧碱溶液于锥形瓶中并滴几滴甲基橙指示剂
C.在天平上准确称取烧碱样品Wg,在烧杯中用蒸馏水溶解
D.将物质的量浓度为cmol·L-1的标准硫酸溶液装入酸式滴定管,调节液面,记下开始读点击查看大图数为V1
E.在锥形瓶下垫一张白纸,滴定至终点,记下读数V2
回答下列各问题:
(1)正确操作步骤的顺序是 ______→______ → ______→D→______(均用字母填写)。
(2)滴定管的读数应注意________________________________________。
(3)D步骤中液面应调节到_________________________,尖嘴部分应__________________。
(4)滴定终点时锥形瓶内溶液的pH约为____________,终点时颜色变化是___________。
(5)若酸式滴定管不用标准硫酸润洗,在其他操作均正确的前提下,会对测定结果________(指烧碱的纯度)有何影响?________(填“偏高”“偏低”或“不变”)。
(6)该烧碱样品纯度的计算式为_____________________________________。
26、(8分)重铬酸钾(K2Cr2O7)主要用于制革、印染、电镀等。其水溶液中存在平衡:Cr2O72-+H2O 2CrO42-+2H+
以铬酸钾(K2CrO4)为原料,用电化学法制备重铬酸钾的实验装置如图。
①不锈钢作________极,写出该电极的电极反应式________________________。
②分析阳极区能得到重铬酸钾溶液的原因________________________。
③当铬酸钾的转化率达到x时,阳极液中K与Cr的物质的量之比为________________。
一、选择题
1-5 BAACD 6-10 CBADB 11-15 DACDC
16.B 17.BD 18.D 19.AD 20.BD
21、(4分)C F G H
22、(9分)
(1)2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑ (2分)
(2)TiCl4+(x+2)H2O=TiO2·H2O↓+4HCl (2分)
(3)Pb(s)+PbO2(s)+2H2SO4(aq)2PbSO4(s)+2H2O(l) (3分)
(4)Mg(OH)2+2NH4+=Mg2++2NH3·H2O。(2分)
23、(10分)
(1)负(1分)
(2)1:2:2:2(2分)
(3)2Cl-+2H2O H2↑+Cl2↑+2OH-(2分)
(4)Ag(1分) ,AgNO3(1分)
(5)正(1分)
(6)13(2分)
24、(14分)
(1)H2O+NH4+NH3·H2O+H+(2分)
(2)NH3 NH4++NH2-(2分)
(3)①8.7×107(2分),N2H6(HSO4)2(2分)
②N2H4-4e-+4OH-=N2+4H2O(2分)
(4)①Cu2++2e=Cu(2分) ②O2和H2SO4(2分)
25、(10分)
(1)C A B E (1分)
(2)滴定管要直立,读书时不能俯视或仰视,视线应与凹液面最低点保持水平。(2分)
(3)零刻度或零稍下的某一刻度 (1分) 充满液体,无气泡(1分)
(4)4.4(1分) 由黄色变为橙色(1分)
(5)偏高(1分)
(6)(注意:V的单位为2ml)(2分)
26、(8分)
(1)阴(1分)2H2O+2e-=H2↑+2OH-(2分)
(2)阳极OH-放电,溶液H+浓度增大,使Cr2O72-+H2O2CrO42-+2H+
向生成方面移动,部分K+通过阳离子交换膜移动到阴极区,使阳极区主要成分是K2Cr2O7。(3分)
(3)2=x (2分)