- 250.00 KB
- 2021-04-12 发布
2017-2018学年河北省承德二中高二第二次月考化学试题
试题说明:1.本试卷满分100分,考试时间为100分钟;
2.请按要求把答案涂、写在答题纸规定的范围内;考试结束只收答题纸。
第Ⅰ卷(选择题,共48分)
一.选择题(本题包括30小题,每小题2分,共60分,每小题只有一个选项符合题意)
可能用到的相对原子质量:H--1 C-- 12 O—16 K--39 Na--23 Al—27 Mg--24
1.下列说法错误的是 ( )
A.需要加热才能发生的反应一定是吸热反应
B. 在热化学方程式中无论反应物还是生成物均必须标明聚集状态
C.焓变小于0而熵变大于0的反应肯定是自发的
D.轮船水线以下的船体上嵌入一定量的锌块可减缓海水对轮船的腐蚀
2.有如下三个热化学方程式: ( )
H2(g)+ O2(g)H2O(g) ΔH=a kJ·mol-1①
H2(g)+ O2(g)H2O(l) ΔH=b kJ·mol-1②
2H2O(l)2H2(g)+O2(g) ΔH=c kJ·mol-1③
下列关于它们的表述中正确的是( )
A.它们都是吸热反应 B.a、b、c均为负值
C.反应热关系a=b D.反应热的关系2b=-c
3.下列说法正确的是( )
A. 右图所示的是一个放热反应
B. 加入催化剂v(正)增大、v(逆)减小
C. 燃烧热是生成1molH2O放出的热量
D. 只有活化分子才可能发生有效碰撞
4.下列关于平衡常数K的说法中,正确的是( )
A.从平衡常数K的大小能推断一个反应进行的程度
B.改变反应物浓度或生成物浓度都会改变平衡常数K
C.平衡常数K与温度、反应浓度、压强有关
D.在任何条件下,化学平衡常数是一个恒定值
5.在一定温度下的定容密闭容器中,当下列条件不再改变时,表明反应:( )
A(s)+2B(g) C(g)+D(g)已达到平衡状态的现象是
A.混合气体的压强 B.混合气体的密度
C.气体的总物质的量 D.单位时间内生成n mol C的同时消耗2n molB
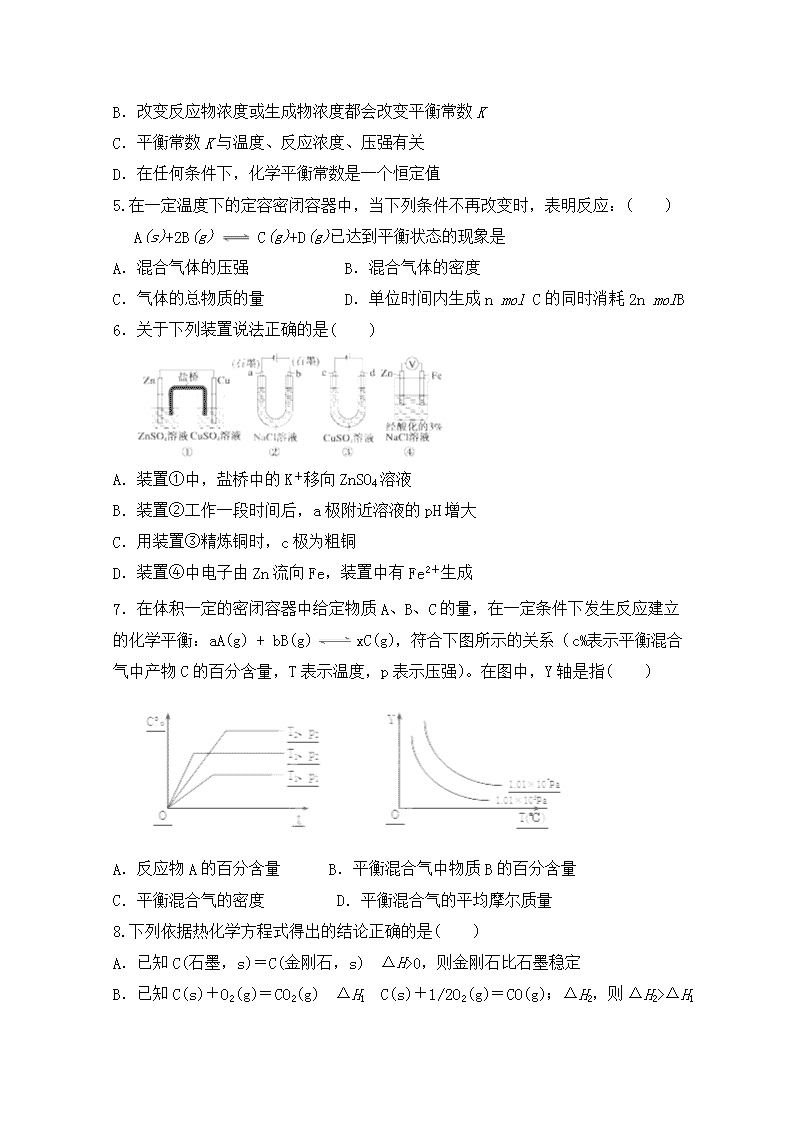
6.关于下列装置说法正确的是( )
A.装置①中,盐桥中的K+移向ZnSO4溶液
B.装置②工作一段时间后,a极附近溶液的pH增大
C.用装置③精炼铜时,c极为粗铜
D.装置④中电子由Zn流向Fe,装置中有Fe2+生成
7.在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g) + bB(g)xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指( )
A.反应物A的百分含量 B.平衡混合气中物质B的百分含量
C.平衡混合气的密度 D.平衡混合气的平均摩尔质量
8.下列依据热化学方程式得出的结论正确的是( )
A.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
B.已知C(s)+O2(g)=CO2(g) ΔH1 C(s)+1/2O2(g)=CO(g);ΔH2,则ΔH2>ΔH1
C.已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol,则氢气的燃烧热为
241.8 kJ/mol
D.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ/mol,则含20 g NaOH的稀溶液与稀盐酸完全中和,中和热为28.65 kJ/mol
9.在密闭容器中发生反应:aX(g)+bY(g)cZ(g)+dW(g)反应达到平衡后,保持温度不变,将气体压缩到原来的1/2体积,当再次达到平衡时,W的浓度为原平衡的1.8倍。下列叙述中不正确的是( )
A.平衡向逆反应方向移动 B.a + b > c + d
C.Z的体积分数减小 D.X的转化率减小
10.X、Y、Z三种气体,取X和Y按2∶1的物质的量之比混合,放入固定体积的密闭容器中发生如下反应:X + 2Y 2Z,达到平衡后,X的转化率不可能为( )
A.10% B.15% C.20% D.25%
11.在1100℃,一定容积的密闭容器中发生反应:FeO(s)+CO(g)Fe(s)+CO2(g) D△H=a kJ/mol(a >0),该温度下K=0.263,下列有关该反应的说法正确的是( )
A. 若生成1 mol Fe,则吸收的热量小于a kJ
B. 若升高温度,正反应速率加快,逆反应速率减慢,则化学平衡正向移动
C. 若容器内压强不随时间变化,则可以判断该反应已达到化学平衡状态
D. 达到化学平衡状态时,若c(CO)=0.100 mol/L,则c(CO2)=0.0263 mol/L
12.对于反应A(g)+3B(g) 2C(g),下列各数据表示不同条件下的反应速率,
其中反应进行得最快的是( )
A.v(A)=0.2 mol·(L·s)-1 B.v(B)=0.2 mol·(L·s)-1
C.v(B)=0.3 mol·(L·s)-1 D.v(C)=0.2 mol·(L·s)-1
13.25℃、101kPa下,反应2N2O5(g)=4NO2(g)+O2(g) △H=+56.7kJ/mol能自发进行的原因是( )
A.是吸热反应 B.是放热反应
C.是熵减小的反应 D.熵增效应大于能量效应
14.用惰性电极电解下列足量溶液,一段时间后,再加入一定质量的另一物质(括号内),溶液能与原来溶液完全一样的是( )
A.NaCl [盐酸溶液] B.NaOH [NaOH] C.AgNO3 [Ag2O] D.CuSO4 [Cu(OH)2]
15.用铂电极电解100mL HNO3 与 AgNO3 的混合液,通电一段时间后,两极均收集到
2.24 L气体(标准状况),则原混合液中Ag+的物质的量浓度为( )
A.1mol·L-1 B. 2 mol·L-1 C.2.5 mol·L-1 D.3 mol·L-1
16.一定条件下,在容积为10L的密闭容器中,将l mol X和1 mol Y进行如下反应:
2X(g)+Y(g) Z(g),经60 s达到平衡生成0.3 mol的Z,下列说法正确的是()
A.60 s内X的平均反应速率为0.001 mol·L-1·s-1
B.将容器的容积变为20 L,Z的新平衡浓度将等于原平衡浓度的1/2
C.若温度和体积不变,往容器内增加1 mol X,X的转化率将增大
D.若升高温度,X的体积分数增大,则正反应的△H>0
17.铅蓄电池的总反应为:PbO2(s)+Pb(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(l)
关于铅蓄电池的说法正确的是( )
A.在放电时,正极发生的反应是Pb(s)+SO(aq) -2e-=PbSO4(s)
B.在放电时,该电池的负极材料是铅板
C.在充电时,电池中硫酸的浓度不断变小
D.在充电时,阳极发生的反应是PbSO4(s)+2e-=Pb(s)+SO(aq)
18.下列叙述正确的是( )
A.N2+3H2 2NH3 △H<0 ,升高温度,逆反应速率加快,正反应速率减慢
B.在稀溶液中,H+(aq)+OH-(aq)==H2O(l);kJ·mol-1,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量为57.3 kJ
C.由C(石墨)=== C(金刚石);kJ·mol-1可知,金刚石比石墨稳定
D.纯锌与稀硫酸反应时,加入少量CuSO4溶液,可使反应速率加快
19. Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如下,电解总反应为2Cu+H2O==Cu2O+H2↑。下列说法正确的是( )
A.石墨电极上产生氢气
B.铜电极发生还原反应
C.铜电极接直流电源的负极
D.当有0.1 mol电子转移时,有0.1 mol Cu2O生成
20.下列叙述正确的是( )
A. 在原电池的负极和电解池的阴极上都是发生失电子的氧化反应
B. 用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2
C. 用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 mol NaOH
D. 镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
21.实验室用4molSO2与2molO2进行下列反应:
2SO2(g)+O2(g) 2SO3(g);△H=-196.64kJ/mol,当放出314.624kJ热量时,SO2的转化率为( )
A.40% B.50% C.80% D.90%
22.有一化学平衡:mA(g)+nB(g) pC(g)+qD(g)
如图表示的是A的转化率与压强、温度T的关系。分析图中曲线可以得出的结论是( )
A.正反应吸热,m+n >p+q
B.正反应吸热,m+n p+q
D.正反应放热,m+n 4Q3 B.2Q1 + Q2 < 4Q3
C.Q1 + Q2 < Q3 D.Q1 + Q2 = Q3
24.某温度下,在一个2L的密闭容器中,加人4molA和2molB进行如下反应:
3A(g)+2B(g)4C(?)+2D(?),反应一段时间后达到平衡,测得生成1.6molC,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是( )
A.该反应的化学平衡常数表达式是K=
B.此时,B的平衡转化率是35%
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.增加C,B的平衡转化率不变
25.下列措施能提高合成氨[N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ/mol]厂的生产效率和经济效益的是( )
①采用20 MPa~50 MPa的压强;②使用催化剂;③在合适的温度下进行反应;④从平衡混合气体中液化分离出NH3,并将N2、H2循环使用
A.①③④ B.③④ C.①②③ D.全部
26.现有两份大理石样品,一份是块状,一份是粉末状,在相同温度下,分别与100 mL、1 mol·L-1 的盐酸完全反应,实验测得生成CO2的体积与反应时间的关系如图所示。有关说法正确的是( )
A.两份大理石样品的质量一定相等
B.两份盐酸一定反应完全
C.曲线a表示的是块状大理石样品与盐酸反应
D.曲线b表示的是块状大理石样品与盐酸反应
27.一定条件下,反应2NO2(g)N2O4(g) ΔH<0在密闭容器中达到平衡。在测定NO2的相对分子质量时,下列条件中,测定结果误差最小的是( )
A.温度130℃、压强3.03×105Pa B.温度25℃、压强1.01×105Pa
C.温度130℃、压强5.05×104Pa D.温度0℃、压强5.05×104Pa
28.某密闭容器中进行如下反应:2SO2(g)+O2(g)2SO3(g),若要使平衡时反应物总物质的量与生成物总物质的量相等,且用SO2、O2作反应物,则SO2、O2的初始物质的量之比的范围应满足( )
A.1<<3 B.<<
C.<<4 D.<<
29.
在一定温度条件下,甲、乙两个容积相等的恒容密闭容器中均发生如下反应:3A(g)+B(g) x C(g)+D(s)。向甲中通入6 mol A和2 mol B,向乙中通入1.5 mol A、0.5 mol B、3 mol C和2 mol D,反应一段时间后都达到平衡,此时测得甲、乙两容器中C的体积分数都为20%。下列叙述中不正确的是( )
A.若平衡时,甲、乙两容器中A的物质的量不相等,则x=4
B.平衡时,甲、乙两容器中A、B的物质的量之比相等
C.平衡时,甲中A的体积分数为40%
D.若平衡时两容器中的压强不相等,则两容器中压强之比为8∶5
30.一定温度下有可逆反应:A(g)+2B(g)2C(g)+D(g)。现将4 mol A和8 mol B加入体积为2 L的某密闭容器中,反应至4 min时,改变某一条件,测得C的物质的量浓度随时间变化的曲线如图所示。下列有关说法中正确的是( )
A.0~2 min内,正反应速率逐渐增大
B.4 min时,A的转化率为50%
C.6 min时,B的体积分数为25%
D.4 min时,改变条件后,平衡向逆反应方向移动
第Ⅱ卷(非选择题,共40分)
31.(10分)如图所示,溶液体积均为200 mL,若电解5 min
容器编号
起始时各物质物质的量/mol
达到平衡的时间/min
达平衡时体系能量的变化/kJ
CO
H2O
CO2
H2
①
1
4
0
0
t1
放出热量:32.8 kJ
②
2
8
0
0
t2
放出热量:Q
时铜电极质量增加2.16 g,试回答:
⑴ 电源电极X名称为____________。
⑵ pH变化: B池_______,C池________。
(填增大、减小或不变)
⑶ 通电5 min时,B中共收集224 mL气体(标
况),则通电前硫酸铜溶液的物质的量浓度为______________。
(4)写出A池中发生反应的化学方程式_____________________________________。
32. (12分)Ⅰ、在一定温度下,氧化铁可以与一氧化碳发生反应:
Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g)。已知该反应在不同温度下的平衡常数如下表:
温度/℃
1 000
1 150
1 300
平衡常数
64.0
50.7
42.9
请回答下列问题:
该反应的平衡常数表达式K=________,ΔH________0(填“>”、“<”或“=”)。
Ⅱ、工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g) CO2(g)+H2(g) △H=-41 kJ/mol
某小组研究在相同温度下该反应过程中的能量变化。他们分别在体积均为V L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
Ⅱ、工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g) CO2(g)+H2(g) △H=-41 kJ/mol
某小组研究在相同温度下该反应过程中的能量变化。他们分别在体积均为V L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
(1)容器①中反应达平衡时,CO的转化率为 。
(2)计算容器②中反应的平衡常数K= 。
33.(18分)(1)①氢氧燃料电池是将H2通入负极,O2通入正极而发生电池反应的。若电解质溶液为H2SO4,其正极电极反应式:
__________________ ____,
②化学反应可为人类提供能量,家用液化气的主要成分之一是丁烷(C4H10),常温常压下,当5.8 kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为2.9×105kJ,试写出丁烷燃烧的热化学方程式:____________________________________________,已知1mol液态水气化时需要吸收44 kJ的热量,则反应:
的ΔH=____________。
③由甲烷、氧气和KOH溶液组成的新型燃料电池中,负极上发生反应的电极反应为__________________________________________.
(2) 36g碳不完全燃烧所得气体中,CO占三分之一体积,CO2占三分之二体积。已知:2C(S)+O2(g)=2CO(g) △H=-110.5kJ/mol,
2CO(g)+O2(g)=2CO2(g) △H=-576kJ/mol,与这些碳完全燃烧相比,损失的热量是_________KJ
(3)氨是重要的化工产品之一,研究合成氨反应具有重要意义。
已知断裂下列化学键需要吸收的能量分别为:
,写出以N2和H2为原料合成NH3的热化学方程式________________________。
34.相同温度下,A、B、C三个密闭容器,A、B恒容,C带有可自由移动的活塞K,各向其中充人如图所示反应物,初始时控制活塞K,使三者体积相等,一段时间后均达到平衡。
①达到平衡时,A、C两个容器中NH3的浓度分别为cl、c2,则c1______c2(填“>”、“<”或“=”)。
②达到平衡时,若A、B两容器中反应物的转化率分别为,则 ______1(填“ >”、“<”或“=”)。
③达到平衡时,若容器C的体积是起始时的,则平衡时容器C中H2的体积分数为_______。
高二月考考试化学参考答案
一、选择题(共54分,1-18题每个2分,19-24每个3分)
1
2
3
4
5
6
7
8
9
10
11
12
A
D
D
A
B
B
D
B
B
D
D
A
13
14
15
16
17
18
19
20
21
22
23
24
D
C
B
A
B
D
A
C
C
A
B
D
25
26
27
28
29
30
D
D
C
C
C
C
二
31.(1)负极 (2分)⑵减小(2分),不变(2分)。
⑶0.025mol/L(2分)(4) (2分)
32. 每空3分 I K=c3(CO2)/c3(CO) < II (1)80% (2)K=1
33.每空3分(1)①正极O2+4H++4e-=2H2O___
②C4H10(g)+ 13/2O2(g)=4CO2(g)+5H2O(l) △H=-2900kJ·mol-1
-2680kJ·mol-1
③CH4+10OH-+8e-===CO32-+7H2O
(2)288
(3)N2(g)+3H2(g)2NH3(g) △H= -90.8 kJ·mol-1
34. ①< < 50% 每空2分