- 110.00 KB
- 2021-04-12 发布
专题三第二单元铁、铜的获取及应用
教学目的 1、掌握铁和铜及其化合物的性质。2、掌握Fe2+与Fe3+的检验。
3、掌握金属冶炼及规律。4、掌握钢铁的腐蚀。
教学过程
【例1】A、B、C、D、E分别是Cu、Ag、Fe、Al、Mg五种金属中的一种,已知:①A、C均能与稀H2SO4反应放出气体;②B与D的硝酸盐反应,置换出单质D;③C与强碱反应放出气体;④C、E在冷浓硝酸中发生钝化.由此可判断A、B、C、D、E依次为 ( )
A、Fe、Cu、Al、Ag、Mg B、Al、Cu、Mg、Ag、Fe
C、Mg、Cu、Al、Ag、Fe D、Mg、Ag、Al、Cu、Fe
【例2】下列各组物质充分反应后的产物中,滴入KSCN溶液显红色的是
A、FeO和稀盐酸 B、过量铁粉跟稀硫酸 C、氯水跟FeCl2溶液 D、过量铁粉跟硫酸铁溶液
【例3】把表面有氧化物的相同大小的铜片和铁片一起放入盐酸中充分反应,所得溶液中的金属离子( )
A、是Fe3+和Cu2+ B、是Fe2+和Cu2+ C、是Fe2+和Fe3+ D、只有Fe2+
【小结1】一、铁和铜的性质比较:
Fe
Cu
物理性质
化
学
性
质
与O2反应
空气中
燃烧
------------
其它非金属
S
Cl2
与水反应
------------
与酸反应
盐酸
------------
浓硝酸
与盐溶液反应
用途
冶炼
三、Fe2+与Fe3+的检验:
物质
Fe2+
Fe3+
溶液颜色
化学性质
检
验
观察法
碱法
SCN-法
氧化还原法
第4页 共4页
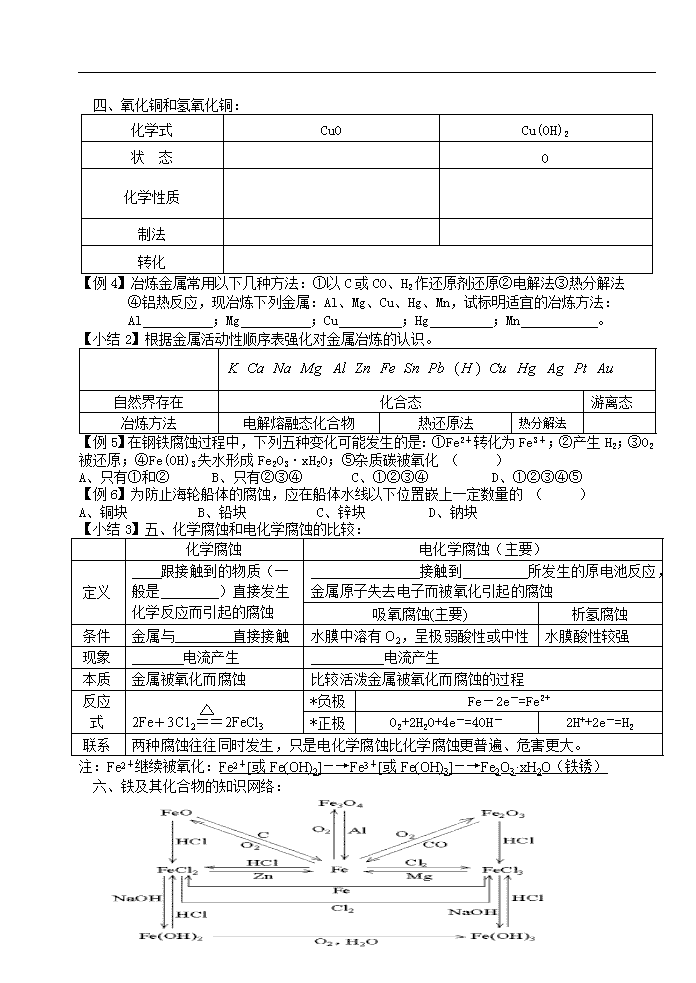
四、氧化铜和氢氧化铜:
化学式
CuO
Cu(OH)2
状 态
O
化学性质
制法
转化
【例4】冶炼金属常用以下几种方法:①以C或CO、H2作还原剂还原②电解法③热分解法
④铝热反应,现冶炼下列金属:Al、Mg、Cu、Hg、Mn,试标明适宜的冶炼方法:
Al ;Mg ;Cu ;Hg ;Mn 。
【小结2】根据金属活动性顺序表强化对金属冶炼的认识。
自然界存在
化合态
游离态
冶炼方法
电解熔融态化合物
热还原法
热分解法
【例5】在钢铁腐蚀过程中,下列五种变化可能发生的是:①Fe2+转化为Fe3+;②产生H2;③O2
被还原;④Fe(OH)3失水形成Fe2O3·xH2O;⑤杂质碳被氧化 ( )
A、只有①和② B、只有②③④ C、①②③④ D、①②③④⑤
【例6】为防止海轮船体的腐蚀,应在船体水线以下位置嵌上一定数量的 ( )
A、铜块 B、铅块 C、锌块 D、钠块
【小结3】五、化学腐蚀和电化学腐蚀的比较:
化学腐蚀
电化学腐蚀(主要)
定义
跟接触到的物质(一般是 )直接发生化学反应而引起的腐蚀
接触到 所发生的原电池反应, 金属原子失去电子而被氧化引起的腐蚀
吸氧腐蚀(主要)
析氢腐蚀
条件
金属与 直接接触
水膜中溶有O2,呈极弱酸性或中性
水膜酸性较强
现象
电流产生
电流产生
本质
金属被氧化而腐蚀
比较活泼金属被氧化而腐蚀的过程
反应式
2Fe+3C12==2FeCl3
*负极
Fe-2e-=Fe2+
*正极
O2+2H2O+4e-=4OH-
2H++2e-=H2
联系
两种腐蚀往往同时发生,只是电化学腐蚀比化学腐蚀更普遍、危害更大。
注:Fe2+继续被氧化:Fe2+[或Fe(OH)2]-→Fe3+[或Fe(OH)3]-→Fe2O3·xH2O(铁锈)
六、铁及其化合物的知识网络:
第4页 共4页
【课外练习】
1、根据Fe+CuCl2=FeCl2+Cu;2FeCl3+Cu=2FeCl2+CuCl2两个反应,判断Fe3+、Fe2+、Cu2+的氧化性强弱顺序为 ( )
A、Cu2+>Fe2+>Fe3+ B、Fe3+>Fe2+>Cu2+ C、Fe3+>Cu2+>Fe2+ D、Fe2+>Fe3+>Cu2+
2、为除去FeSO4溶液中的Fe2(SO4)3和CuSO4,最好选用 ( )
A.烧碱溶液 B.浓氨水 C.镁粉 D.铁粉
3、电子工业中常用FeCl3溶液腐蚀印刷电路板,欲从腐蚀后的废液中回收Cu及制取纯净的FeCl3溶液,需要下列试剂:①蒸馏水②铁粉③浓H2SO4④浓盐酸⑤烧碱⑥浓氨水⑦Cl2中的 ( )
A、①②④⑦ B、①③④⑥ C、②④⑥⑦ D、①④⑥⑦
4、将下列四种铁的化合物溶于稀盐酸,滴加KSCN溶液没有颜色变化,再加入氯水即呈红色的是 ( )
A.FeS B.Fe2O3 C.FeCl3 D.Fe2(SO4)3
5、下列金属冶炼的反应原理,错误的是( )
A、2NaCl(熔融) 2Na + Cl2↑ B、MgO + H2 Mg + H2O
C、Fe3O4 + 4CO 3Fe + 4CO2 D、2HgO 2Hg + O2↑
6、下列说法正确的是( )
A.使元素的化合态转化成游离态的过程就是还原的过程
B.高炉炼铁的原料有铁矿石、焦炭和空气。工业上就是用焦炭还原铁矿石,以制得生铁
C.电解熔融氧化铝时,每还原出铝,必有电子转移
D.工业上常用电解水溶液的方法制取金属钠
7、如图,各容器中盛有海水,铁在其中被腐蚀由快到慢的顺序为 ( )
A、④>②>①>③ B、②>①>③>④ C、④>②>③>① D、③>②>④>①
8、下列各组离子在水溶液中能大量共存的是 ( )
A、Fe3+、Fe2+、Cl-、OH- B、Fe2+、H+、Na+、NO3-
C、H+、Fe2+、SO42-、Cl- D、Fe3+、NO3-、K+、CSN-
9、某500mL溶液中含0.1 mol Fe2+、0.2 mol Fe3+,加入0.2 mol 铁粉,待Fe3+完全还原后,溶液中Fe2+的物质的量浓度为(假设反应前后体积不变) ( )
A.0.4 mol·L-1 B.0.6 mol·L-1 C.0.8 mol·L-1 D.1.0 mol·L-11、
10、某磁铁矿石200 t,经分析其中含有铁元素86.9 t (杂质中不含铁元素),则磁铁矿中Fe3O4的质量分数为 ( )
第4页 共4页
A. 50% B. 60% C. 65% D. 70%
*11、向FeCl3溶液中加入a g铜粉,搅拌全部溶解,然后再向其中加入b g铁粉,经充分反应
后得滤渣c g ,若已知a>b>c,则推断c g滤渣是________,滤液中存在的阳离子是_________.
12、用CO还原赤铁矿可得到一种具有银白色金属光泽的单质A,A在纯氧中燃烧可得到一种黑
色固体B,将A投入到稀盐酸溶液中,可产生一种可燃性气体C,将A投入硫酸铜溶液中,生成
一种红色固体。
(1) 写出A、B、C、D的名称:A ,B ,C ,D ;
(2) 写出各步反应的化学方程式:
① ,② ,
③ ,④ 。
*13.粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:①取适量A
进行铝热反应,产物中有单质B生成;②另取20 g A全部溶于0.15 L 6.0 mol·盐酸中,
得溶液C;③将①中得到的单质B和溶液C反应,放出 l.12 L(标况)气体,同时生成溶液D,
还残留有固体物质B;④用KSCN溶液检验时,溶液D不变色。请填空:
(1)①中引发铝热反应的实验操作________________________,产物中的单质B是________。
(2)②中所发生的各反应的化学方程式是___________________________。
(3)③中所发生的各反应的离子方程式是__________________________________。
(4)若溶液D的体积仍视为0.15 L,则该溶液中c(Mg2+)为____________, c(Fe2+)为_____________。
14.(14分)实验室可用氯气与金属铁反应制备无水三氯化铁,该化合物是棕红色、易潮解,100℃左右时升华。下图是两个学生设计的实验装置、左边的反应装置相同,而右边的产品收集装置则不同,分别如(Ⅰ)和(Ⅱ)所示。试回答:
(1)B中反应的化学方程式为:__________________________________________;
(2)D中的反应开始前,需排除装置中的空气,应采取的方法是:__________ _。
(3)D中反应化学方程式为:________________________ ___________________。
(4)装置(Ⅰ)的主要缺点是:___________________________________ ____ _______。
(5)装置(Ⅱ)的主要缺点是:______________________________________ _ _______。
如果选用此装置来完成实验,则必须采取的改进措施是:____________ _________。
15.将55 g铁片放入硫酸铜溶液片刻,取出洗涤干燥后称重,质量为56.6 g,求参加反应的铁和生成的铜的质量。
第4页 共4页
相关文档
- 2020版高中化学 第3章 自然界中的2021-04-12 10:27:304页
- 2020高中化学 专题 氨和铵盐限时练2021-04-12 10:22:564页
- 2020_2021学年高中化学专题十五乙2021-04-12 10:08:555页
- 高中化学第四章生命中的基础有机化2021-04-12 09:57:435页
- 高中化学选修5人教版同步练习及测2021-04-12 09:44:135页
- 高中化学《有机化学基础》4_2糖类2021-04-12 09:41:348页
- 高中化学第3章晶体结构与性质第2节2021-04-12 09:30:047页
- 人教版高中化学选修三 3_3 金属晶2021-04-12 09:28:2515页
- 化学(心得)之反思在高中化学教学中的2021-02-27 09:08:5715页
- 九年级下册化学教案 课题2 化学肥2021-02-27 09:08:256页