- 295.00 KB
- 2021-02-27 发布
小专题突破11 有机实验归纳
[专题精讲]
一、有机物的制备实验
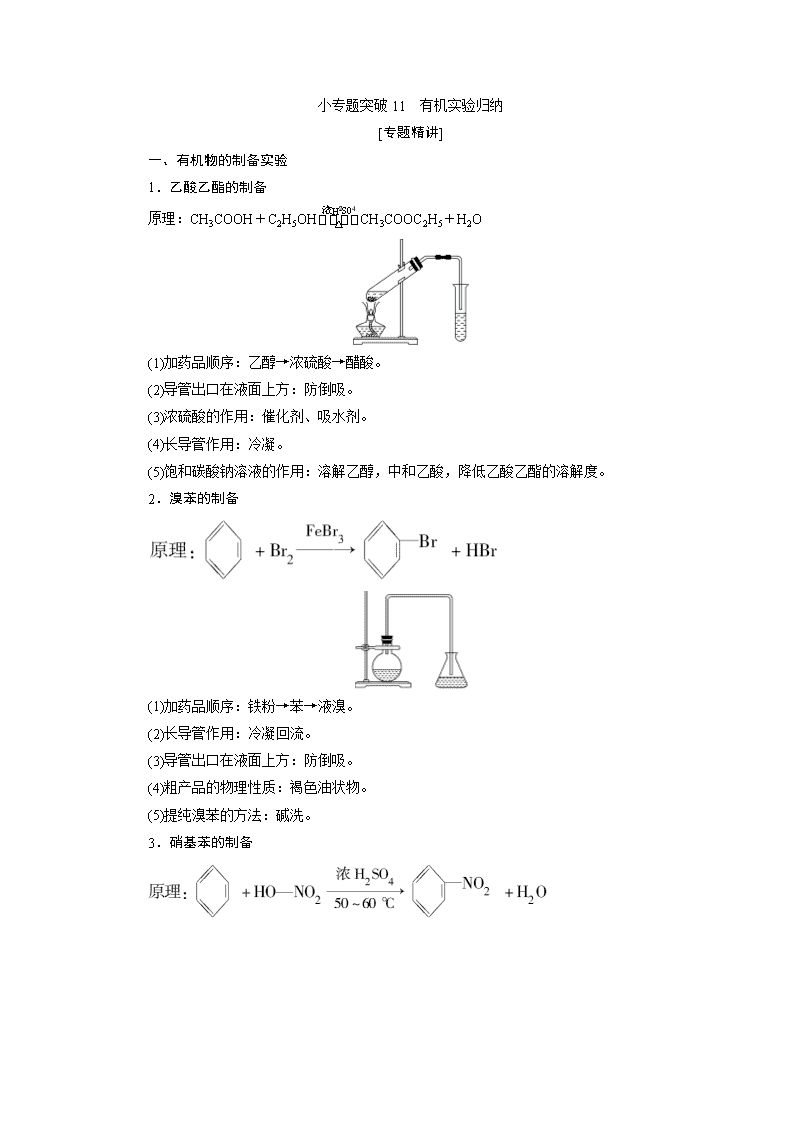
1.乙酸乙酯的制备
原理:CH3COOH+C2H5OHCH3COOC2H5+H2O
(1)加药品顺序:乙醇→浓硫酸→醋酸。
(2)导管出口在液面上方:防倒吸。
(3)浓硫酸的作用:催化剂、吸水剂。
(4)长导管作用:冷凝。
(5)饱和碳酸钠溶液的作用:溶解乙醇,中和乙酸,降低乙酸乙酯的溶解度。
2.溴苯的制备
(1)加药品顺序:铁粉→苯→液溴。
(2)长导管作用:冷凝回流。
(3)导管出口在液面上方:防倒吸。
(4)粗产品的物理性质:褐色油状物。
(5)提纯溴苯的方法:碱洗。
3.硝基苯的制备
(1)加药品顺序:浓硝酸→浓硫酸(冷却)→苯。
(2)长导管的作用:冷凝回流。
(3)温度计水银球位置:水浴中。
(4)水浴温度:50~60 ℃。
(5)粗产品的物理性质:淡黄色油状物,密度比水大,比混合酸小。
(6)提纯硝基苯的方法:碱洗。
二、有机物的性质实验
1.银镜反应
(1)银氨溶液的制备:稀AgNO3溶液中滴加稀氨水至沉淀恰好消失。
Ag++NH3·H2O===AgOH↓+NH
AgOH+2NH3·H2O===[Ag(NH3)2]++OH-+2H2O
(2)原理:RCHO+2Ag(NH3)2OHRCOONH4+2Ag↓+3NH3+H2O。
(3)反应条件:水浴加热。
(4)反应现象:产生光亮的银镜。
(5)注意事项:①试管内壁洁净;②碱性环境;③银氨溶液必须现用现配。
2.醛和新制氢氧化铜反应
(1)Cu(OH)2悬浊液的制备:过量的NaOH溶液中滴加几滴CuSO4溶液。
Cu2++2OH-===Cu(OH)2↓
(2)原理:RCHO+2Cu(OH)2+NaOHRCOONa+Cu2O↓+3H2O。
(3)反应条件:加热。
(4)反应现象:产生红色沉淀。
(5)注意事项:①Cu(OH)2悬浊液须新制;②碱性环境。
3.糖类的水解
蔗糖
淀粉
纤维素
催化剂
H2SO4(1∶5)
H2SO4(20%)
浓硫酸(90%)
加热
水浴加热
直接加热
小火微热
检验水
解完全
-
加碘水
-
检验水
解产物
先加NaOH再加检验试剂
[专题精练]
1.实验是化学研究的基础,关于下列各实验的叙述中,正确的是( )
A.实验室制取硝基苯 B.用酒精萃取碘水中的碘
C.实验室制取乙酸乙酯 D.分离苯和硝基苯的混合物
解析:选A。实验室制取硝基苯需要水浴加热,控制温度为60 ℃左右,故A项正确;酒精与水互溶,无法用酒精萃取碘水中的碘,故B项错误;实验室制取乙酸乙酯时,为防止倒吸,装置中右侧导管不能插入饱和Na2CO3溶液中,故C项错误;用蒸馏法分离苯和硝基苯的混合物,温度计的水银球应置于蒸馏烧瓶的支管口处,测量蒸气的温度,故D项错误。
2.下列实验能获得成功的是( )
A.将乙醛滴入银氨溶液中,加热煮沸制银镜
B.苯与浓溴水反应制取溴苯
C.向浓溴水中加几滴苯酚观察沉淀
D.1 mol·L-1CuSO4溶液2 mL和0.2 mol·L-1NaOH溶液4 mL混合后加入40%的乙醛溶液0.5 mL,加热煮沸观察沉淀的颜色
解析:选C。银镜反应要在水浴加热的条件下进行,将乙醛滴入银氨溶液中,加热煮沸得到黑色沉淀,不能制得银镜,故A项错误;苯和液溴在溴化铁做催化剂的条件下反应制备溴苯,不能用溴水,故B项错误;苯酚和浓溴水发生取代反应生成三溴苯酚白色沉淀,故C项正确;1 mol·L-1CuSO4溶液2 mL和0.2 mol·L-1NaOH溶液4 mL混合后反应生成氢氧化铜,但NaOH少量,新制氢氧化铜与乙醛的反应需在碱性条件下进行,故D项错误。
3.实验室采用如图所示装置研究苯与液溴的反应类型并制取少量溴苯。试回答下列问题:
(1)仪器A的名称是________;仪器B除导气外的作用是__________________________。
(2)写出制取溴苯的化学方程式:___________________________。
(3)反应完毕后,向锥形瓶D中滴加AgNO3溶液,有____________________(填现象)生成,此现象说明这种获得溴苯的反应属于________(填有机反应类型)。
解析:(3)锥形瓶D中吸收的是溴化氢气体,A中生成的溴化氢进入D中,溶于水电离出Br-,滴加AgNO3溶液,Br-和Ag+反应生成淡黄色溴化银沉淀,该现象说明液溴和苯发生了取代反应。
答案:(1)三颈烧瓶 冷凝回流反应物
(3)淡黄色沉淀 取代反应
4.实验室制备硝基苯的实验装置如右图所示,主要步骤如下:
①配制一定比例的浓H2SO4和浓HNO3混合酸,加入反应器中。
②向室温下的混合酸中逐滴加入一定质量的苯,充分振荡,混合均匀。
③在50~60 ℃下发生反应,直至反应结束。
④除去混合酸后,粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤。
⑤将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯硝基苯。
填写下列空白:
(1)配制一定比例的浓H2SO4和浓HNO3混合酸时,操作注意事项是________________________________________________________________________。
(2)步骤③中,为了使反应在50~60 ℃下进行,常用的方法是_____________________。
(3)步骤④中洗涤和分离粗硝基苯应使用的仪器是____________。
(4)步骤④中粗产品用5%NaOH溶液洗涤的目的是____________________________。
(5)纯硝基苯是无色、密度比水________(填“小”或“大”)、具有苦杏仁味的油状液体。
答案:(1)先将浓HNO3注入容器中,再慢慢注入浓H2SO4,并及时搅拌和冷却
(2)将反应器放在50~60 ℃的水浴中加热 (3)分液漏斗 (4)除去粗产品中残留的酸
(5)大
5.关于银镜反应的实验操作步骤如下:
A.在试管中先注入少量NaOH溶液,振荡,加热煮沸之后把NaOH溶液倒去,再用蒸馏水洗净试管备用。
B.在洗净的试管里配制银氨溶液。
C.向银氨溶液中滴入3~4滴乙醛稀溶液。
D.加热。
请回答下列问题:
(1)步骤A中加NaOH溶液振荡,加热煮沸的目的是____________________________。
(2)简述银氨溶液的配制过程:__________________________________________
________________________________________________________________________。
(3)写出乙醛发生银镜反应的化学方程式:_________________________________
________________________________________________________________________。
答案:(1)除去试管内壁的油污
(2)向洁净的试管中加入适量2%的硝酸银溶液,然后边振荡试管边逐滴滴入2%的稀氨水,至最初产生的沉淀恰好溶解为止
(3)CH3CHO+2Ag(NH3)2OHCH3COONH4+2Ag↓+3NH3+H2O
6.某同学用如图所示实验装置制取乙酸乙酯。回答以下问题:
(1)在大试管中先加入3 mL________,然后一边摇动一边慢慢地加入2 mL____________和2 mL乙酸,混合均匀,然后加入几粒碎瓷片。按上图连接好装置,用酒精灯对大试管小心均匀加热,当观察到明显现象时停止实验。
(2)加入浓硫酸的目的是______________________。
(3)加热前,大试管中加入几粒碎瓷片的作用是______,饱和碳酸钠溶液的作用是________________________________________________________________________
________________________________________________________________________。
(4)乙酸乙酯的密度比水________(填“大”或“小”),有水果香气味。
(5)与书中采用的实验装置的不同之处是这位同学采用了球形干燥管代替了长导管,并将干燥管的末端插入了饱和碳酸钠溶液中,在此处球形干燥管的作用有:
①________________________________________________________________________,
②________________________________________________________________________。
(6)有甲、乙、丙三位同学,分别将乙酸与乙醇反应得到的酯(未用饱和Na2CO3溶液承接)提纯,在未用指示剂的情况下,他们都是先加NaOH中和过量的酸,然后用蒸馏法将酯分离出来。但他们的结果却不同:
①甲得到不溶于水的中性酯;②乙得到显酸性的酯的混合物;③丙得到大量水溶性物质。
试分析产生上述各种现象的原因。
①________________________________________________________________________。
②________________________________________________________________________。
③________________________________________________________________________。
(7)下图是某同学探究“分离乙酸乙酯、乙醇、乙酸混合物”实验操作步骤流程图。
(a)____________;(b)____________。(填试剂名称)
①____________;②____________;③____________。(填分离方法)
答案:(1)乙醇 浓H2SO4
(2)做催化剂;做吸水剂,有利于反应向生成酯的方向进行
(3)防止暴沸 中和乙酸、溶解乙醇,降低乙酸乙酯的溶解度,便于分层,提纯乙酸乙酯
(4)小
(5)①防止倒吸 ②使乙酸乙酯充分冷凝
(6)①甲同学加入的碱正好将过量的酸中和,所以蒸馏后得到中性酯 ②乙同学加入碱量不足,所以蒸馏出来的酯含有过量的酸,得到显酸性的酯的混合物 ③丙同学加入的碱过量使生成的酯水解为可溶性的醇和钠盐
(7)饱和碳酸钠溶液 硫酸 分液 蒸馏 蒸馏