- 300.23 KB
- 2021-02-26 发布
HLLYBQ 整理 供“高中试卷网(http://sj.fjjy.org)”
·1·
浏阳一中、醴陵一中 2018-2019 学年高二 12 月联考
化学试题
总分:100 分 时量:90 分钟 考试时间 2018 年 12 月 24 日
命题人:攸县一中高二化学组 审题人:攸县一中高二化学组
姓名: 考号:
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Cl:35.5 Fe:56 S:32
第Ⅰ卷 选择题(共 48 分)
一、选择题(共 16 小题,每小题 3 分,共 48 分。每小题都只有一个..选项符合题意)
1.下列物质的分类组合全部正确的是( )
选项 强电解质 弱电解质 非电解质
A CaO HBr CO2
B NaHCO3 NH3·H2O NH3
C Ba(OH)2 H2O Cu
D H2SO4 BaSO4 C2H5OH
2.下列关于反应能量的说法正确的是( )
A.一定条件下 2SO2(g)+O2(g) 2SO3(g) △H1 ,2SO2(g)+O2(g) 2SO3(l) △H2 则△H1>△H2
B.相同条件下,如果 1 mol 氢原子所具有的能量为 E1,1 mol 氢分子所具有的能量为 E2,则 2E1=
E2
C.甲烷的燃烧热为 890.3 kJ•mol﹣1,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=﹣890.3 kJ•mol﹣1
D.已知 H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,则含 1 mol NaOH 的氢氧化钠溶液
与含 0.5 mol H2SO4 的浓硫酸混合放出 57.3 kJ 的热量
3.一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合题图的是( )
HLLYBQ 整理 供“高中试卷网(http://sj.fjjy.org)”
·2·
时间
水
蒸
气
含
量
温 度 (T) 的 影
T1
T2
时间
水
蒸
气
含
量
温 度 (P) 的 影
P1
P2
A.CO2(g)+2NH3(g) CO(NH2)2(s)+H2O(g) ΔH<0
B.CO2(g)+H2(g) CO(g)+H2O(g) ΔH>0
C.CH3CH2OH(g) CH2=CH2(g)+H2O(g) ΔH>0
D.2C6H5CH2CH3(g)+O2(g) 2C6H5CH=CH2(g)+2H2O(g) ΔH<0
4.常温下,下列四种溶液:①c(H+)=1mol·L-1 的醋酸 ②0.1mol·L-1 的盐酸 ③0.01mol·L-1 的
NaOH 溶液 ④c(OH-)=10-3mol·L-1 氨水溶液。由水电离出的氢离子浓度之比为( )
A.1∶10∶100∶1000 B.0∶1∶12∶11
C.14∶13∶12∶11 D.14∶13∶2∶3
5.在 0.10mol·L-1 CH3COOH 溶液中存在如下电离平衡:CH3COOH CH3COO-+H+对于该平衡,下
列叙述正确的是( )
A.加入水时,平衡向逆反应方向移动
B.加入少量 NaOH 固体,平衡向正反应方向移动
C.加入少量 0.1mol·L-1 HCl 溶液,溶液中 c(H+)减小
D.加入少量 CH3COONa 固体,平衡向正反应方向移动
6.下列实验不能达到预期实验目的是( )
序
号
实验内容 实验目的
A
室 温 下 , 用 pH 试 纸 测 定 浓 度 为 0.1mol·L-1NaClO 溶 液 和
0.1mol·L-1CH3COONa 溶液的 pH
比较 HClO 和 CH3COOH 的酸性
强弱
B
向盛有 1mL 硝酸银溶液的试管中滴加 NaCl 溶液,至不再有沉淀生
成,再向其中滴加 Na2S 溶液
说明一种沉淀能转化为另一
种溶解度更小的沉淀
C
向含有少量 FeCl3 的 MgCl2 溶液中加入足量 Mg(OH)2 粉末,搅拌一会
过滤
除去 MgCl2 中少量 FeCl3
D 室温下,分别向 2 支试管中加入相同体积、相同浓度的 Na2S2O3 溶液,研究浓度对反应速率的影响
HLLYBQ 整理 供“高中试卷网(http://sj.fjjy.org)”
·3·
再分别加入相同体积不同浓度的稀硫酸
7.在下列给定条件的溶液中,一定能大量共存的离子组是( )
A.无色溶液:K+ Cl- Mg2+ SO4
2- Cr2O7
2-
B.能使 pH 试纸呈红色的溶液:Na+、NH+
4 、I-、NO-
3
C.Na2CO3 溶液:K+、Fe3+、SO2-
4 、NO-
3
D. KW
c H+ =0.1 mol/L 的溶液:Na+、K+、SiO2-
3 、NO-
3
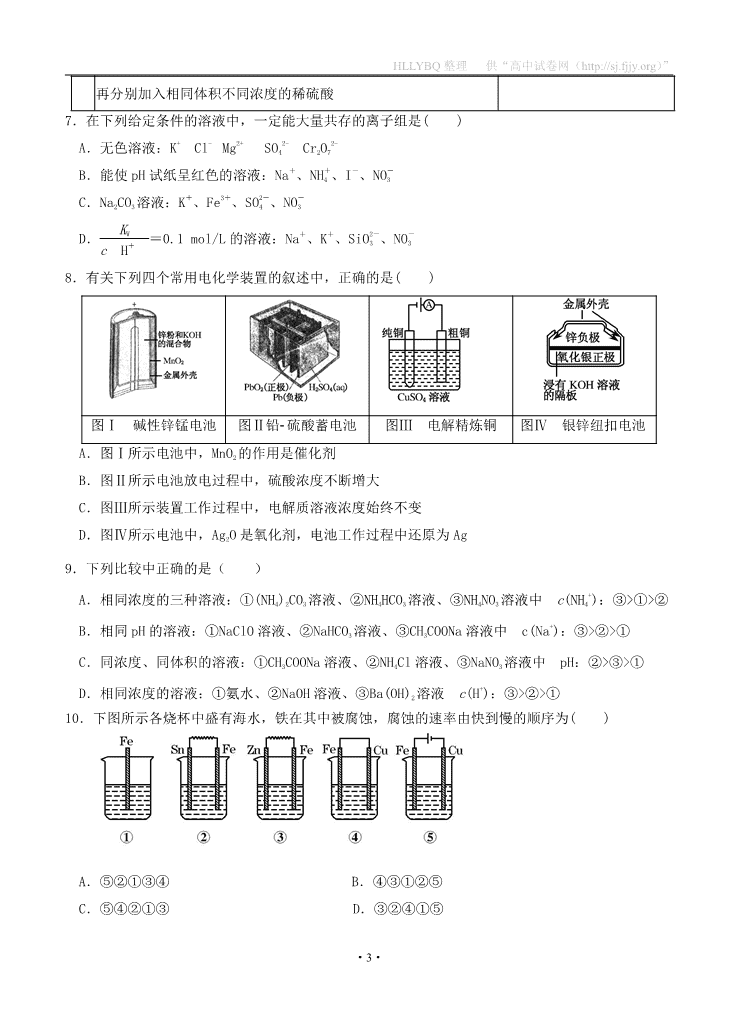
8.有关下列四个常用电化学装置的叙述中,正确的是( )
图Ⅰ 碱性锌锰电池 图Ⅱ铅硫酸蓄电池 图Ⅲ 电解精炼铜 图Ⅳ 银锌纽扣电池
A.图Ⅰ所示电池中,MnO2 的作用是催化剂
B.图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C.图Ⅲ所示装置工作过程中,电解质溶液浓度始终不变
D.图Ⅳ所示电池中,Ag2O 是氧化剂,电池工作过程中还原为 Ag
9.下列比较中正确的是( )
A.相同浓度的三种溶液:①(NH4)2CO3 溶液、②NH4HCO3 溶液、③NH4NO3 溶液中 c(NH4
+):③>①>②
B.相同 pH 的溶液:①NaClO 溶液、②NaHCO3 溶液、③CH3COONa 溶液中 c(Na+):③>②>①
C.同浓度、同体积的溶液:①CH3COONa 溶液、②NH4Cl 溶液、③NaNO3 溶液中 pH:②>③>①
D.相同浓度的溶液:①氨水、②NaOH 溶液、③Ba(OH)2 溶液 c(H+):③>②>①
10.下图所示各烧杯中盛有海水,铁在其中被腐蚀,腐蚀的速率由快到慢的顺序为( )
A.⑤②①③④ B.④③①②⑤
C.⑤④②①③ D.③②④①⑤
HLLYBQ 整理 供“高中试卷网(http://sj.fjjy.org)”
·4·
11.一定温度时,向容积为 2L 的密闭容器中充入一定量的 SO2 和 O2,发生反应 2SO2(g)+O2(g) 2SO3(g)
△H=-196 kJ•mol-1,一段时间后达平衡,反应过程中测定的部分数据见下表:
反应时间/min n(SO2)/mol n(O2)/mol
0 2 1
5 1.2
10 0.4
15 0.8
下列说法不正确的是( )
A. 反应在前 5min 的平均速率为 v(O2) =0.04mol·L-1·min-1
B. 相同温度下,起始时向容器中充入 1.5molSO3,达平衡时 SO3 的转化率为 40%
C. 保持温度不变,向平衡后的容器中再充入 0.2molSO2 和 0.2molSO3 时,此时平衡正向移动
D. 保持其他条件不变,若起始时向容器中充入 2molSO3,达平衡时吸收 78.4 kJ 的热量
12.下列说法中,与盐类水解有关的是( )
①明矾可以做净水剂;
②实验室配制 FeCl3 溶液时,将 FeCl3 溶于少量的浓盐酸再加水稀释;
③用 NaHCO3 和 Al2(SO4)3 两种溶液可作泡沫灭火剂;
④在 NH4Cl 溶液中加入金属镁会产生氢气;
⑤草木灰与铵态氮肥不能混合施用;
⑥比较 NH4Cl 和 Na2S 等某些盐溶液的酸碱性.
A.①④⑥ B.②③⑤ C.③④⑤ D.①②③④⑤⑥
13.已知 A(g)+C(g)===D(g);ΔH=-Q1kJ/mol,B(g)+C(g)===E(g);ΔH=-Q2kJ/mol,Q1、Q2 均
大于 0,且 Q1>Q2,若 A 与 B 组成的混合气体 1mol 与足量的 C 反应,放热为 Q3kJ,则原混合气体
中 A 与 B 物质的量之比为( )
A.Q3-Q2
Q1-Q3
B.Q1-Q3
Q3-Q2
C.Q3-Q2
Q1-Q2
D.Q1-Q3
Q1-Q2
14.某温度时,AgCl(s) Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示。下列说法正确
的是( )
A.加入 AgNO3,可以使溶液由 c 点变到 d 点
B.加入少量水,平衡右移,Cl-浓度减小
HLLYBQ 整理 供“高中试卷网(http://sj.fjjy.org)”
·5·
C.d 点没有 AgCl 沉淀生成
D.c 点对应的 Ksp 等于 a 点对应的 Ksp
15. 镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为 KOH 溶液,
其充、放电按下式进行:Cd + 2NiOOH + 2H2O 放电
充电
Cd(OH)2 + 2Ni(OH)2 有关该电池的说法正确
的是( )
A.充电时阳极反应:Ni(OH)2-e- + OH- = NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的 OH-向正极移动
16.常温下,现向 50 mL 0.1 mol·L-1 NH4HSO4 溶液中滴加 0.05 mol·L-1 NaOH 溶液,得到溶液的 pH
与 NaOH 溶液体积的关系曲线如下图所示(假设滴加过程中无气体产生)。下列说法正确的是( )
A . b 点 溶 液 中 离 子 浓 度 由 大 到 小 的 顺 序 为 : c(Na+) > c(SO4
2-) > c(NH4
+) > c(H+) >
c(OH-)
B.图中 b、c、d 三点溶液中水的电离程度最大的是 c 点
C.b 点后滴加 NaOH 溶液过程中,NH3·H2O 的电离程度逐渐减小
D.pH=7 时,溶液中 c(H+)+c(Na+)+c(NH4
+)=c(SO4
2-)+c(OH-)
Ⅱ卷 非选择题(共 52 分)
二、非选择题(本题共 5 个大题,除说明外,每空 2 分,共 52 分)
17.(10 分)甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
HLLYBQ 整理 供“高中试卷网(http://sj.fjjy.org)”
·6·
(1)已知:CH3OH(g)=HCHO(g)+H2(g) △H=+84kJ⋅mol−1, 2H2(g)+O2(g)═2H2O(g) △H=−484kJ⋅mol−1
工业上常以甲醇为原料制取甲醛,请写出 CH3OH(g)与 O2(g)反应生成 HCHO(g)和 H2O(g)的热化学方程
式:
(2)在一容积为 2L 的密闭容器内,充入 0.2molCO 与 0.4molH2 发生反应 CO(g)+2H2(g)CH3OH(g)
CO 的平衡转化率与温度,压强的关系如图所示。
①A,B 两点对应的压强大小关系是 PA________PB(填“>,<,=”)
②下列叙述能说明上述反应能达到化学平衡状态的是 (填代号)
a.H2 的消耗速率是 CH3OH 生成速率的 2 倍 b.CH3OH 的体积分数不再改变
c.混合气体的密度不再改变 d.气体的平均相对分子质量和压强不再改变
③在 P1 压强、T1°C 时,该反应的平衡常数 K=_________(填计算结果)
④T1°C、1L 的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下:CO:0.1mol, H2 :
0.2mol, CH3OH:0.2mol。此时 v 正 ________ v 逆(填> 、 < 或 =)。
18.(12 分)已知 25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 CH3COOH H2CO3 HClO
电离平衡常数 Ka=1.8×10﹣5 Ka1=4.3×10﹣7
Ka2=5.6×10﹣11
Ka=3.0×10﹣8
(1)物质的量浓度均为 0.1mol•L﹣1 的四种溶液:pH 由小到大排列的顺序是 (用编号填
写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1mol•L﹣1 CH3COOH 溶液加水稀释过程中,下列表达式的数据变大的是 (填
字母)
HLLYBQ 整理 供“高中试卷网(http://sj.fjjy.org)”
·7·
A. c(H+) B. C. c(H+)•c(OH﹣)
D. E.
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:
(4)25℃时,CH3COOH 与 CH3COONa 的混合溶液,若测得混合液 pH=6,则溶液中 c(CH3COO﹣)﹣c(Na+)
=________(填准确数值).
(5)25℃时,将 a mol•L﹣1 的醋酸与 b mol•L﹣1 氢氧化钠等体积混合,反应后溶液恰好显中性,用 a、
b 表示醋酸的电离平衡常数为
(6)标准状况下,将 1.12L CO2 通入 100mL 1mol•L﹣1 的 NaOH 溶液中,用溶液中微粒的浓度符号完成
下列等式: c(OH﹣)=2c(H2CO3)+
19.(12 分)某课外活动小组用如图装置进行实验,试回答下列问题:
(1)若开始时开关 K 与 a 连接,则 A 极的电极反应式为
B 极的 Fe 发生 腐蚀(填“析氢”或“吸氧”)
(2)若开始时开关 K 与 b 连接,下列说法正确的是________(填序号)
①溶液中 Na+向 A 极移动
②从 A 极处逸出的气体能使湿润的 KI 淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下 B 极产生 2.24 L 气体,则溶液中转移 0.2 mol 电子
且此时装置内总反应的离子方程式为
(3)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫
酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
①该电解槽的阳极反应式为 ,此时通过阴离子交换膜
的离子数________(填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口________(填“A”“B”“C”或“D”)导出。
HLLYBQ 整理 供“高中试卷网(http://sj.fjjy.org)”
·8·
20.(8 分)研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题:
Ⅰ.(1)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol 化学键时释
放(或吸收)的能量。已知:N≡N 键的键能是 948.9 kJ·mol-1,H—H 键的键能是 436.0 kJ·mol-1;
N—H 键的键能是 391.55 kJ·mol-1。则 1/2N2(g)+3/2H2(g)===NH3(g) ΔH=______________
Ⅱ.下图是一个化学过程的示意图,回答下列问题:
(1)乙装置中电极 A 的名称是__________
(2)甲装置中通入 CH4 的电极反应式为
(3)一段时间,当丙池中产生 112 mL(标准状况下)气体时,均匀搅拌丙池,所得溶液在 25 ℃时的 pH
=________(已知:NaCl 溶液足量,电解后溶液体积为 500 mL)。
21.(10 分)草酸晶体的组成可表示为 H2C2O4·xH2O,为了测定 x 值,进行下述实验:
①称取 n g 草酸晶体配成 100.00 mL 水溶液;
②取 25.00 mL 所配制的草酸溶液置于锥形瓶中,加稀硫酸,用浓度为 a mol·L-1 的 KMnO4 溶液滴定,
试回答下列问题:
(1)写出滴定实验中所发生反应的化学方程式:
(2)实验中 KMnO4 溶液应装在____式滴定管中,滴定终点的判断依据是
(3)滴定过程中用去 V mL a mol·L-1 的 KMnO4 溶液,则所配制的草酸的物质的量浓度为_______mol·L
-1
(4)若滴定终点读数时目光俯视,则计算出的 x 值可能_______________(填偏大、偏小、无影响)
HLLYBQ 整理 供“高中试卷网(http://sj.fjjy.org)”
·9·
浏阳一中、醴陵一中 2018 年下学期高二年级联考化学答案
一、选择题(共 16 小题,每小题 3 分,共 48 分)
1 2 3 4 5 6 7 8
B A A A B A D D
9 10 11 12 13 14 15 16
B C B D A D A C
二、非选择题(本题共 5 个大题,除说明外,每空 2 分,共 52 分)
17. (10 分)
(1)2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g) △H=-316kJ/mol
(2)①< ②bd ③100 ④>
18.(12 分)
(1)a<d<c<b
(2)BD
(3)ClO﹣+H2O+CO2=HCO3
﹣+HClO
(4)9.9×10﹣7mol•L﹣1
(5)
(6)c(HCO3
﹣)+c(H+)
19.(12 分)
(1) O2+2H2O+4e-===4OH- 吸氧
(2) ② 2Cl-+2H2O
=====
电解 2OH-+H2↑+Cl2↑
(3)①4OH--4e-===2H2O+O2↑(或 4H2O-4e-=== O2↑+4H+) 小于(1 分)
②D(1 分)
20.(8 分)
Ⅰ.(1)-46.2 kJ·mol-1
Ⅱ.(1) 阳极
(2)CH4+10OH--8e-===CO
2-
3 +7H2O
(3)12
21.(10 分)
(1) 2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
HLLYBQ 整理 供“高中试卷网(http://sj.fjjy.org)”
·10·
(2)酸 ,滴入最后一滴 KMnO4 溶液时,锥形瓶内溶液的颜色恰好由无色变成红色,且半分钟内不
褪色。
(3)
(4)偏大
欢迎访问“高中试卷网”——http://sj.fjjy.org
相关文档
- 四年级上册数学单元测试- 第八单元2021-02-27 09:11:449页
- 妇产科护理学综合练习试卷12021-02-27 09:11:4217页
- 2019-2020学年江西省宜春市宜丰中2021-02-27 09:11:4215页
- 江西省吉安市永丰二中2016届高三上2021-02-27 09:11:3931页
- 内蒙古鄂尔多斯市2018-2019学年高2021-02-27 09:11:377页
- 医学考试-中医内科学(方剂学)-试卷42021-02-27 09:11:3313页
- 医学考试-中医外科学综合练习试卷12021-02-27 09:11:3221页
- 2020年四川省攀枝花市中考数学试卷2021-02-27 09:11:3119页
- 2019届浙江省杭州市高考命题比赛模2021-02-27 09:11:2713页
- 小学二年级数学上册第一次月考试卷2021-02-27 09:11:226页