- 1.36 MB
- 2021-02-26 发布
专题二十一 物质的制备 实验方案的设计与评价
挖命题
【考情探究】
考点
内容解读
5年考情
预测热度
考题示例
难度
关联考点
物质的制备
掌握常见气体的实验室制法(包括所有试剂、反应原理、仪器和收集方法)
2018课标Ⅰ,26,14分
难
氧化还原反应
★★★
实验方案的
设计与评价
根据化学实验的目的和要求,能做到:
①设计实验方案;②正确选用实验装置;
③掌握控制实验条件的方法;④预测或描述实验现象,分析或处理数据,得出合理结论;⑤评价或改进实验方案
2018课标Ⅱ,28,15分
难
CO2、CO的性质
滴定原理的应用
★★★
分析解读 物质制备、实验方案的设计与评价作为综合实验专题是历年高考必考内容,特别是实验方案的设计,可综合考查仪器的使用、装置的连接、实验基本操作、实验现象的分析等多个考点。实验方案的评价以选择题形式呈现频率较高,但也可以是综合实验题中的某一小题。
【真题典例】
破考点
【考点集训】
考点一 物质的制备
1.(2019届山东临沂教学质量检测,15)用下图装置制取并收集表中的四种气体(图中夹持仪器均已略去;a、b、c表示相应仪器中加入的试剂),能达到实验目的的是( )
选项
气体
a
b
c
A
H2
稀硫酸
Zn
浓硫酸
B
CO2
盐酸
CaCO3
饱和碳酸钠溶液
C
Cl2
浓盐酸
KMnO4
饱和食盐水
D
SO2
浓硫酸
Cu
浓硫酸
答案 C
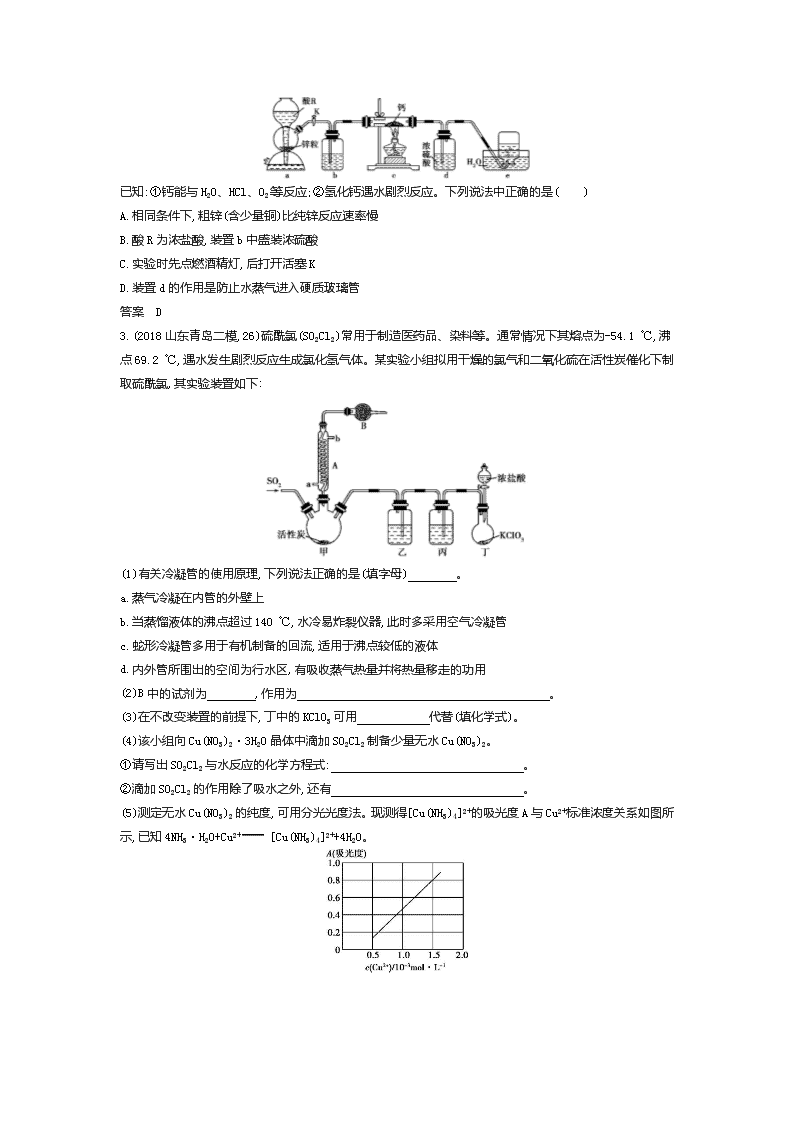
2.(2018山东聊城一模,9)某学习小组设计实验制备氢化钙(CaH2),实验装置如下图所示。
已知:①钙能与H2O、HCl、O2等反应;②氢化钙遇水剧烈反应。下列说法中正确的是( )
A.相同条件下,粗锌(含少量铜)比纯锌反应速率慢
B.酸R为浓盐酸,装置b中盛装浓硫酸
C.实验时先点燃酒精灯,后打开活塞K
D.装置d的作用是防止水蒸气进入硬质玻璃管
答案 D
3.(2018山东青岛二模,26)硫酰氯(SO2Cl2)常用于制造医药品、染料等。通常情况下其熔点为-54.1 ℃,沸点69.2 ℃,遇水发生剧烈反应生成氯化氢气体。某实验小组拟用干燥的氯气和二氧化硫在活性炭催化下制取硫酰氯,其实验装置如下:
(1)有关冷凝管的使用原理,下列说法正确的是(填字母) 。
a.蒸气冷凝在内管的外壁上
b.当蒸馏液体的沸点超过140 ℃,水冷易炸裂仪器,此时多采用空气冷凝管
c.蛇形冷凝管多用于有机制备的回流,适用于沸点较低的液体
d.内外管所围出的空间为行水区,有吸收蒸气热量并将热量移走的功用
(2)B中的试剂为 ,作用为 。
(3)在不改变装置的前提下,丁中的KClO3可用 代替(填化学式)。
(4)该小组向Cu(NO3)2·3H2O晶体中滴加SO2Cl2制备少量无水Cu(NO3)2。
①请写出SO2Cl2与水反应的化学方程式: 。
②滴加SO2Cl2的作用除了吸水之外,还有 。
(5)测定无水Cu(NO3)2的纯度,可用分光光度法。现测得[Cu(NH3)4]2+的吸光度A与Cu2+标准浓度关系如图所示,已知4NH3·H2O+Cu2+ [Cu(NH3)4]2++4H2O。
称取0.315 0 g制得的无水Cu(NO3)2样品,用蒸馏水溶解并配制成100 mL溶液,用 (填仪器名称)准确量取10.00 mL,加过量氨水,再用蒸馏水稀释至100 mL,测得其吸光度A=0.8。则此无水Cu(NO3)2样品的纯度是 (保留三位有效数字)。
答案 (1)bcd (2)碱石灰(或氢氧化钠) 吸收过量的SO2或Cl2,防止污染;防止空气中水蒸气进入三颈烧瓶使硫酰氯水解 (3)KMnO4、K2Cr2O7、KClO或对应的钠盐
(4)①2H2O+SO2Cl2 H2SO4+2HCl↑ ②抑制Cu(NO3)2水解 (5)移液管或酸式滴定管 89.5%
考点二 实验方案的设计与评价
1.(2018山东临沂三模,26)亚氯酸钠(NaClO2)是一种高效的漂白剂和水处理剂。以氯酸钠为原料制备亚氯酸钠的装置如下图所示(夹持装置省略)。
已知:
①纯ClO2易分解爆炸,空气中ClO2的体积分数在10%以下比较安全。
②NaClO2饱和溶液在温度低于38 ℃时析出晶体NaClO2·3H2O;高于38 ℃时析出NaClO2;高于60 ℃时NaClO2分解成NaClO3和NaCl。
(1)检查A装置气密性的方法是 。该装置中产生ClO2的化学方程式为 。
(2)实验过程中需要持续通入空气,目的是 。
(3)NaClO2在碱性溶液中才能稳定存在,下列可用于检测三颈瓶中溶液酸碱性的是 (填代号)。
a.石蕊 b.酚酞 c.pH试纸 d.pH计
(4)B装置中发生反应的离子方程式为 ;使用冰水浴的原因是 ;反应结束后,从溶液中得到NaClO2固体的实验操作是 。
(5)NaClO2是一种高效水处理剂,在一定条件下可以将CN-氧化成两种无毒无害的气体。现用NaClO2处理10 m3含CN-a mg·L-1的工业污水,理论上至少需要NaClO2的质量是 g。
答案 (1)关闭K1、K2,向分液漏斗中注入水,打开分液漏斗活塞,开始有少量水滴下,一段时间后,水不能滴下,说明装置A气密性好 2NaClO3+Na2SO3+H2SO4 2ClO2↑+2Na2SO4+H2O
(2)稀释ClO2,使生成的ClO2全部进入三颈瓶中
(3)d (4)2ClO2+2OH-+H2O2 2ClO2-+2H2O+O2 防止NaClO2分解 在38~60 ℃条件下,减压蒸发结晶、过滤、洗涤、干燥 (5)43.5a
2.(2018山东聊城三模,26)莫尔法是用硝酸银标准溶液测定卤离子含量的沉淀滴定法。将无水FeCl3与氯苯混合发生反应:2FeCl3+C6H5Cl 2FeCl2+C6H4Cl2+HCl↑,将生成的HCl用水吸收,利用莫尔法测出无水FeCl3的转化率,同时得到常用的还原剂FeCl2,按照如图装置,在三颈烧瓶中放入162.5 g无水FeCl3与225 g氯苯,控制反应温度在130 ℃下加热3 h,冷却、过滤、洗涤、干燥得到粗产品。有关数据如下:
物质
C6H5Cl
C6H4Cl2
熔点/℃
-45
53
沸点/℃
132
173
物质
AgCl
Ag2CrO4
颜色
白色
砖红色
溶度积
1.56×10-10
9.0×10-12
回答下列问题:
(1)仪器a的名称是 ,搅拌器的作用是 。
(2)反应结束后,还要继续通入N2的目的是 ;仪器c盛装的试剂是 (填序号)。
A.碱石灰 B.浓硫酸
C.无水氯化钙 D.硅胶
(3)如何从滤液中回收过量的氯苯? 。
(4)下列各装置(盛有蒸馏水)能代替图中虚线框内部分的是 (填序号)。
(5)将锥形瓶内的溶液稀释至1 000 mL,从中取10.00 mL,用0.200 0 mol·L-1 AgNO3溶液进行滴定,以K2CrO4溶液作指示剂,终点现象为 ;若消耗22.50 mL AgNO3溶液,则无水FeCl3的转化率为 。
(6)上述滴定完成时,若滴定管尖嘴处留有气泡会导致测定结果偏 (填“高”或“低”)。
答案 (1)三颈烧瓶或三口烧瓶 加快反应速率
(2)将反应生成的HCl全部排至装置d,被水完全吸收 CD
(3)蒸馏滤液,收集132 ℃的馏分 (4)eg (5)砖红色沉淀刚好出现 90% (6)低
炼技法
【方法集训】
方法 不同类型综合性实验题的解答思维建模
1.(2018山东济南二模,26)硫化钠又称硫化碱,为无色、易溶于水和热乙醇的固体,常用于制造硫代硫酸钠、多硫化钠、硫化染料等。实验室中用工业硫化钠(因含重金属硫化物和煤粉等而呈褐色)、纯碱等物质制备硫代硫酸钠晶体(Na2S2O3·5H2O)的原理如下:Na2CO3+SO2 Na2SO3+CO2、S+ Na2SO3 Na2S2O3。回答下列问题:
(1)工业硫化钠的纯化
将18 g工业硫化钠加入烧瓶中,再加入150 mL 95%的乙醇溶液和8 mL水。用如图所示装置进行沸水浴加热,并回流40 min,趁热过滤,冷却、搅拌、结晶、倾析,除去上层母液;最后用95%的乙醇溶液洗涤,烘干,得到Na2S·9H2O晶体。图中仪器a的名称是 ,该过程中回流40 min的目的是 。
(2)硫代硫酸钠的制备
称取纯化后的Na2S·9H2O晶体14.4 g和m g Na2CO3,混合后置于锥形瓶中,加入150 mL蒸馏水,微热后按照下图组装仪器;然后打开分液漏斗的活塞和螺旋夹6,并适当调节该螺旋夹,向锥形瓶中通入SO2气体,当溶液呈中性时,停止通入SO2气体,对反应后溶液进行后续处理,即可制得硫代硫酸钠晶体(Na2S2O3·5H2O)。
①适当调节螺旋夹6的目的是 。
②实验过程中,通入SO2一段时间后,溶液中会生成大量淡黄色沉淀,然后又变澄清。生成淡黄色沉淀的化学方程式为 。若通入SO2气体时间过长,会降低硫代硫酸钠的产率,原因是 。
③为提高产品纯度,节约原料,m= g;
④反应结束后,需对溶液进行后续处理,得到硫代硫酸钠晶体(Na2S2O3·5H2O),其操作是蒸发浓缩,冷却结晶、过滤、 、烘干。称量所得产品,质量为n g,则Na2S2O3·5H2O的产率为 %。
答案 (1)球形冷凝管 保证硫化钠充分溶解
(2)①控制气体流速,保证SO2充分反应,防倒吸
②2Na2S+3SO2 3S↓+2Na2SO3 通入SO2时间过长,会使溶液酸性较强,导致Na2S2O3因反应而损耗 ③3.18
④洗涤 4.48n(或100n/22.32)
2.(2017山东青岛质检一,26)氯化铁可用作金属蚀刻、有机合成的催化剂,研究其制备及性质是一个重要的课题。
(1)氯化铁晶体的制备
①实验过程中装置乙中发生反应的离子方程式有 ,装置丙的作用为 。
②为顺利达到实验目的,上述装置中弹簧夹打开和关闭的顺序为 。
③反应结束后,将乙中溶液边加入 ,边进行加热浓缩、 、过滤、洗涤、干燥即得到产品。
(2)氯化铁的性质探究
某兴趣小组将饱和FeCl3溶液进行加热蒸发、蒸干灼烧,在试管底部得到固体。为进一步探究该固体的成分设计了如下实验。(查阅文献知:①FeCl3溶液浓度越大,水解程度越小;②氯化铁的熔点为306 ℃、沸点为315 ℃,易升华,气态FeCl3会分解成FeCl2和Cl2;③ FeCl2的熔点为670 ℃)
操作步骤
实验现象
解释原因
打开K,充入氮气
D中有气泡产生
①充入N2的原因是
关闭K,加热至600 ℃,充分灼烧固体
B中出现棕黄色固体
②产生现象的原因
是
实验结束,振荡C静置
③
④ (用相关的方程式说明)
⑤结合以上实验和文献资料,该固体可以确定的成分有
答案 (1)① Fe+2H+ Fe2++H2↑、Cl2+2Fe2+ 2Fe3++2Cl- 吸收多余的氯气
②关闭弹簧夹1和3,打开弹簧夹2,待铁屑完全溶解后打开弹簧夹1和3,关闭弹簧夹2
③浓盐酸 冷却结晶
(2)①排出装置内的空气 ②FeCl3易升华 ③溶液分层,上层接近无色,下层橙红色 ④2FeCl3 2FeCl2+Cl2、2Br-+Cl2 Br2+2Cl- ⑤FeCl3、Fe2O3
过专题
【五年高考】
A组 山东省卷、课标卷题组
考点一 物质的制备
1.(2016课标Ⅱ,13,6分)下列实验操作能达到实验目的的是( )
实验目的
实验操作
A.
制备Fe(OH)3胶体
将NaOH浓溶液滴加到饱和FeCl3溶液中
B.
由MgCl2溶液制备无水MgCl2
将MgCl2溶液加热蒸干
C.
除去Cu粉中混有的CuO
加入稀硝酸溶解,过滤、洗涤、干燥
D.
比较水与乙醇中氢的活泼性
分别将少量钠投入到盛有水和乙醇的烧杯中
答案 D
2.(2018课标Ⅰ,26,14分)醋酸亚铬[(CH3COO)2Cr·2H2O]为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如图所示。回答下列问题:
(1)实验中所用蒸馏水均需经煮沸后迅速冷却,目的是 。仪器a的名称是 。
(2)将过量锌粒和氯化铬固体置于c中,加入少量蒸馏水,按图连接好装置。打开K1、K2,关闭K3。
①c中溶液由绿色逐渐变为亮蓝色,该反应的离子方程式为 。
②同时c中有气体产生,该气体的作用是 。
(3)打开K3,关闭K1和K2。c中亮蓝色溶液流入d,其原因是 ;d中析出砖红色沉淀。为使沉淀充分析出并分离,需采用的操作是 、 、洗涤、干燥。
(4)指出装置d可能存在的缺点 。
答案 (1)去除水中溶解氧 分液(或滴液)漏斗
(2)①Zn+2Cr3+ Zn2++2Cr2+
②排除c中空气
(3)c中产生H2使压强大于大气压 (冰浴)冷却 过滤
(4)敞开体系,可能使醋酸亚铬与空气接触
3.(2014山东理综,31,20分)工业上常利用含硫废水生产Na2S2O3·5H2O,实验室可用如下装置(略去部分夹持仪器)模拟生产过程。
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g) Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO2(g) 3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq) Na2S2O3(aq) (Ⅲ)
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若 ,则整个装置气密性良好。装置D的作用是 。
装置E中为 溶液。
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为 。
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 。
a.蒸馏水 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
实验中,为使SO2缓慢进入烧瓶C,采用的操作是 。已知反应(Ⅲ)相对较慢,则烧瓶C中反应达到终点的现象是 。反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器还有 。
a.烧杯 b.蒸发皿 c.试管 d.锥形瓶
(4)反应终止后,烧瓶C中的溶液经蒸发浓缩、冷却结晶即可析出Na2S2O3·5H2O,其中可能含有Na2SO3、Na2SO4等杂质。利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作、现象和结论:
。
已知Na2S2O3·5H2O遇酸易分解:S2O32-+2H+ S↓+SO2↑+H2O
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液
答案 (1)液柱高度保持不变 防止倒吸 NaOH(合理即得分) (2)2∶1
(3)c 控制滴加硫酸的速度(合理即得分)
溶液变澄清(或浑浊消失) a、d
(4)取少量产品溶于足量稀盐酸,静置,取上层溶液(或过滤,取滤液),滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质(合理即得分)
4.(2014课标Ⅱ,28,15分)某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,进行如下实验。
①氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mL c1 mol·L-1的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L-1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液。
②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)装置中安全管的作用原理是 。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用 式滴定管,可使用的指示剂为 。
(3)样品中氨的质量分数表达式为 。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将 (填“偏高”或“偏低”)。
(5)测定氯的过程中,使用棕色滴定管的原因是 ;滴定终点时,若溶液中c(Ag+)=2.0×10-5 mol·L-1,c(CrO42-)为 mol·L-1。[已知:Ksp(Ag2CrO4)=1.12×10-12]
(6)经测定,样品X中钴、氨和氯的物质的量之比为1∶6∶3,钴的化合价为 。制备X的化学方程式为 ;X的制备过程中温度不能过高的原因是
。
答案 (1)当A中压力过大时,安全管中液面上升,使A瓶中压力稳定(2分)
(2)碱 酚酞(或甲基红)(每空1分,共2分)
(3)(c1V1-c2V2)×10-3×17w×100%(2分)
(4)偏低(2分)
(5)防止硝酸银见光分解 2.8×10-3(每空1分,共2分)
(6)+3(1分)
2CoCl2+2NH4Cl+10NH3+H2O2 2[Co(NH3)6]Cl3+2H2O(2分) 温度过高过氧化氢分解、氨气逸出(2分)
考点二 实验方案的设计与评价
5.(2018课标Ⅱ,13,6分)下列实验过程可以达到实验目的的是 ( )
编号
实验目的
实验过程
A
配制0.400 0 mol·L-1的NaOH溶液
称取4.0 g固体NaOH于烧杯中,加入少量蒸馏水溶解,转移至250 mL容量瓶中定容
B
探究维生素C的还原性
向盛有2 mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化
C
制取并纯化氢气
向稀盐酸中加入锌粒,将生成的气体依次通过NaOH溶液、浓硫酸和KMnO4溶液
D
探究浓度对反应速率的影响
向2支盛有5 mL不同浓度NaHSO3溶液的试管中同时加入2 mL 5% H2O2溶液,观察实验现象
答案 B
6.(2014课标Ⅰ,13,6分)利用如图所示装置进行下列实验,能得出相应实验结论的是( )
选项
①
②
③
实验结论
A.
稀硫酸
Na2S
AgNO3与
AgCl的浊液
Ksp(AgCl)>
Ksp(Ag2S)
B.
浓硫酸
蔗糖
溴水
浓硫酸具有脱
水性、氧化性
C.
稀盐酸
Na2SO3
Ba(NO3)2
溶液
SO2与可溶性
钡盐均可生
成白色沉淀
D.
浓硝酸
Na2CO3
Na2SiO3
溶液
酸性:硝酸>
碳酸>硅酸
答案 B
7.(2018课标Ⅱ,28,15分)K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。回答下列问题:
(1)晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的化学方程式为:2K3[Fe(C2O4)3]2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为 。
(2)某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。
①通入氮气的目的是 。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有 、 。
③为防止倒吸,停止实验时应进行的操作是 。
④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是: 。
(3)测定三草酸合铁酸钾中铁的含量。
①称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点。滴定终点的现象是 。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。该晶体中铁的质量分数的表达式为 。
答案 (1)3FeC2O4+2K3[Fe(CN)6] Fe3[Fe(CN)6]2+
3K2C2O4
(2)①隔绝空气、使反应产生的气体全部进入后续装置
②CO2 CO
③先熄灭装置A、E的酒精灯,冷却后停止通入氮气
④取少许固体粉末于试管中,加稀硫酸溶解,滴入1~2滴KSCN溶液,溶液变红色,证明含有Fe2O3
(3)①粉红色出现 ②5cV×56m×1 000×100%
8.(2017课标Ⅲ,26,14分)绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知: 、 。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为m2 g。按下图连接好装置进行实验。
①仪器B的名称是 。
②将下列实验操作步骤正确排序 (填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯
c.关闭K1和K2 d.打开K1和K2,缓缓通入N2
e.称量A f.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数目x= (列式表示)。若实验时按a、d次序操作,则使x (填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
①C、D中的溶液依次为 (填标号)。C、D中有气泡冒出,并可观察到的现象分别为 。
a.品红 b.NaOH c.BaCl2
d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式 。
答案 (1)样品中没有Fe(Ⅲ) Fe(Ⅱ)易被氧气氧化为Fe(Ⅲ)
(2)①干燥管 ②dabfce
③76(m2-m3)9(m3-m1) 偏小
(3)①c、a 生成白色沉淀、褪色
②2FeSO4 Fe2O3+SO2↑+SO3↑
B组 其他自主命题省(区、市)卷题组
考点一 物质的制备
1.(2017天津理综,4,6分)以下实验设计能达到实验目的的是( )
实验目的
实验设计
A.
除去NaHCO3固体中的Na2CO3
将固体加热至恒重
B.
制备无水AlCl3
蒸发Al与稀盐酸反应后的溶液
C.
重结晶提纯苯甲酸
将粗品水溶、过滤、蒸发、结晶
D.
鉴别NaBr和KI溶液
分别加新制氯水后,用CCl4萃取
答案 D
2.(2015重庆理综,4,6分)下列实验中,所使用的装置(夹持装置略)、试剂和操作方法都正确的是( )
答案 A
3.(2015福建理综,25,15分)某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验。
实验一 制取氯酸钾和氯水
利用上图所示的实验装置进行实验。
(1)制取实验结束后,取出B中试管冷却结晶,过滤,洗涤。该实验操作过程需要的玻璃仪器有 。
(2)若对调B和C装置的位置, (填“能”或“不能”)提高B中氯酸钾的产率。
实验二 氯酸钾与碘化钾反应的研究
(3)在不同条件下KClO3可将KI氧化为I2或KIO3。该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录表如下(实验在室温下进行):
试管编号
1
2
3
4
0.20 mol·L-1 KI/mL
1.0
1.0
1.0
1.0
KClO3(s)/g
0.10
0.10
0.10
0.10
6.0 mol·L-1 H2SO4/mL
0
3.0
6.0
9.0
蒸馏水/mL
9.0
6.0
3.0
0
实验现象
①系列a实验的实验目的是 。
②设计1号试管实验的作用是 。
③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为 。
实验三 测定饱和氯水中氯元素的总量
(4)该小组设计的实验方案为:使用下图装置,加热15.0 mL饱和氯水试样,测定产生气体的体积。此方案不可行的主要原因是 。(不考虑实验装置及操作失误导致不可行的原因)
(5)根据下列资料,为该小组设计一个可行的实验方案(不必描述操作过程的细节): 。
资料:ⅰ.次氯酸会破坏酸碱指示剂;
ⅱ.次氯酸或氯气可被SO2、H2O2和FeCl2等物质还原成Cl-。
答案 (15分)(1)烧杯、漏斗、玻璃棒、胶头滴管(不填“胶头滴管”也可) (2)能
(3)①研究反应体系中硫酸浓度对反应产物的影响 ②硫酸浓度为0的对照实验 ③ClO3-+6I-+6H+ Cl-+3I2+3H2O
(4)因存在Cl2的重新溶解、HClO分解等,此方案无法测算试样含氯总量(或其他合理答案)
(5)量取一定量的试样,加入足量的H2O2溶液,加热除去过量的H2O2,冷却,再加入足量的硝酸银溶液,称量沉淀质量(或其他合理答案)
考点二 实验方案的设计与评价
4.(2016北京理综,10,6分)K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O 2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
结合实验, 下列说法不正确的是( )
A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O72-被C2H5OH还原
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.若向④中加入70% H2SO4溶液至过量,溶液变为橙色
答案 D
5.(2015安徽理综,12,6分)某同学将光亮的镁条放入盛有NH4Cl溶液的试管中,有大量气泡产生。为探究该反应原理,该同学做了以下实验并观察到相关现象,由此得出的结论不合理的是( )
选项
实验及现象
结论
A
将湿润的红色石蕊试纸放在试管口,试纸变蓝
反应中有NH3产生
B
收集产生的气体并点燃,火焰呈淡蓝色
反应中有H2产生
C
收集气体的同时测得溶液的pH为8.6
弱碱性溶液中Mg也可被氧化
D
将光亮的镁条放入pH为8.6的NaHCO3溶液中,有气泡产生
弱碱性溶液中OH-氧化了Mg
答案 D
6.(2018北京理综,28,16分)实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)
①A为氯气发生装置。A中反应方程式是 (锰被还原为Mn2+)。
②将除杂装置B补充完整并标明所用试剂。
③C中得到紫色固体和溶液。C中Cl2发生的反应有3Cl2+2Fe(OH)3+10KOH2K2FeO4+6KCl+8H2O,另外还有 。
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
方案Ⅰ
取少量a,滴加KSCN溶液至过量,溶液呈红色
方案Ⅱ
用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生
ⅰ.由方案Ⅰ中溶液变红可知a中含有 离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由 产生(用方程式表示)。
ⅱ.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是 。
②根据K2FeO4的制备实验得出:氧化性Cl2 FeO42-(填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO42-的氧化性强弱关系相反,原因是 。
③资料表明,酸性溶液中的氧化性FeO42->MnO4-,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色。该现象能否证明氧化性FeO42->MnO4-。若能,请说明理由;若不能,进一步设计实验方案。
理由或方案: 。
答案 (1)①2KMnO4+16HCl 2MnCl2+2KCl+5Cl2↑+8H2O
②
③Cl2+2OH-Cl-+ClO-+H2O
(2)①ⅰ.Fe3+ 4FeO42-+20H+4Fe3++3O2↑+10H2O
ⅱ.排除ClO-的干扰
②> 溶液酸碱性不同
③理由:FeO42-在过量酸的作用下完全转化为Fe3+和O2,溶液浅紫色一定是MnO4-的颜色
方案:向紫色溶液b中滴加过量稀H2SO4,观察溶液紫色快速褪去还是显浅紫色
C组 教师专用题组
考点一 物质的制备
1.(2013安徽理综,8,6分)实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
选项
a中的物质
b中的物质
c中收集的
气体
d中的物质
A
浓氨水
CaO
NH3
H2O
B
浓硫酸
Na2SO3
SO2
NaOH溶液
C
稀硝酸
Cu
NO2
H2O
D
浓盐酸
MnO2
Cl2
NaOH溶液
答案 B
2.(2013浙江理综,8,6分)下列说法正确的是( )
A.实验室从海带提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取
B.用乙醇和浓H2SO4制备乙烯时,可用水浴加热控制反应的温度
C.氯离子存在时,铝表面的氧化膜易被破坏,因此含盐腌制品不宜直接存放在铝制容器中
D.将(NH4)2SO4、CuSO4溶液分别加入蛋白质溶液,都出现沉淀,表明二者均可使蛋白质变性
答案 C
3.(2014大纲全国,29,15分)苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:
()2Cu+H2O
制备苯乙酸的装置示意图如下(加热和夹持装置等略):
已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250 mL三口瓶a中加入70 mL 70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是 。
(2)将a中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温到130 ℃继续反应。在装置中,仪器b的作用是 ;仪器c的名称是 ,其作用是 。反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是 。下列仪器中可用于分离苯乙酸粗品的是 (填标号)。
A.分液漏斗 B.漏斗 C.烧杯
D.直形冷凝管 E.玻璃棒
(3)提纯粗苯乙酸的方法是 ,最终得到44 g纯品,则苯乙酸的产率是 。
(4)用CuCl2·2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是 。
(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30 min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是 。
答案 (1)先加水、再加入浓硫酸(1分)
(2)滴加苯乙腈(1分) 球形冷凝管(1分) 回流(或使汽化的反应液冷凝)(1分) 便于苯乙酸析出(2分) BCE(全选对2分)
(3)重结晶(1分) 95%(2分)
(4)取少量洗涤液、加入稀硝酸、再加AgNO3溶液、无白色浑浊出现(2分)
(5)增大苯乙酸溶解度,便于充分反应(2分)
4.(2012课标,28,14分)溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
苯
溴
溴苯
密度/g·cm-3
0.88
3.10
1.50
沸点/℃
80
59
156
水中溶解度
微溶
微溶
微溶
按下列合成步骤回答问题:
(1)在a中加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL液态溴。向a中滴入几滴溴,有白色烟雾产生,是因为生成了 气体。继续滴加至液溴滴完。装置d的作用是 ;
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是 ;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是 ;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为 ,要进一步提纯,下列操作中必须的是 (填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是 (填入正确选项前的字母)。
A.25 mL B.50 mL C.250 mL D.500 mL
答案 (1)HBr 吸收HBr和Br2
(2)除去HBr和未反应的Br2 干燥
(3)苯 C
(4)B
考点二 实验方案的设计与评价
5.(2013课标Ⅱ,27,14分)氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌[含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:
工业ZnO浸出液 滤液 滤液 滤饼ZnO
提示:在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2。
回答下列问题:
(1)反应②中除掉的杂质离子是 ,发生反应的离子方程式为 ;在加高锰酸钾溶液前,若pH较低,对除杂的影响是 。
(2)反应③的反应类型为 ,过滤得到的滤渣中,除了过量的锌外还有 。
(3)反应④形成的沉淀要用水洗,检验沉淀是否洗涤干净的方法是 。
(4)反应④中产物的成分可能是ZnCO3·xZn(OH)2。取干燥后的滤饼11.2 g,煅烧后可得到产品8.1 g,则x等于 。
答案 (1)Fe2+和Mn2+(2分) MnO4-+3Fe2++7H2O 3Fe(OH)3↓+MnO2↓+5H+(2分)、
2MnO4-+3Mn2++2H2O 5MnO2↓+4H+(2分)
铁离子和锰离子不能生成沉淀,从而无法除去铁和锰杂质(2分)
(2)置换反应 镍(每空1分,共2分)
(3)取少量水洗液于试管中,滴入1~2滴稀硝酸,再滴入硝酸钡溶液,若无白色沉淀生成,则说明沉淀已经洗涤干净(2分)
(4)1(2分)
6.(2013安徽理综,28,14分)某酸性工业废水中含有K2Cr2O7。光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25 ℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表(表中不要留空格)。
实验
编号
初始pH
废水样品
体积/mL
草酸溶液
体积/mL
蒸馏水
体积/mL
①
4
60
10
30
②
5
60
10
30
③
5
60
测得实验①和②溶液中的Cr2O72-浓度随时间变化关系如图所示。
(2)上述反应后草酸被氧化为 (填化学式)。
(3)实验①和②的结果表明 ;实验①中0~t1时间段反应速率v(Cr3+)= mol·L-1·min-1(用代数式表示)。
(4)该课题组对铁明矾[Al2Fe(SO4)4·24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;
假设二: ;
假设三: ;
……
(5)请你设计实验验证上述假设一,完成下表中内容。
[除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4·Al2(SO4)3·24H2O、Al2(SO4)3等。溶液中Cr2O72-的浓度可用仪器测定]
实验方案(不要求写具体操作过程)
预期实验结果和结论
答案 (14分)(1)
实验
编号
初始
pH
废水样品
体积/mL
草酸溶液
体积/mL
蒸馏水
体积/mL
③
20
20
(2)CO2
(3)溶液pH对该反应的速率有影响 2(c0-c1)t1
(4)Al3+起催化作用 SO42-起催化作用
(5)
实验方案(不要求写具体操作过程)
预期实验结果和结论
用等物质的量K2SO4·Al2(SO4)3·24H2O代替实验①中的铁明矾,控制其他反应条件与实验①相同,进行对比实验。
反应进行相同时间后,若溶液中c(Cr2O72-)大于实验①中的c(Cr2O72-),则假设一成立;若两溶液中的c(Cr2O72-)相同,则假设一不成立。
(本题属于开放性试题,合理答案均可)
【三年模拟】
一、选择题(每小题6分,共30分)
1.(2018山东聊城三模,10)灼热的焦炭与水蒸气反应所得产物为H2、CO和少量CO2,为了检验产物中的H2和CO(假设气体均被充分吸收),设计如下实验装置。下列有关说法错误的是( )
A.为了实验安全,应先点燃①处酒精灯,后点燃④处酒精灯
B.②、③、⑤中依次盛装氢氧化钠溶液、浓硫酸和澄清石灰水
C.④中黑色固体变红色,即可证明产物中一定含有H2和CO中的一种或两种
D.若用碱石灰替换无水硫酸铜,也可以达到检验H2和CO的目的
答案 D
2.(2018山东K12联盟联考,9)由硫铁矿(主要成分:FeS2 和SiO2)为主要原料得到绿矾(FeSO4·7H2O)的流程如下:
下列说法不正确的是( )
A.过程1废气中含SO2
B.过程2试剂a 为稀硫酸
C.过程3的离子方程式为2Fe3++SO2+2H2O 2Fe2++SO42-+4H+
D.过程4将溶液加热到有较多固体析出,再用余热将液体蒸干,可得纯净绿矾
答案 D
3.(2017山东省实验中学一诊,3)下图是一套实验室制取气体的装置,用于制备、干燥和收集气体。下列各组物质中能利用这套装置进行实验的是( )
A.制取NO气体 B.制取二氧化碳气体
C.制取氢气 D.制取氨气
答案 B
4.(2018山东七校联合体二模,10)下列操作、现象与结论均正确的是( )
选项
操作
现象
结论
A
向FeCl3和KSCN混合溶液中,加入少量KCl的固体
溶液颜色变浅
FeCl3+3KSCN Fe(SCN)3+3KCl平衡向逆反应方向移动
B
向待测液中依次滴入氯水和KSCN溶液
溶液变为红色
待测液中含有Fe2+
C
向装有X溶液的试管中滴入浓NaOH溶液,将干燥红色石蕊试纸置于试管口
无明显现象
X溶液中无NH4+
D
乙醇和重铬酸钾溶液混合
橙色溶液变为绿色
乙醇具有还原性
答案 D
5.(2018山东潍坊一模,10)根据下列实验操作和现象得出的结论正确的是( )
选项
实验操作
现象
结论
A
将某溶液与稀盐酸反应产生的气体通入澄清石灰水
石灰水变浑浊
该溶液中一定含有CO32-
B
将浓硫酸与乙醇混合加热产生的气体通入酸性高锰酸钾溶液
溶液紫色褪去
该反应过程不一定生成乙烯
C
用洁净铂丝蘸取无色溶液进行焰色反应
火焰呈黄色
无色溶液为钠盐溶液
D
向KI溶液中加入淀粉,然后滴入少量稀硫酸
开始无明显现象,片刻后溶液变蓝
氧化性:H2SO4>I2
答案 B
二、非选择题(共70分)
6.(17分)(2018山东聊城一模,27)实验室制备三氯乙醛(CCl3CHO)的反应原理为C2H5OH+4Cl2 CCl3CHO+5HCl,发生的副反应为C2H5OH+HCl C2H5Cl+H2O。某探究小组模拟制备三氯乙醛的实验装置如图所示(夹持、加热装置均略去)。回答下列问题:
(1)装置A中发生反应的离子方程式为 。
(2)仪器b的名称是 ,其作用是 。
(3)若撤去装置B,对实验的影响是 。
(4)实验时发现D中导管口处冒出气泡速率过快,合理的解决方法是 。
(5)测定产品的纯度:
①称取0.40 g产品,配成待测溶液,加入20.00 mL 0.100 mol·L-1碘标准溶液,再加入适量碱液,充分反应:CCl3CHO+OH- CHCl3+HCOO-,HCOO-+I2 H++2I-+CO2↑;
②再加适量盐酸调节溶液的pH,并立即用0.020 mol·L-1的Na2S2O3溶液滴定至终点,发生反应:I2+2S2O32- 2I-+S4O62-;
③重复上述操作3次,平均消耗Na2S2O3溶液20.00 mL。
滴定时所用指示剂是 ,达到滴定终点的现象是 ,测得产品的纯度为 。
答案 (1)MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
(2)球形冷凝管 冷凝回流三氯乙醛和乙醇
(3)三氯乙醛的纯度变低
(4)停止对A加热或控制滴加盐酸的速率
(5)淀粉溶液 蓝色变为无色,且半分钟内不变色 66.375%(或66.38%、66.4%也可)
7.(17分)(2018山东七校联合体二模,26)氮化铝(AlN)是一种新型无机非金属材料。某AlN样品仅含有Al2O3杂质,为测定AlN的含量,设计如下两种实验方案。已知:AlN+NaOH+H2O NaAlO2+NH3↑
【方案1】取m g样品,用图1装置测定样品中AlN的纯度(夹持装置已略去)。
图1
(1)如图1,C装置中球形干燥管的作用是 。
(2)完成以下实验步骤:组装好实验装置,首先检查装置气密性,再加入实验药品。接下来的实验操作是 ,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是 。
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见: 。
【方案2】用图2装置测定m g样品中AlN的纯度(部分夹持装置已略去)。
图2
(4)为测定生成气体的体积,量气装置中的X液体可以是 (填字母序号)。
a.CCl4 b.H2O
c.NH4Cl溶液 d.C6H6(苯)
(5)若m g样品完全反应,测得生成气体的体积为V mL(已转换为标准状况),则AlN的质量分数是 。若将a处胶管用弹簧夹夹住,并把分液漏斗上口导管拔开,其他操作均同上,则最终测定的结果将 (填“偏大”“偏小”或“无影响”)。
答案 (1)防止倒吸 (2)关闭K1,打开K2 把装置中残留的氨气全部赶入C装置 (3)C装置出口处连接一个装有碱石灰的干燥管 (4)ad (5)41V22 400m×100% 偏大
8.(18分)(2018山东聊城二模,26)硫酸亚铁在工农业生产中具有广泛的应用。该物质不稳定,受热易分解产生氧化物,具有较强的还原性。
Ⅰ.某学习小组利用如下装置来探究FeSO4受热分解的产物。
(1)甲组同学利用“A接B接C”的装置来验证产物中含有SO2气体。
①连接好装置后,接下来的操作是 。
②仪器a 的名称是 ;其作用是 。
(2)乙组同学查阅资料得:硫酸亚铁分解的气体产物中除SO2 外还有SO3;SO3 的熔点为16.8 ℃,沸点是46.8 ℃,溶于水放出大量的热,易形成酸雾。为此设计了“A接D接C”的装置验证产物中含有SO3 。
①装置D中的现象是 ,BaCl2 溶液不能用Ba (NO3)2溶液代替的原因是 。
②装置A 中固体变为红棕色,结合两组同学的实验,写出硫酸亚铁分解的化学方程式: 。
③取硫酸亚铁样品18.20 g,加热分解至恒重时测得固体质量为11.00 g(假设杂质不反应),该硫酸亚铁样品的纯度为 % (保留小数点后两位,下同),样品中铁元素的质量分数为 %。
Ⅱ.用硫酸亚铁碱性试纸可检验食品中是否含有CN-,方案如下:
已知:蓝色染料普鲁士蓝的合成方法如下:
(3)若试纸变蓝则证明食品中含有CN-,基于普鲁士蓝的合成原理,请解释检测时试纸变蓝的原因: 。
答案 (1)①检验装置的气密性 ②长颈漏斗 平衡装置B中的压强(或“防堵塞”)
(2)①产生白色沉淀,在液面上有酸雾形成 SO2 通入BaCl2 溶液中无现象,SO2 通入Ba(NO3)2溶液中会产生白色的BaSO4沉淀,干扰SO3的检验
②2FeSO4 Fe2O3+SO3↑+SO2↑ ③83.52 30.77
(3)Fe2+和CN-反应生成[Fe(CN)6]4-, 同时Fe2+被空气中的O2 氧化生成Fe3+,Fe3+与[Fe(CN)6]4-反应生成蓝色沉淀Fe4[Fe(CN)6]3
9.(18分)(2017山东泰安二模,26)甲醛(HCHO)与葡萄糖相似具有还原性。为探究过量甲醛和新制Cu(OH)2反应的产物,进行如下研究。
(1)在下图装置中进行实验,向a中加入50 mL 0.5 mol·L-1 CuSO4溶液和100 mL 5 mol·L-1NaOH溶液,振荡,再加入50 mL 40%的甲醛溶液,缓慢加热20分钟后冷却至室温。
①仪器b的名称是 。
②能说明甲醛具有还原性的实验现象是 。
(2)上述实验有副反应发生,产生的气体为CO、H2中的一种或两种。为确认气体成分,将装置A和下图所示的装置连接后进行实验。
依次连接的合理顺序为A→B→ → → → →G,装置B的作用是 。证明有H2产生的实验现象是 。
(3)已知:。设计实验证明a中甲醛中的碳元素未被氧化成+4价。写出实验操作、现象、结论: 。
(4)反应后a中有红色固体产生,为研究其组成,进行如下实验(以下每步均充分反应):
已知:Cu2O [Cu(NH3)4]+(无色) [Cu(NH3)4]2+(蓝色)。
①锥形瓶ⅱ中固体完全溶解得深蓝色溶液的离子方程式为 。
②将容量瓶ⅱ中的溶液稀释100倍后,溶液的颜色与容量瓶ⅰ相近。由此可知固体产物的组成及物质的量之比约为 。
答案 (1)①球形冷凝管 ②a中出现砖红色物质
(2)E F D C 吸收甲醛蒸气,防止其干扰后续检验 F中黑色固体变红色,D中固体变蓝色
(3)取少量a中反应后的清液,滴入过量稀硫酸,未见气泡产生,说明甲醛中的碳元素未被氧化成+4价
(4)①2Cu+O2+8NH3·H2O 2[Cu(NH3)4]2++4OH-+6H2O ②n(Cu2O)∶n(Cu)=1∶200
相关文档
- 2020届高考化学一轮复习化学反应速2021-02-27 09:00:1318页
- 2021届(鲁科版)高考化学一轮复习化学2021-02-26 22:35:5115页
- 中考化学第一轮复习化学实验与探究2021-02-26 22:27:028页
- 2021届(鲁科版)高考化学一轮复习化学2021-02-26 22:26:0119页
- 2020版高考一轮复习化学通用版学案2021-02-26 22:17:329页
- 2020届高考化学一轮复习化学反应与2021-02-26 21:52:268页
- 2020届高考化学一轮复习化学反应进2021-02-26 21:39:5015页
- 2020版高考一轮复习化学通用版学案2021-02-26 21:39:0810页
- 2020年高考化学一轮复习化学反应速2021-02-26 21:36:198页
- 2020届高考化学一轮复习化学实验方2021-02-26 21:23:4612页