- 204.50 KB
- 2024-05-11 发布
长泰一中2016—2017学年第一学期期末考试
高二化学试题(理科)
相对原子质量:H-1 O-16 N-14 C-12
第Ⅰ卷(选择题,共50分)
一、 选择题(本大题有20小题,每小题只有一个选项符合题意,共50分)
1.下列反应属于吸热反应的是 ( )
A. C6H12O6(葡萄糖aq)+6O2 6CO2+6H2O B. CH3COOH+KOH CH3COOK+H2O
C. A+BC+D; △H<0 D.破坏生成物全部化学键所需能量小于破坏反应物全部化学键所需能量
2.一定温度下,可逆反应2NO2(g) 2NO(g)+O2(g)在体积固定的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2,同时生成2n mol NO2;②单位时间内生成n mol O2,同时生成2n mol NO;③用NO2、NO、O2的物质的量浓度变化表示反应速率比为2∶2∶1;④混合气体压强不再改变;⑤混合气体颜色不再改变;⑥混合气体的平均相对分子质量不再改变
A.①④⑤⑥ B.①②③⑤ C.②③④⑥ D.以上全部
3.下列叙述中正确的是 ( )
A.在稀溶液中1mol酸和1mol碱完全反应所放出的热量,叫做中和热
B.在101kPa时1mol物质燃烧时的反应热叫做该物质的标准燃烧热
C.热化学方程式中,各物质前的化学计量数不表示分子个数
D.如果反应物所具有的总能量小于生成物所具有的总能量,则发生的反应是放热反应。
4.在如图所示的装置中,a的金属性比氢要强,b为碳棒,关于此装置的各种叙述不正确的是
A.碳棒上有气体放出,溶液pH变大 B.a是正极,b是负极
C.导线中有电子流动,外电路中,电子从a极到b极
D.a极上发生了氧化反应
5.碰撞理论是一种较直观的反应速率理论,下列有关碰撞理论叙述正确的是 ( )
A.反应物分子碰撞能发生反应 B.发生有效碰撞的分子具有最高的能量
C.有效碰撞是活化分子在一定方向上的碰撞 D.活化分子的平均能量称之活化能
6.某反应2AB(g)C(g)+3D(g)在高温下能自发进行,其逆反应在低温下能自发进行,则该反应的ΔH、ΔS应为
A.ΔH<0,ΔS>0 B.ΔH<0,ΔS<0 C.ΔH>0,ΔS>0 D.ΔH>0,ΔS<0
7.在一定条件下,CO和CH4燃烧的热化学方程式分别为:
2CO(g)+O2(g)=2CO2(g), △H= -566kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l), △H= -890kJ·mol-1由1 mol CO和3 mol CH4组成的混和气在上述条件下完全燃烧时,释放的热量为 ( )
A.2912 kJ B.2953 kJ C.3236 kJ D.3867 kJ
8.在可逆反应中,平衡常数与反应进行的限度关系正确的是 ( )
A.K越大,反应程度越大 B.K越大,反应程度越小
C.K的大小与反应程度无关 D.K越大,反应可能变大,也可能变小
9.可以将反应.Zn+Br2=ZnBr2设计成蓄电池,下列4个反应 ①Br2+2e=2Br-②2Br--2e=Br2③Zn-2e=Zn2+④Zn2++2e=Zn其中表示充电时的阳极反应和放电时的负极反应的是( )
A.②和③ B.②和① C. ③和① D. ④和①
10、铁镍蓄电池又称爱迪生电池,放电时的总反应为Fe+Ni2O3+3H2O===Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是( )
A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe
B.电池放电时,负极反应为Fe+2OH--2e-===Fe(OH)2
C.电池充电过程中,阴极附近溶液的pH降低
D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-===Ni2O3+3H2O
11.对于在一密闭容器中进行的下列反应:C(s)+ O2(g) CO2(g)下列说法中错误的是
A.将木炭粉碎成粉末状可以加快化学反应速率 B.升高温度可以加快化学反应速率
C.增加压强可以加快化学反应速率 D.增加木炭的量可以加快化学反应速率
12.用石墨作电极电解CuSO4溶液。通电一段时间后,欲使电解液恢复到起始状态,应向溶液中加入适量的 ( )
A.CuSO4 B.Cu(OH)2 C.CuO D.CuSO4·5H2O
13.在一定温度下的定容密闭容器中,当下列物理量不再改变时,表明反应:A(s)+2B(g)=== C(g)+D(g)已达平衡的是 ( )
A.混合气体的压强 B.气体的总体积 C.混合气体的相对分子质量 D.气体的总物质的量
14.电解稀H2SO4、Cu(NO3)2、NaCl的混合液,最初一段时间阴极和阳极上分别析出的物质分别是
A.H2和Cl2 B.Cu和Cl2 C.H2和O2 D.Cu和O2
15.下列变化的熵变大于零的是 ( )
A.H2O(l) H2O(g) B.CO2(g) CO2(s)
C.NaOH(aq)+HCl(aq) = NaCl(aq)+H2O D.NH3(g)+HCl(g)=NH4Cl(s)
16.阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池反应为:2H2+O2=2H2O,电解液为KOH,反应保持在较高温度,使H2O蒸发,下列叙述正确的是 ( )
A.此电池能发出蓝色火焰
B.H2为正极,O2为负极
C.工作时,电解液的pH不断减小
D.电极反应为:负极2H2+4OH--4e-=4H2O;正极O2+2H2O+4e-=4OH-
17..将固体NH4I置于密闭容器中,在某温度下发生下列反应:
NH4I(固) NH3(g)+HI(g),2HI(g) H2(g)+I2(g),当达到平衡时 ,c(H2)=0.5mol/L,c(HI)=4mol/L,则NH3的浓度为 ( )
A.3.5mol/L B.4mol/L C.4.5mol/L D.5mol/L
18.下列叙述中不正确的是 ( )
A.镀锡的铁皮,破损后铁皮反而易被腐蚀 B.纯铁比生铁更易被腐蚀
C.金属的电化腐蚀比化学腐蚀普遍 D.金属腐蚀的本质是M-ne
=Mn+而被损耗
19.反应4NH3(气)+5O2(气) 4NO(气)+6H2O(气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率(X)(反应物的消耗速率或产物的生成速率)可表示为 ( )
A. (NH3) = 0.010 mol/(L·s) B. (O2) = 0.0010 mol/(L·s)
C. (NO) = 0.0010 mol/(L·s) D. (H2O) = 0.045 mol/(L·s)
20.在一密闭容器中,CO和H2O混合加热到800℃达到下列平衡:
CO(g)+H2O(g)CO2(g)+H2(g) ,K=1.0,若反应开始时CO和H2O的浓度分别为0.20mol/L和1.00mol/L,则CO转化为CO2的转化率为 ( )
A.80% B.83% C.75% D、91%
第Ⅱ卷(非选择题,共50分)
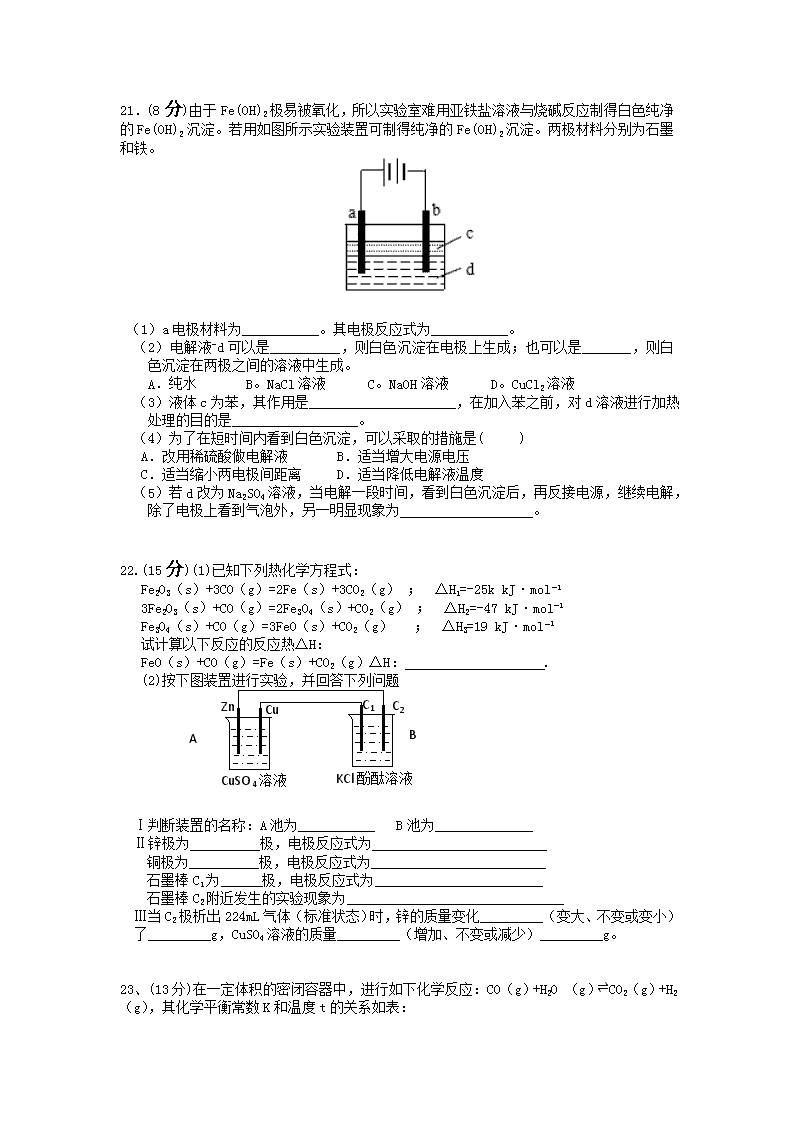
21.(8分)由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。若用如图所示实验装置可制得纯净的Fe(OH)2沉淀。两极材料分别为石墨和铁。
(1)a电极材料为___________。其电极反应式为___________。
(2)电解液-d可以是__________,则白色沉淀在电极上生成;也可以是_______,则白色沉淀在两极之间的溶液中生成。
A.纯水 B。NaCl溶液 C。NaOH溶液 D。CuCl2溶液
(3)液体c为苯,其作用是_____________________,在加入苯之前,对d溶液进行加热处理的目的是__________________。
(4)为了在短时间内看到白色沉淀,可以采取的措施是( )
A.改用稀硫酸做电解液 B.适当增大电源电压
C.适当缩小两电极间距离 D.适当降低电解液温度
(5)若d改为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接电源,继续电解,除了电极上看到气泡外,另一明显现象为___________________。
22.(15分)(1)已知下列热化学方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ; △H1=-25k kJ·mol-1
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ; △H2=-47 kJ·mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ; △H3=19 kJ·mol-1
试计算以下反应的反应热△H:
FeO(s)+CO(g)=Fe(s)+CO2(g)△H: .
(2)按下图装置进行实验,并回答下列问题
Zn
C2
Cu
C1
A
B
CuSO4溶液
KCl酚酞溶液
Ⅰ判断装置的名称:A池为___________ B池为______________
Ⅱ锌极为__________极,电极反应式为_________________________
铜极为__________极,电极反应式为_________________________
石墨棒C1为______极,电极反应式为________________________
石墨棒C2附近发生的实验现象为_______________________________
Ⅲ当C2极析出224mL气体(标准状态)时,锌的质量变化_________(变大、不变或变小)了_________g,CuSO4溶液的质量_________(增加、不变或减少)_________g。
23、(13分)在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O (g)⇌CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:
t℃
700
800
830
1000
1200
K
1.7
1.1
1.0
0.6
0.4
回答下列问题:
(1)该反应的化学平衡常数表达式为K= ,该反应为 反应(填吸热或放热).若改变条件使平衡向正反应方向移动,则平衡常数 (填序号)
①一定不变 ②一定减小 ③可能增大 ④增大、减小、不变皆有可能
(2)能判断该反应是否达到化学平衡状态的依据是 .
(a)容器中压强不变 (b)混合气体中c(CO)不变
(c)v逆(H2)=v正(H2O) (d)c(CO)=c(CO2)
(3)若在一密闭容器中,将一定量的CO与H2O混合加热到830℃下达到平衡。若反应开始时CO与H2O的浓度分别为0.200 mol·L–1和0.100 mol·L–1,平衡时CO的转化率 。
(4)甲醇是一种可再生能源,具有开发和应用的广阔前景,
已知反应2CH3OH(g)⇌CH3OCH3(g)+H2O(g),某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质
CH3OH
CH3OCH3
H2O
浓度/(mol•L﹣1)
0.44
0.6
0.6
判断该反应向 反应方向进行。
(5)生产液晶显示器的过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的12 000~20 000倍,在大气中的寿命可长达740年之久,以下是几种化学键的键能:
化学键
N≡N
F﹣F
N﹣F
键能/kJ•mol﹣1
941.7
154.8
283.0
则反应N2(g)+3F2(g)═2NF3(g)的△H=
24、(14分)在100℃时,将0.200mol的四氧化二氮气体充入2L真空的密闭容器中,每隔一定的时间对该容器内的物质进行分析,得到如表格:
0
2
4
6
8
10
c(N2O4)
0.100
c1
0.050
c3
a
b
c(NO2)
0.000
0.060
c2
0.120
0.120
0.120
试填空:
(1)该反应达到平衡时,四氧化二氮的转化率为 %,表中c2 c3、a b(填“>”、“<”或“=”).
(2)2min时四氧化二氮的浓度c1= mol/L,在0~2min时间段内,四氧化二氮的平均反应速率为 mol/(L•min).
(3)100℃时,该反应的平衡常数K= 。
(4)达到平衡后,升高温度,气颜色会变深,则升高温度后,反应2NO2(g)⇌N2O4(g)平衡常数将 (填“增大”、“减小”或“不变”).
(5)乙二醛(OHC—CHO)是一种重要的精细化工产品。
已知:OHC—CHO(g) +2H2(g) HOCH2CH2OH(g) △H=−78kJ·mol−1 K1
2H2(g) + O2(g) 2H2O(g) △H=−48①kJ·mol−1 K2
乙二醇气相氧化反应HOCH2CH2OH(g) +O2(g) OHC—CHO(g) + 2H2O(g)的△H= kJ·mol−1。相同温度下,该反应的化学平衡常数K= (用含K1、K2的代数式表示)。
学校 班级 姓名 座号 得分
请 勿 在 密 封 线 内 答 题
长泰一中2016—2017学年第一学期期末考试
高二化学试题(理科)答题卷
第Ⅱ卷(非选择题,共50分)
21. (8分)
(1)____ __。_______ ____。
(2)___ __, __ ____,
(3)_________ ____________, ______ _______。
(4) 。
(5) ___________________。
22.(15分)
(1)△H: .
(2) Ⅰ、A池为___________ B池为______________
Ⅱ、__________, _________________________
_________, ____________ _____________
______, _____ ___________
_______________ ________
Ⅲ、 , g, , g。
23、(13分)
(1)K= , ,
(2) 。
(3) 。
(4) 。
(5)△H=
24、(14分)
(1) %, 、 .
(2) , .
(3)K= 。
(4) .
(5)
△H= kJ·mol−1。K= 。