- 276.50 KB
- 2024-05-03 发布
2016-2017学年度上学期2015级
第五次双周练化学试卷(A)
命题人:金双娇 审题人:蔡艳
时长:90分钟 分数:100分 考试时间:2016年12月16日可能用到的相对原子质量:H 1 Li 7 C 12 N 14 O 16 Zn 65 Cu 64 Ag 108 Pb 207
第Ⅰ卷(选择题 共40分)
选择题(本题包括20小题,每小题2分,共40分,每小题只有一个选项符合题意)
1.已知吸热反应2CO(g) = 2C(s)+O2(g) ,设ΔH 和ΔS不随温度而变,下列说法中正确的是( )
A.低温下能自发进行 B.高温下能自发进行
C.任何温度下都能自发进行 D.任何温度下都不能自发进行
2.相同浓度的下列溶液中, c (CO32-)由大到小的关系为( )
①Na2CO3 ②NaHCO3 ③H2CO3 ④(NH4)2CO3 ⑤NH4HCO3
A.③①②④⑤ B.①④②⑤③ C.③①④②⑤ D.①④⑤②③
3.下列反应水解方程式正确的是( )
A.AlCl3+3H2O=Al(OH)3+3HCl B.碳酸氢钠溶液:HCO3-+H2OH2CO3+OH- C.Na2CO3+2H2OH2CO3+2NaOH D.NH4Cl溶于D2O中:NH4++D2ONH3·D2O+H+
4.在蒸发皿中加热蒸干并灼烧下列物质的溶液,可以得到该固体物质的是( )
A.KHCO3 B.AlCl3 C.Na2SO3 D.Fe2(SO4)3
5.下列有关金属腐蚀与保护的说法正确的是( )
A.常温下,断开K时,若M溶液为浓硫酸,则铁不发生化学腐蚀
B.关闭K,若M为氯化钠,则铁极的电极反应式为O2+4e-+2H2O=4OH-
C.关闭K,若M为硫酸铵,则石墨极的电极反应式为2H++2e-=H2↑
D.关闭K,若M溶液为海水,石墨换成铜或银,则叫外加电流的阴极保护法
6.下列说法正确的是( )
A.铅蓄电池在放电过程中,负极质量增加,正极质量也增加
B.电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属
C.在NH4HSO4溶液中由于NH4+的水解促进了水的电离,所以水的电离程度增大
D.在密闭容器中发生2SO2+O22SO3反应,增大压强,平衡会正向移动, 的值增大
7.被称为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边镀二氧化锰。在纸内的离子“流过”水和氧化锌组成的电解液。总反应的化学方程式为:Zn+2MnO2+H2O=Zn(OH)2+Mn2O3,下列说法错误的是( )
A.电池工作时,锌失去电子
B.外电路中每通过0.2 mol电子,消耗锌的质量为6.5 g
C.电池工作时,电子由正极通过外电路流向负极
D.电池正极的电极反应式为:2MnO2+H2O+2e-= Mn2O3+2OH-
8.电解CuSO4溶液时,要求达到三点(1)阳极质量减少;(2)阴极质量增加;(3)电解质溶液中c(Cu2+)不变,则可选用的电极是( )
A.纯铜作阳极,含Zn和Ag的铜合金作阴极 B.含Zn和Ag的铜合金作阳极,纯铜作阴极
C.用纯铁作阳极,纯铜作阴极 D.用石墨作阳极,纯铜作阴极
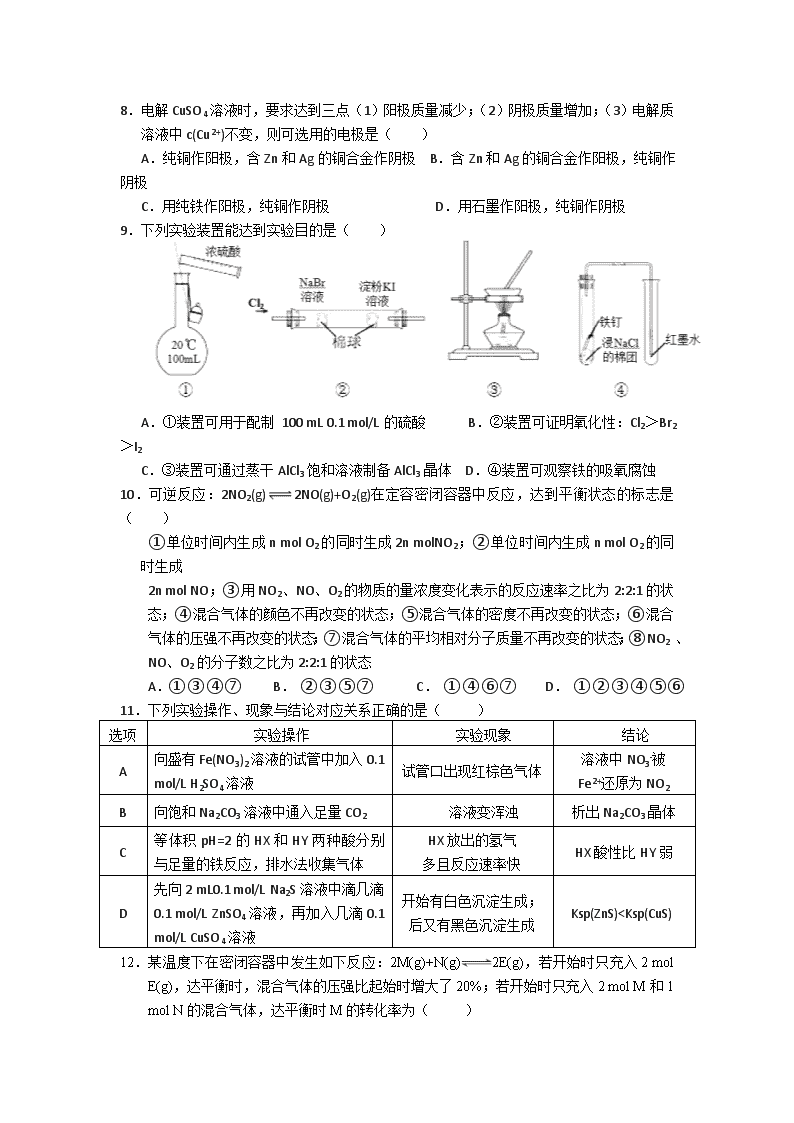
9.下列实验装置能达到实验目的是( )
A.①装置可用于配制 100 mL 0.1 mol/L的硫酸 B.②装置可证明氧化性:Cl2>Br2>I2
C.③装置可通过蒸干AlCl3饱和溶液制备AlCl3晶体 D.④装置可观察铁的吸氧腐蚀
10.可逆反应:2NO2(g)2NO(g)+O2(g)在定容密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n molNO2;②单位时间内生成n mol O2的同时生成
2n mol NO;③用NO2、NO、O2的物质的量浓度变化表示的反应速率之比为2:2:1的状态;④混合气体的颜色不再改变的状态;⑤混合气体的密度不再改变的状态;⑥混合气体的压强不再改变的状态;⑦混合气体的平均相对分子质量不再改变的状态;⑧NO2 、NO、O2的分子数之比为2:2:1的状态
A.①③④⑦ B. ②③⑤⑦ C. ①④⑥⑦ D. ①②③④⑤⑥
11.下列实验操作、现象与结论对应关系正确的是( )
选项
实验操作
实验现象
结论
A
向盛有Fe(NO3)2溶液的试管中加入0.1 mol/L H2SO4溶液
试管口出现红棕色气体
溶液中NO3-被
Fe2+还原为NO2
B
向饱和Na2CO3溶液中通入足量CO2
溶液变浑浊
析出Na2CO3晶体
C
等体积pH=2的HX和HY两种酸分别与足量的铁反应,排水法收集气体
HX放出的氢气
多且反应速率快
HX酸性比HY弱
D
先向2 mL0.1 mol/L Na2S溶液中滴几滴0.1 mol/L ZnSO4溶液,再加入几滴0.1 mol/L CuSO4溶液
开始有白色沉淀生成;后又有黑色沉淀生成
Ksp(ZnS)S(PbS)>S(CuS)
D.若溶液中c(Cu2+)=1×10-10 mol·L-1,则S2-已完全转化成CuS
18.有关下列图像的分析错误的是( )
A.图①表示对平衡N2(g)+3H2(g)2NH3(g)加压时的速率变化
B.图②中a、b曲线只可表示反应H2(g)+I2(g)2HI(g)在有催化剂和无催化剂存在下建立平衡的过程
C.图③表示室温下将各1 mL pH=2的HA、HB两种酸溶液加水稀释的情况。若2A>C(2分)
(2)① a(1分);CH4+10OH--8e- =CO32-+7H2O(2分)
22.(10分)(1) (2分);< (2分)
(2)C(2分)
(3)0.24 mol/(L·min)(2分);60%(2分)
23.(10分)(1)酚酞(1分);甲基橙(1分)
(2)V1=V2(1分);V1<V2(1分)
(3)①0.1448(2分);②无色变粉红色且半分钟内不变色(2分);③ ADE(2分)
24.(10分)(1)① A(2分);② BC(2分);
(2)① X﹣+H2OHX+OH﹣(2分);② c(2分);
(3)<(2分);
25.(10分)(1)C(1分)
(2)CuO[或Cu(OH)2或CuCO3或Cu2(OH)2CO3] (1分)
(3)Fe3++3H2OFe(OH)3+3H+(2分),
CuO+2H+=Cu2++H2O[或Cu(OH)2+2H+=Cu2++2H2O](2分)
(4)将Fe2+氧化为Fe3+,便于生成沉淀而与Cu2+分离(2分)
(5)应在HCl气流中加热蒸发(2分)
26.(10分)(1)负(1分);Cu2++2e-=Cu(2分);A(1分)
(2)①用湿润的淀粉KI试纸靠近B极试管口,若观察到试纸变蓝,则有氯气生成(2分);
②0.01(1分);0.03(1分);4OH-4e-=O2↑+2H2O(2分)