- 321.05 KB
- 2024-01-22 发布
一、选择题
1.下列对“摩尔(mol)”的叙述不正确的是( )
A.摩尔是一个单位,用于计量物质所含微观粒子的多少
B.摩尔既能用来计量纯净物,又能用来计量混合物
C.1 mol 任何气体所含的气体分子数目都相等
D.用“摩尔”(而不用“个”)计量微观粒子与用“纳米”(而不用“米”)计量原子直径,计
量思路都是扩大单位
2.某硫原子的质量是 a g,12C 原子的质量是 b g,若 NA 只表示阿伏加德罗常数的数值,则下
列说法中正确的是( )
①该硫原子的相对原子质量为12a
b ②m g 该硫原子的物质的量为 m
aNA
mol③该硫原子的摩尔
质量是 aNA g④a g 该硫原子所含的电子数为 16NA
A.①③ B.②④ C.①② D.②③
3.(2010·广东高考)设 nA 为阿伏加德罗常数的数值,下列说法正确的是( )
A.16 g CH4 中含有 4nA 个 C—H 键 B.1 mol·L-1NaCl 溶液含有 nA 个 Na+
C.1 mol Cu 和足量稀硝酸反应产生 nA 个 NO 分子
D.常温常压下,22.4 L CO2 中含有 nA 个 CO2 分子
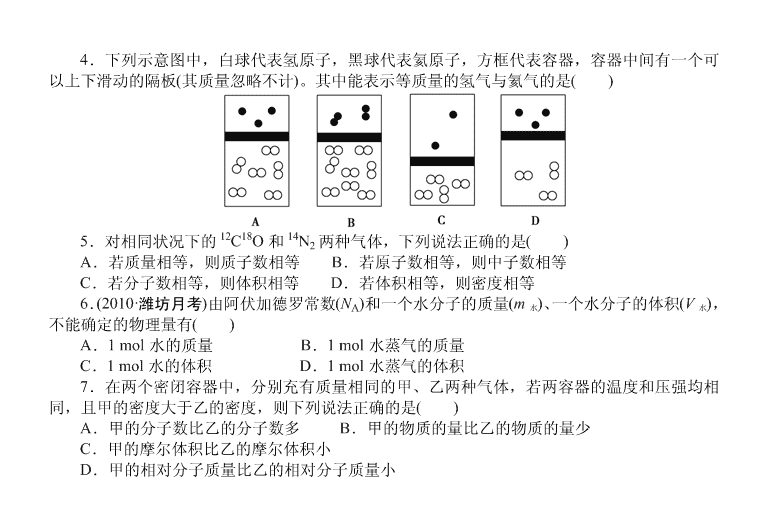
4.下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可
以上下滑动的隔板(其质量忽略不计)。其中能表示等质量的氢气与氦气的是( )
5.对相同状况下的 12C18O 和 14N2 两种气体,下列说法正确的是( )
A.若质量相等,则质子数相等 B.若原子数相等,则中子数相等
C.若分子数相等,则体积相等 D.若体积相等,则密度相等
6.(2010·潍坊月考)由阿伏加德罗常数(NA)和一个水分子的质量(m 水)、一个水分子的体积(V 水),
不能确定的物理量有( )
A.1 mol 水的质量 B.1 mol 水蒸气的质量
C.1 mol 水的体积 D.1 mol 水蒸气的体积
7.在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相
同,且甲的密度大于乙的密度,则下列说法正确的是( )
A.甲的分子数比乙的分子数多 B.甲的物质的量比乙的物质的量少
C.甲的摩尔体积比乙的摩尔体积小
D.甲的相对分子质量比乙的相对分子质量小
8.(2010·潍坊模拟)NA 代表阿伏加德罗常数,下列说法正确的是( )
A.同温同压下,相同体积的任何气体单质所含的原子数目相同
B.1 mol 过氧化钠中阴离子所带的负电荷数为 2NA
C.常温常压下,11.2 L 氮气所含的原子数目为 NA
D.某温度时,pH=6 的纯水中,含 10-6NA 个 OH-
9.(2011·杭州模拟)镁与铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与
时间(t)关系如图。反应中镁和铝的( )
A.物质的量之比为 3∶2 B.质量之比为 3∶2
C.摩尔质量之比为 2∶3 D.反应速率之比为 2∶3
10.(2010·潍坊质检)标准状况下,a L 气体 X2 和 b L 气体 Y2 恰好完全反应生成 c L 气体 Z,
若 2a=6b=3c,则 Z 的化学式为( )
A.XY2 B.X2Y C.X3Y D.XY3
二、非选择题
11.(1)0.2 mol NH3 分子中所含氢原子数与________个 H2O 分子中所含氢原子数相等。
(2)含 0.4 mol Al3+的 Al2(SO4)3 中所含的 SO2-
4 的物质的量是________。
(3)已知 16 g A 和 20 g B 恰好完全反应生成 0.04 mol C 和 31.76 g D,则 C 的摩尔质量为
________。
12.(1)2 mol O3 与 3 mol O2 的质量之比________,分子数之比________,同温同压下的密度
之比________,含氧原子数之比________,体积之比________。
(2)O3 与 Cl2 具有相似的性质,均可用于自来水的消毒。已知二者在消毒时均被还原为最低价
态,则相同状况下 10 L O3 与________ L Cl2 的消毒能力相当。
(3)气体化合物 A 分子式可表示为 OxFy,已知同温同压下 10 mL A 受热分解生成 15 mL O2 和
10 mL F2,则 A 的化学式为_____________。
13.(1)2.3 g Na 中含电子的物质的量为________mol,在跟足量水反应中失去电子的物质的量
为________mol。
(2)如果 a g 某气体中含有的分子数为 b,则 c g 该气体在标准状况下的体积是(设 NA 为阿伏加
德罗常数)________ _______。
14.(2011·原创题)在标准状况下,2.8 g CO 和 8.8 g CO2 的混合气体。
(1)混合气体的总物质的量为________。
(2)混合气体的摩尔质量为________,平均相对分子质量为________。
答案及解析
1.【解析】 本题考查用“摩尔(mol)”的意义。“摩尔”(而不用“个”)计量微观粒子与用
“纳米”(而不用“米”)计量原子直径,计量思路不一样,用“纳米”(而不用“米”)是缩小单位。
【答案】 D
2.【解析】 本题考查基本物理量的基本计算。
②项中 m g S 的个数为m
a,则 n(S)= m
aNA
mol
③项中单位为 g/mol
④a g S 原子恰好为一个硫原子,电子数为 16。【答案】 C
3.【解析】 本题借助阿伏加德罗常数考查宏观量与微观量的关系。A 项,1 mol CH4 中有 4 mol
C—H 键;B 项,没有给出 NaCl 溶液的体积;C 项,1 mol Cu 与足量稀硝酸反应产生2
3nA 个 NO
分子;D 项,CO2 气体的体积不是在标准状况下的体积。【答案】 A
4.【解析】 本题考查阿伏加德罗定律及质量、物质的量、体积的关系。等质量的 He 与 H2
的物质的量之比为 1∶2,则 H2 的体积是 He 的 2 倍,H2 的分子个数是 He 的 2 倍,且氢气为双原
子分子,而 He 为单原子分子。【答案】 A
5.【解析】 相同物质的量的 12C18O 和 14N2 的质子数相同,但二者的摩尔质量不同,故相等
质量的 12C18O 与 14N2 所含的质子数不相等。若二者原子数相等,则分子数相同,二者的质子数相
等,但中子数前者大于后者。相同状况下,若二者的分子数相等,则体积相同,但二者的密度前
者大于后者。【答案】 C
6.【解析】 本题考查以物质的量为核心的计算。A、B 选项中,1 mol 水或水蒸气的质量都
为 m 水 NA;C 选项中,水分子间距离和水分子大小相比可以忽略,1 mol 水的体积为 NAV 水;D 选
项中,水蒸气分子间距离比分子直径大得多,即水蒸气的体积主要决定于水蒸气分子间距离,仅
由题给条件不能确定 1 mol 水蒸气的体积。【答案】 D
7.【解析】
乙
【答案】 B
8.【解析】 A 项,同温同压下,相同体积的任何气体单质所含的分子数目相同,原子数目
与分子的组成有关,气体单质有些是单原子分子(如稀有气体),有些是双原子分子(如 H2、Cl2 等),
有的还是多原子分子(如 O3)。B 项,1 mol 过氧化钠中含有 2 mol Na+和 1 mol O2-
2 ,1 mol O2-
2 所带
的负电荷数为 2NA,故 B 正确。C 项,11.2 L 氮气在常温常压下其物质的量不是 0.5 mol,所含的
原子数目自然不是 NA。D 项,OH-数目与水的体积有关。【答案】 B
9.【解析】 由图可知生成 H2 的体积相同,由关系式 Mg~H2 ↑和2
3Al~H2↑知nMg
nAl =1
2
3
=3
2,
mMg
mAl =3×24
2×27=4
3,故 A 正确,B 错误;MMg
MAl =24
27=8
9,C 错误;Mg 反应速率大于 Al 反应速
率,D 错误。【答案】 A
10.【解析】 由V1
V2
=n1
n2
知 3X2+Y2===2XmYn,即 m=3,n=1。【答案】 C
11.【解析】 (1)0.2 mol NH3 含 0.6 mol 氢原子,则水的物质的量为 0.3 mol,故 N(H2O)=0.3
mol×6.02×1023mol-1=1.806×1023。
(2)Al3+与 SO2-
4 的物质的量之比为 2∶3,则 SO2-
4 的物质的量为 0.6 mol。
(3)生成 C 的质量为 16 g+20 g-31.76 g=4.24 g,则 C 的摩尔质量为 4.24 g
0.04 mol=106 g/mol。
【答案】 (1)1.806×1023 (2)0.6 mol (3)106 g/mol
12.【解析】 (1)本题考查的是物质的量的应用,根据物质的量与其他量的关系把物质的量转
化成要求的量,还考查了阿伏加德罗定律的运用,运用时注意所给的条件。
(2)此过程为氧化还原反应,用 O3 与 Cl2 消毒后分别转化为 O-2、C l-1,若设 Cl2 的体积为 x L,
根据氧化还原反应过程中化合价升降总数相等,则 10 L×3×[0-(-2)]=x L×2×[0-(-1)],解
得 x=30。
(3)根据质量守恒定律和阿伏加德罗定律,写出分解反应的化学方程式为 2OxFy=====△ 3O2+
2F2,则 A 的化学式为 O3F2。
【答案】 (1)1∶1 2∶3 3∶2 1∶1 2∶3 (2)30 (3)O3F2
13.【解析】 (1)n(Na)= 2.3 g
23 g·mol-1=0.1 mol,
n(e-)=n(Na)×11=1.1 mol,
n(失 e-)=n(Na)×1=0.1 mol。
(2)同温同压下,气体的物质的量与分子数成正比,
则
a
M气
c
M气
=b
N,N=bc
a ,那么 c g 该气体在标准状况下的体积
为:bc
a ÷NA×22.4 L=22.4bc
aNA
L。
【答案】 (1)1.1 0.1 (2)22.4bc
aNA
L
14.【解析】 (1)n(CO)= 2.8 g
28 g·mol-1=0.1 mol,
n(CO2)= 8.8 g
44 g·mol-1=0.2 mol,
n(总)=0.1 mol+0.2 mol=0.3 mol。
(2) M =2.8 g+8.8 g
0.3 mol =38.7 g/mol,
平均相对分子质量为 38.7。
【答案】 (1)0.3 mol (2)38.7 g/mol 38.7