- 128.50 KB
- 2023-11-15 发布
物质的量在化学方程式计算中的应用
【学习目标】
1、掌握物质的量、物质的量浓度、气体摩尔体积应用于化学方程式的计算方法和格式;
2、加深对物质的量、物质的量浓度、气体摩尔体积等概念的理解以及对化学反应规律的认识。
【要点梳理】
要点一、化学计量数
在化学反应中各反应物按一定微粒数比相互转化为一定微粒数的生成物。各反应物和各生成物微粒个数的最简整数比称之为各物质的化学反应计量数。化学计量数既表示各物质参加化学反应的微粒个数,也表示宏观可度量物质的量之比。它比以前称之为方程式中各物质系数的提法更确切、更科学。
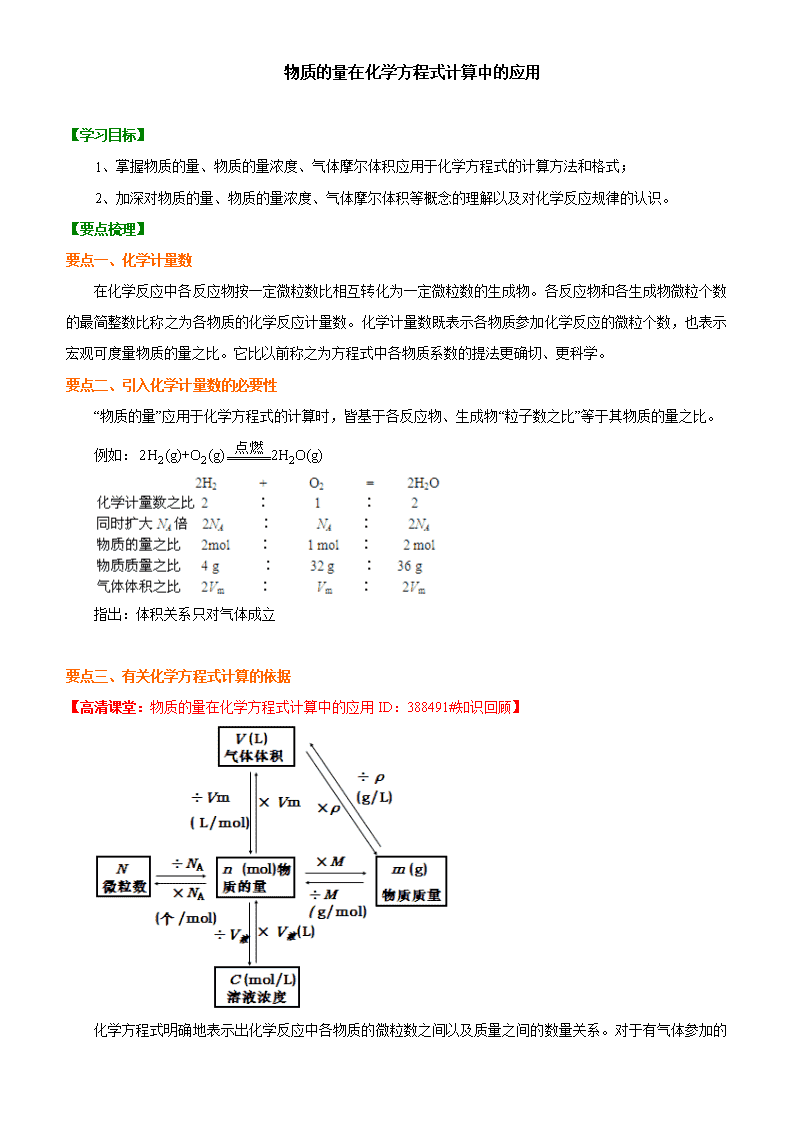
要点二、引入化学计量数的必要性
“物质的量”应用于化学方程式的计算时,皆基于各反应物、生成物“粒子数之比”等于其物质的量之比。
例如:
指出:体积关系只对气体成立
要点三、有关化学方程式计算的依据
【高清课堂:物质的量在化学方程式计算中的应用ID:388491#知识回顾】
化学方程式明确地表示出化学反应中各物质的微粒数之间以及质量之间的数量关系。对于有气体参加的反应,其气态物质在同温同压下也有确定的体积关系,总结起来有如下规律:
(1)相互作用的物质的微粒数之比等于方程式中各物质化学计量数之比。
(2)相互作用的各物质的物质的量之比等于方程式中各物质化学计量数之比。
(3)相互作用的气态物质,同温同压下的体积之比等于化学方程式中各气态物质化学计量数之比。
(4)相互作用物质的质量之比等于方程式中各物质化学计量数和该物质的相对分子质量乘积之比。
以上四种基本关系在化学计算中会经常用到。
要点四、计算要求
(1)根据化学方程式进行计算时,已知物质的其他物理量一般可换算成物质的量,再根据化学方程式中的化学计量数之比等于物质的量之比,列比例求解。
(2)解题过程中注意:
①各种符号的书写要规范,大写字母与小写字母的意义各不相同。如“M”表示摩尔质量,而“m”表示质量;“N”表示微粒数,而“n”表示物质的量。
②设未知数直接用各物理量的符号表示,且要注明物质(或粒子)的符号。如设参加反应盐酸溶液的体积为V[HCl(aq)]。
③各物理量及单位、物质的名称、公式等尽量用符号表示。如已知NaOH溶液的体积和物质的量浓度,求NaOH溶液的质量时就写成:
m(NaOH)=c(NaOH)×V[NaOH(aq)]×M(NaOH)
要点五、解题步骤
(1)设未知数。设出的未知数直接用各物理量的符号表示,如设参加反应的NaOH溶液的体积为V [NaOH (aq)],并且不带单位。同时应合理利用化学方程式中的横向和纵向联系,使运算简便。
(2)写出有关化学方程式,并注意隐含条件。在化学方程式相关物质下面注明相应的关系量,比较复杂的数量关系可先化简。
(3)建立未知量和已知量之间的数量关系,可以是等式也可以是不等式。把已知量代入计算式中,计算时都要带单位(已知量带单位,未知量不带单位)。
(4)运用数学工具选取容易解决的突破口求解,并写出答案。
解题关键:①准确把握反应内涵(包括显性与隐含的反应),正确书写化学方程式或离子方程式。
②化学方程式所表示的是纯净物之间的量的关系,因此不纯物质必须换算成纯净物的量再进行计算。
③在所列比例式中,同一物质上下单位要一致,不同物质左右单位要对应。
④规范用语
n (H2SO4)——表示H2SO4的物质的量
v (NaOH)——表示化学方程式中NaOH的化学计量数
c (HCl)——表示盐酸的物质的量浓度
V [NaCl (aq)]——表示NaCl溶液的体积
V (H2)——表示H2的体积
w (MnO2)——表示混合物中MnO2的质量分数
m (H2O)——表示H2O的质量
在列比例式及运算过程中都应带单位。
化学方程式的计算题型较多。在熟悉基本题型与常规解法的同时要注意积累解题的思维方法和技巧。
【典型例题】
类型一、反应物中有一种过量的计算:
例1实验室将30 g含MnO2质量分数为76.6%的软锰矿石与90.0 mL 12 mol·L-1浓盐酸共热,计算在标准状况下可生成Cl2多少升?
【思路点拨】在做题时应该认识到二氧化锰与浓盐酸反应制氯气时浓盐酸是过量的,利用方程式进行计算时应选择二氧化锰的量作为标准。
【答案】5.8L。
【解析】
n(HCl)=0.09L×12mol·L-1=1.08mol
举一反三:
【高清课堂:物质的量在化学方程式计算中的应用ID:388491#例题1】
【变式1】将6.5g Zn放入足量盐酸中,Zn完全反应。计算:
(1)6.5 g Zn的物质的量;
(2)参加反应的HCl的物质的量;
(3)生成H2的体积(标准状况)。
【答案】
(1)6.5 g Zn的物质的量为0.1mol;
(2)参加反应的HCl的物质的量0.2mol;
(3)生成H2的体积(标准状况)为2.24L。
【解析】 (1)6.5 g Zn的物质的量为;
由题意知HCl过量
类型二、两量差列比例解计算题
例2 将5.29gNaCl和NaBr的混合物溶于水后通入足量的Cl2使之充分反应,再将反应后溶液加热蒸干、灼烧,得到残渣质量4.40g。计算原混合物中NaCl、NaBr的质量。
【思路点拨】该题只给出了处理前后混合物的质量,且质量变化了,找出质量变化的原因,利用差量法解题。
【答案】原混合物中NaCl的质量为3. 23g,原混合物中NaBr的质量为2.06g。
【解析】由于NaCl不参与反应,故引起固体物质质量减少的原因是NaBr转化为NaCl
设原混合物中NaBr的质量为m(NaBr)
解得:m(NaBr)=2.06 g。
原混合物中NaCl的质量为:5.29-2.06g=3. 23g。
【总结升华】当某一反应有气体参加或有气体生成,且同一条件下反应方程式前后气体物质的化学计量数不相等时,反应前后的总体积存在差量;当反应物或生成物部分为固体、部分为气体时,反应体系中固体物质总质量在反应前后存在差量。即可用两量差列比例求解。
例3把一块表面已部分被氧化的钠0.77 g放入10 g水中,得到标准状况下氢气224 mL。求
(1)若将金属钠表面的氧化物均视为氧化钠,试求该氧化钠的质量。
(2)所得溶液中溶质的质量分数和该溶液的物质的量浓度(溶液的密度为d g·cm-3)。
【思路点拨】做问题(1)时弄清楚氢气是由钠和水反应生成的,根据氢气的量求金属钠的质量,进而求氧化钠的质量;做问题(2)还需利用氧化钠与水反应的方程式,理清谁是溶质、溶液的质量怎么变化。
【答案】(1)0.31 g (2)11.16%,2.79d mol·L―1
【解析】(1)设金属钠质量为x,与水反应生成NaOH的质量为y。
列比例式后解得 x=0.46 g,y=0.8 g,
由此可得m (Na2O)=0.77 g-0.46 g=0.31 g。
(2)设0.31 g Na2O与水反应生成NaOH的质量为z。
列比例式后解得 z=0.4 g,
NaOH的质量分数为:
,
c (NaOH)×40 g·mol-1=11.16%×1000d g·L―1,
c (NaOH)=2.79d mol·L―1。
【总结升华】一般思路:分析题目:已知条件是什么?求什么?将哪几种物质的物理量直接应用于化学方程式计算合理且最佳?然后将所求物质直接用物理量符号表示。解题格式和过程要规范,养成用物质的量来解题的习惯。
【高清课堂:物质的量在化学方程式计算中的应用ID:388491# 混合物计算——图像题】
举一反三:
【变式1】现有一种Na2CO3和NaHCO3的混合物,某同学为测定其含量,取一定量的该样品溶于水,逐滴加入稀盐酸并不断振荡,首先发生反应:Na2CO3 + HCl = NaHCO3 + NaCl,然后才发生反应:NaHCO3+ HCl = NaCl + CO2↑+ H2O。
已知:该温度下CO2密度为1.98g/L,实验测得产生的CO2体积的与加入稀盐酸的数据如下图。
(1)当加入 g盐酸时,才开始产生CO2; 图中V= mL。
(2)请计算:
①所加入盐酸中HCl的质量分数为多少?
②原样品中Na2CO3和NaHCO3的质量各是多少?(百分数精确到0.1%,质量精确到0.01g)
【答案】
(1)5,444;
(2)①所加入盐酸中HCl的质量分数为7.4%;
②原样品中Na2CO3的质量为1.06g,NaHCO3的质量为1.26g。
【巩固练习】
一、选择题
1.等质量的镁和铝分别与足量稀硫酸反应,在相同条件下产生氢气的体积比为( )。
A.1∶2 B.2∶3 C.3∶4 D.8∶9
2.不同体积的相同物质的量浓度的KCl,CaCl2,FeCl3溶液分别用VmL 1 mol /L的AgNO3溶液与之反应,都可使Cl-离子恰好完全沉淀,则上述三种溶液的体积比是( )。
A.1∶2∶3 B.3∶2∶1 C.6∶3∶2 D.2∶3∶6
3.200mL 0.3 mol /L的硫酸和 100mL 0.6 mol /L的硫酸混合,所得溶液的H+的物质的量浓度是( )。
A.0.4 mol /L B.0.8 mol /L C.0.45 mol /L D.0.9 mol /L
4.完全中和24.6 g二元酸H2A,消耗烧碱24g,则H2A的相对分子质量是( )。
A.42 B.82 C.162 D.84
5.将钠、铁、镁、铝各取0.1mol,分别投入足量的稀H2SO4中,充分反应后,放出的气体( )。
A.钠最多 B.一样多 C.铁最多 D.铝最多
6.能完全中和20 mL 1 mol /L NaOH溶液生成正盐的溶液是( )。
A.40 mL 0.1 mol /L盐酸 B.20 mL1 mol /L硫酸溶液
C.10 mL 1 mol /L硫酸溶液 D.5mL 1 mol /L磷酸溶液
7.用铝箔包住0.1 mol金属钠,用针扎一些小孔,放入水中,完全反应后,用排水集气法收集产生的气体,则收集到的气体体积(标准状况)为( )。
A.2.24 L B.1.12 L C.大于1.12 L D.小于1.12 L
8.若1.8 g某金属跟足量盐酸充分反应,放出2.24 L(标准状况)氢气,则该金属是( )。
A.Al B.Mg C.Fe D.Zn
9.金属Ti(钛)是一种具有许多优良性能的较为昂贵的金属,钛和钛合金被认为是21世纪的重要金属材料。某化学兴趣小组在实验室中探究Ti、Mg、Cu的活动性顺序。他们在相同温度下,取大小相同的三种金属薄片,分别投入等体积、等浓度的足量稀盐酸中,观察现象如下:
金属
Ti
Mg
Cu
金属表面现象
放出气泡 速率缓慢
放出气泡 速率快
无变化
下列有关三种金属的说法正确的是( )。
A.三种金属的活动性由强到弱的顺序是Ti、Mg、Cu
B.若钛粉中混有Mg,提纯Ti时可用稀盐酸除去Mg
C.用Ti从CuSO4溶液中置换出Cu是工业制取Cu的很好途径
D.Cu和MgCl2溶液不发生化学反应
10.把足量的铁粉投入到溶解有硫酸和硫酸铜的溶液中,充分反应后,剩余金属粉末的质量与原加入铁粉的质量相等,则原溶液中H+与SO42-的物质的量浓度之比为( )。
A.1∶4 B.2∶7 C.1∶2 D.3∶8
11.物质在相互反应时( )。
A.它们的质量一定相等
B.它们的物质的量一定相等
C.它们的质量比等于方程式中化学计量数之比
D.它们的物质的量之比等于方程式中化学计量数之比
12.钾(K)与钠(Na)在性质上具有很大的相似性,但K比Na的活泼性强,下面是根据Na的性质对K的性质的预测,其中正确的是( )。
A.K的活泼性强,所以钾应该保存在煤油中
B.K可被空气中的氧气氧化,且氧化产物在常温和加热条件下均为K2O
C.K与水能够反应,但不如Na与水的反应剧烈,但产物都有氢气
D.K可以与水剧烈反应,生成氢气
二、填空题
1.在25℃,101kPa条件下,将15 L O2通入10 L CO和H2的混合气中,使其完全燃烧,干燥后,恢复至原来的温度和压强。
(1)若剩余气体的体积是15L,则原CO和H2的混合气中V(CO)= L, V(H2)= L。
(2)若剩余气体的体积为aL,则a的取值范围是 。
(3)若剩余气体的体积为a L,则原CO和H2的混合气中V(CO)︰V(H2)= 。
A
B
D
C
通入Cl2并点燃
④
通入少量CO2
②
放入水中
①
放入盐酸中
③
2.物质A是由A元素组成的单质,将其在酒精灯火焰上灼烧,火焰为黄色,B、C、D是含有A元素的三种不同化合物,A、B、C、D按右图所示关系进行转化:
(1)写出下列物质的化学式:
A________;B________;C________;D________。
(2)写出①②③的离子方程式及④的化学方程式:
①________________,②________________,
③________________,④________________。
3.(1)分别取W g钠、镁、铝与足量的盐酸反应,在相同条件下产生氢气的体积比是________。
(2)分别取0.1 mol钠、镁、铝与足量的盐酸反应,在相同条件下产生氢气的体积比是________。
(3)若产生相同物质的量的氢气,所需钠、镁、铝的质量比为________。
(4)若产生相同体积(同温同压下)的氢气,所需钠、镁、铝的物质的量比为________。
(5)若将0.2 mol钠、镁、铝分别投入到10 mL 1 mol·L-1的盐酸中,在标准状况下,产生氢气体积的大小顺序是________。
【参考答案与解析】
一、选择题
1.C
2.C
3.B
4.B
5.D
【解析】由钠、铁、镁、铝分别与稀H2SO4的反应的化学方程式可知,当金属的物质的量相同时,铝与稀硫酸反应放出的气体最多。
6.C
【解析】根据化学反应方程式,物质的量之比应该满足化学方程式计量系数之比。
7.C
【解析】Na与H2O反应生成NaOH和H2,Al与NaOH溶液反应也产生H2。
8.A
【解析】解决本题的难点在于该金属的价态不明确,若知道该金属的价态,由H2的物质的量便可得该金属的物质的量,从而得摩尔质量,最终得该金属的相对原子质量,便可解决问题,由此我们假设金属为R,化合价分别为+1价、+2价、+3价,当化合价为+1价,M (R)=9 g·mol―1;当化合价为+2价时,M (R)=
18 g·mol―1;当化合价为+3价时,M (R)=27 g·mol―1,综合考虑,只有当化合价为+3价,R为Al时合适,故选A。
9.D
【解析】活动性顺序为:Mg>Ti>Cu;Mg、Ti与盐酸均可反应,Ti比Cu贵重。
10.A
【解析】设原溶液中H2SO4和CuSO4物质的量分别为a和b。Fe+H2SO4=FeSO4+H2↑,Fe+CuSO4=FeSO4+ Cu由题意:56(a+b)=64b,,。
11.D
【解析】物质在相互反应时,它们的物质的量之比等于化学计量数之比。
12.D
【解析】A中不仅要考虑钾的活泼性,还应考虑单质钾的密度;B中常温下产生氧化钾,加热时产生过氧化钾,甚至超氧化钾;C中由于钾的活泼性强于钠,所以金属钾与水的反应较金属钠与水的反应剧烈。
二、填空题
1.(1)5 5 (2)10<a<20 (3)(a-10)︰(20-a)
2.(1)Na NaOH Na2CO3 NaCl
(2)①2Na+2H2O=2Na++2OH―+H2↑ ②2OH―+CO2=CO32―+H2O
③CO32―+2H+=CO2↑+H2O ④2Na+Cl22NaCl
3.(1) (2)1∶2∶3 (3)32∶12∶9 (4)6∶3∶2 (5)Na>Al=Mg
【解析】本题主要考查金属与水和酸的反应。根据钠、镁、铝与酸反应的化学方程式:2Na+2HCl=2NaCl+H2↑,Mg+2HCl=MgCl2+H2↑,2Al+6HCl=2AlCl3+3H2↑以及2Na+2H2O=2NaOH+H2↑,按照各小题的要求,从量上分析即可得出答案。