- 113.80 KB
- 2021-06-24 发布
新课标化学必修一
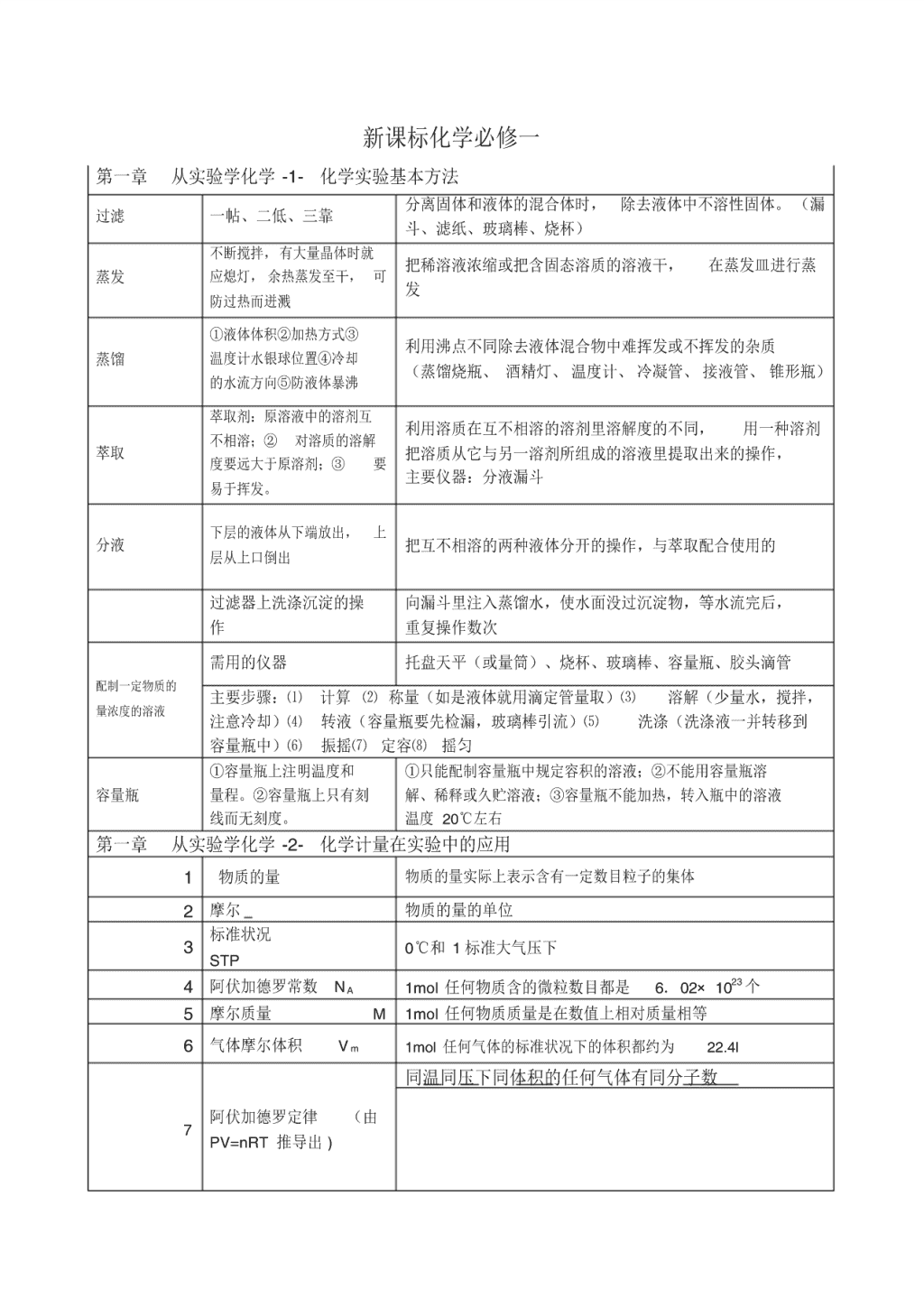
第一章 从实验学化学 -1- 化学实验基本方法
过滤 一帖、二低、三靠 分离固体和液体的混合体时, 除去液体中不溶性固体。 (漏
斗、滤纸、玻璃棒、烧杯)
蒸发
不断搅拌, 有大量晶体时就
应熄灯, 余热蒸发至干, 可
防过热而迸溅
把稀溶液浓缩或把含固态溶质的溶液干, 在蒸发皿进行蒸
发
蒸馏
①液体体积②加热方式③
温度计水银球位置④冷却
的水流方向⑤防液体暴沸
利用沸点不同除去液体混合物中难挥发或不挥发的杂质
(蒸馏烧瓶、 酒精灯、 温度计、 冷凝管、 接液管、 锥形瓶)
萃取
萃取剂: 原溶液中的溶剂互
不相溶;② 对溶质的溶解
度要远大于原溶剂;③ 要
易于挥发。
利用溶质在互不相溶的溶剂里溶解度的不同, 用一种溶剂
把溶质从它与另一溶剂所组成的溶液里提取出来的操作,
主要仪器:分液漏斗
分液
下层的液体从下端放出, 上
层从上口倒出
把互不相溶的两种液体分开的操作,与萃取配合使用的
过滤器上洗涤沉淀的操
作
向漏斗里注入蒸馏水,使水面没过沉淀物,等水流完后,
重复操作数次
配制一定物质的
量浓度的溶液
需用的仪器 托盘天平(或量筒)、烧杯、玻璃棒、容量瓶、胶头滴管
主要步骤:⑴ 计算 ⑵ 称量(如是液体就用滴定管量取)⑶ 溶解(少量水,搅拌,
注意冷却)⑷ 转液(容量瓶要先检漏,玻璃棒引流)⑸ 洗涤(洗涤液一并转移到
容量瓶中)⑹ 振摇⑺ 定容⑻ 摇匀
容量瓶
①容量瓶上注明温度和
量程。②容量瓶上只有刻
线而无刻度。
①只能配制容量瓶中规定容积的溶液;②不能用容量瓶溶
解、稀释或久贮溶液;③容量瓶不能加热,转入瓶中的溶液
温度 20℃左右
第一章 从实验学化学 -2- 化学计量在实验中的应用
1 物质的量 物质的量实际上表示含有一定数目粒子的集体
2 摩尔 物质的量的单位
3 标准状况
STP
0℃和 1 标准大气压下
4 阿伏加德罗常数 NA 1mol 任何物质含的微粒数目都是 6.02× 1023 个
5 摩尔质量 M 1mol 任何物质质量是在数值上相对质量相等
6 气体摩尔体积 V m 1mol 任何气体的标准状况下的体积都约为 22.4l
7 阿伏加德罗定律 (由
PV=nRT 推导出 )
同温同压下同体积的任何气体有同分子数
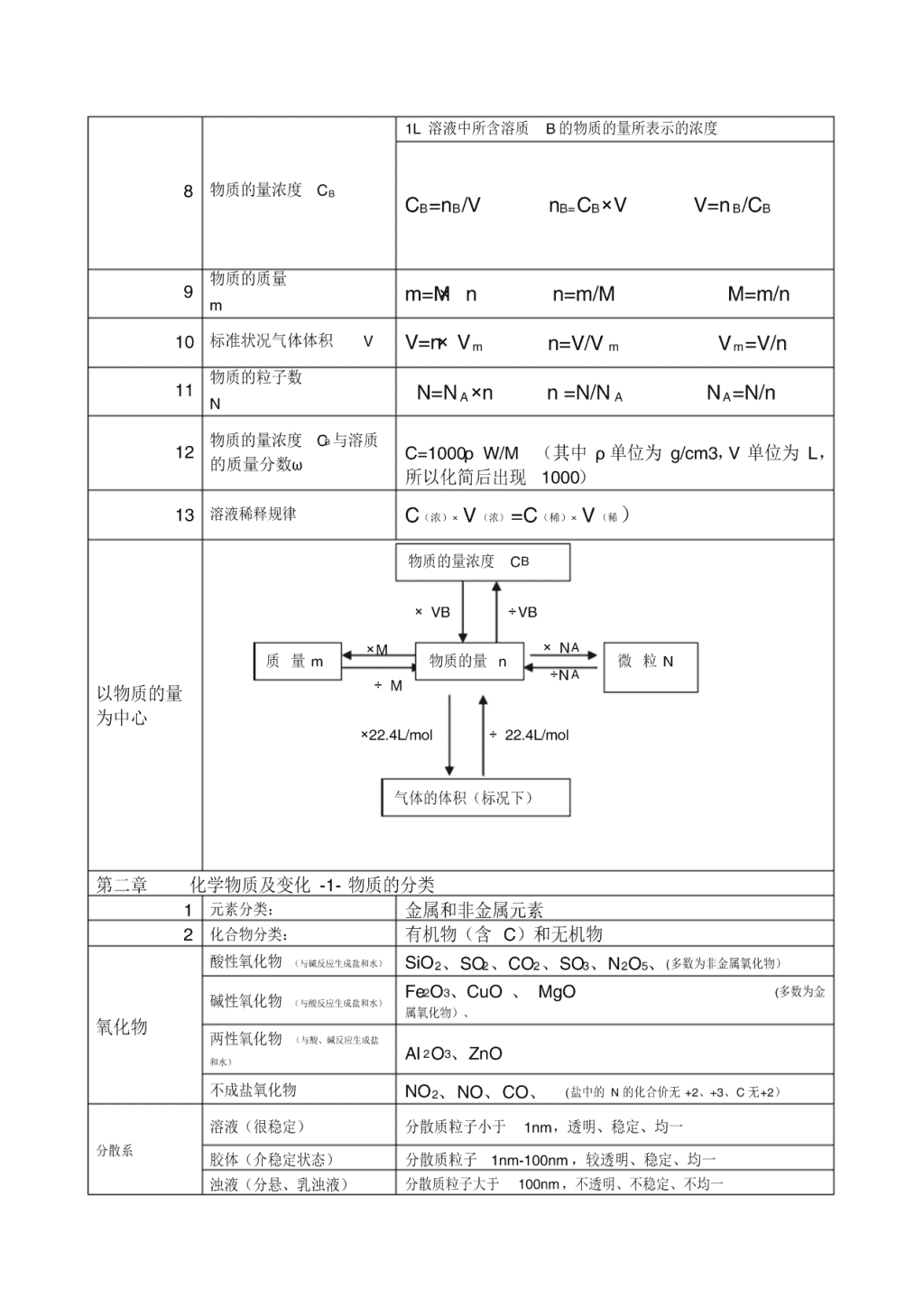
8 物质的量浓度 CB
1L 溶液中所含溶质 B 的物质的量所表示的浓度
CB=nB/V nB=CB×V V=n B/CB
9 物质的质量
m m=M× n n=m/M M=m/n
10 标准状况气体体积 V V=n×V m n=V/V m V m=V/n
11 物质的粒子数
N N=N A ×n n =N/N A NA=N/n
12 物质的量浓度 CB 与溶质
的质量分数ω C=1000ρW/M (其中 ρ单位为 g/cm3,V 单位为 L,
所以化简后出现 1000)
13 溶液稀释规律 C(浓)× V (浓) =C(稀)× V (稀 )
以物质的量
为中心
第二章 化学物质及变化 -1- 物质的分类
1 元素分类: 金属和非金属元素
2 化合物分类: 有机物(含 C)和无机物
氧化物
酸性氧化物 (与碱反应生成盐和水) SiO2、SO2、CO2、SO3、N2O5、(多数为非金属氧化物)
碱性氧化物 (与酸反应生成盐和水)
Fe2O3、CuO 、 MgO (多数为金
属氧化物)、
两性氧化物 (与酸、碱反应生成盐
和水) Al 2O3、ZnO
不成盐氧化物 NO2、NO、CO、 (盐中的 N 的化合价无 +2、+3、C 无+2)
分散系
溶液(很稳定) 分散质粒子小于 1nm,透明、稳定、均一
胶体(介稳定状态) 分散质粒子 1nm-100nm ,较透明、稳定、均一
浊液(分悬、乳浊液) 分散质粒子大于 100nm ,不透明、不稳定、不均一
物质的量浓度 CB
质 量 m 微 粒 N
气体的体积(标况下)
物质的量 n
×VB ÷VB
×NA
÷N A
÷22.4L/mol ×22.4L/mol
÷M
×M
化学反应的
分类
四大基本反应类型
化合: 2SO2+ O2 2SO3
分解: 2NaHCO3 Na2CO3 +CO2↑+ H 2O
置换: Cl 2 +2KI ===2KCl+I 2
复分解: 2NH 4Cl +Ca(OH) 2 CaCl 2+2NH 3↑+ 2H2O
是否有离子参加反应 (电解
质在水溶液中)
离子反应: Cl 2+H2O = HCl+HClO
非离子反应: 2Fe+3Cl 2 2FeCl3
是否有元素电子得失或偏
移(有升降价)
氧化还原反应: 2Na+2H2O=2NaOH+H 2↑
非氧化还原反应: Al(OH) 3 + NaOH = NaAlO 2 + 2H 2O
热量的放出或吸收
放热反应: 3Fe+2O2 Fe3O4
吸热反应: C+CO2 2CO
第二章 化学物质及变化 -2- 离子反应
电解质(酸、碱、盐、水) 在水溶液里或熔融状态下本身能够导电的化合物
非电解质 (包括 CO 2、SO2) 在水溶液里或熔融状态下不能够导电的化合物
碳酸的电离方程式 H2CO3 H ++HCO3
- (弱电解质用“ ”
NaHCO3 的电离方程式 NaHCO3=Na++HCO3
- (强电解质用“ = ”
离子反应式 用实际参加反应的离子所表示的式子
离子反应式写法
一写、二改、三删、四查
单质、氧化物、气体、难溶、难电离的物质要保留分子式
离子共存
有颜色的离子 MnO 4-紫红、 Fe3+棕黄、 Fe2+浅绿、 Cu2+蓝色
与 H+ 不共存(弱酸根) OH-、CO32-、SO32-、SiO32-、AlO 2-、S2-、F- 等
与 OH -不共存 (弱碱金属阳
离子) H+、Fe3+、Fe2+、Fe3+、Cu2+、Al 3+、Mg 2+、NH 4+ 等
与 H+ 和 OH -都不共存
HCO 3-、HSO3-、 HS-、
等
常见生成沉淀 Ba2+、Ca2+与 SO4
2-、CO3
2- Ag+与 Cl -
胶体
胶体的性质(介稳定) 丁达尔现象、布朗运动、电泳、聚沉
判断胶体最简单的方法 丁达尔现象
胶体提纯 渗析(胶体微粒不能透过半透膜)
Fe(OH)3 胶体制备的方法
取烧杯盛 20mL 蒸馏水,加热至沸腾,然后逐滴加入饱和
FeCl3 溶液 1mL ~2mL。继续煮沸至溶液呈红褐色。观察所
得红褐色液体 Fe(OH) 3 胶体。
Fe(OH) 3 胶体制备方程式
FeCl3+3H 2O Fe(OH)3( 胶体 ) +3HCl
胶体凝聚的条件 加热、加电解质、加相反电性的胶体
第二章 化学物质及变化 -3- 氧化还原反应
氧化还原反应的本质 有电子转移 (得失或偏移 )
氧化还原反应的特征 元素化合价的升降(不一定有氧的得失)
升失氧 还原剂、还原性、失电子、(升价)、 被氧化、发生氧化反应成氧化产物
降得还 氧化剂、氧化性、得电子、 (降价)、 被还原、发生还原反应成还原产物
化合反应 不一定是氧化还原反应,一般有单质参加的化合反应或有单质
生成的分解反应才属氧化还原反应分解反应
置换反应 一定是氧化还原反应
复分解反应 一定不是氧化还原反应
气体的检验
NH 3 的检验 用湿润的红色石蕊试纸变蓝
SO2 的检验 用品红溶液褪色
SO2 的吸收 用 KMnO 4 溶液 (强氧化性 )
CO2 的检验 用澄清石灰水变浊
Cl2 的检验 用湿润的 KI 淀粉试纸变蓝
NO 的检验 打开瓶盖后遇空气变红棕色
离子的检验
NH 4+的检验 加 NaOH 溶液加热后放出气体用湿润的红色石蕊试纸变
蓝
Fe3+的检验
①加 NaOH 溶液有红褐色沉淀②加 KSCN 溶液出现血红
色
Fe2+的检验
①加 NaOH 溶液有白色沉淀马上变灰绿色 ,最终变红褐色
②加 KSCN 溶液无现象 ,再加氯水后出现血红色
SO42-的检验 先加 HCl 无现象后加 BaCl2 溶液有不溶于酸的白色沉淀
Cl- 、(Br -、I -)的检验
先加 AgNO 3后加 HNO3 溶液有不溶于酸的白色沉淀 AgCl
(淡黄色沉淀 AgBr 、黄色沉淀 AgI )
NO 3
- 的检验
加浓缩后加入少量浓硫酸和几块铜片加热有红棕色的气
体放出( NO2)
物质的保存
K、Na 保存在煤油中(防水、防 O2)
见光易分解的物质 用棕色瓶( HNO 3、AgNO 3、氯水、 HClO 等)
碱性物质 用橡胶塞不能用玻璃塞( Na2SiO3、NaOH 、Na2CO3)
酸性、强氧化性物质 用玻璃塞不能用橡胶塞( HSO4、HNO 3、KMnO 4)
物质的保存
F2、 HF(氢氟酸) 用塑料瓶不能用玻璃瓶(与 SiO2 反应腐蚀玻璃 )
保存在水中 白磷(防在空气中自燃)、 Br 2(防止挥发)
地壳中含量最多的元素 氧 O、硅 Si、铝 Al 、铁 Fe
地壳有游离态存在的元素 金、铁(陨石)、硫(火山口附近)
金属共同的物理性质 有金属光泽、不透明、易导电、导热、延展性
能与 HCl 和 NaOH 都
能反应的物质
两性: Al 、Al 2O3、Al(OH) 3
弱酸的酸式盐: NaHCO 3、NaHSO3、NaHS
弱酸的铵盐:( NH 4) 2CO3、(NH 4)2S
两性金属 锌 Zn、铝 Al (与酸和碱都放 H2)
钝化金属 铁 Fe、铝 Al (被冷的浓 H2SO4、浓 HNO3)
酸化学性质
稀、浓硫酸的通性 1 强酸性 ----反应生成盐
2 高沸点酸,难挥发性——制备易挥发性酸
浓硫酸的特性
1、吸水性—做干燥,不能干燥 NH3、H2S
2、脱水性—使有机物脱水炭化
3、强氧化性——与不活泼金属、非金属、还原性物质反应
硝酸 HNO3 1、强酸性 2、强氧化性 3、不稳定性 (见光、受热)
次氯酸 HClO 1、弱酸性 2、强氧化性 3、不稳定性 (见光、受热 )
硅酸 H2SiO3 1、弱酸性 2、难溶性 3、不稳定性 (热 )
漂白
氧化型(永久) 强氧化性: HClO 、Na2O2、O3、浓 H2SO4、浓 HNO 3
加合型(暂时) SO2 (使品红褪色,不能使石蕊变红后褪色)
吸附型(物理) 活性碳 明矾溶液生成的 Al(OH) 3 胶体
水溶液
氯水主要成分
分子: Cl 2、 H2O、 HClO
离子: H +、Cl -、 ClO-
氨水主要成分 分子: NH3 H 2O NH 3·H2O
离子: NH4
+ OH ˉ
氯水与液氯、氨水与液氨的区别 氯水、氨水属混合物、液氯与液氨属纯净物
氯原子 Cl 与氯离子 Cl -的区别 最外层电子数不同,化学性质不同,氯离子 Cl -达稳定结构
气体
极易溶于水(喷泉) NH 3(1:700) HCl (1:500)
只能用排气法收集 NO 2 NH3 HCl
只能用排气法收集 NO N2 CO
钠与水的反
应
现象 : ①浮、②熔、③游、
④咝、⑤红
①钠浮在水面上——密度小于水;②水蒸气——放热;③熔
化成一个小球——溶点低;④在水面上游动——生成气体;
咝咝发出响声——反应剧烈;⑤变色——生成碱
俗名 苏打 Na2CO3、小苏打 NaHCO 3 水玻璃: Na2SiO3 的水溶液 漂白粉主要成分:
Ca(ClO) 2、CaCl 2,有效成分 Ca(ClO) 2
用途
Na2O2(淡黄色 )用作呼吸面具, Al(OH) 3 和 NaHCO 3 (小苏打)可中和胃酸
明矾用作净水剂,次氯酸 HClO 杀菌、消毒、永久性漂白、 SO2 暂时性漂白
自来水常用 Cl 2 来消毒、杀菌但产生致癌的有机氯 ,改用广谱高效消毒剂二氧化氯 (ClO2)
Fe2O3—红色油漆和涂料; Al 2O3—耐火材料 ,NH 3 可用于氮肥、制冷剂。
晶体硅 Si 作半导体、太阳能电池 ; SiO2 可作光导纤维;硅胶是常用的干燥剂及催
化剂的载体。水玻璃可做肥皂填料、木材防腐防火剂及黏胶
第三章 金属及其化合物 -1- 金属的化学性质
4. 金属钠的
物理性质
金属钠是一种银白色的金属;熔点低、密度小、硬度小、展性好。查表或看书可知金属
钠熔点为 97.81。
C,沸点为 882.9 。
C;密度为 0.97g·cm—3
5、金属与水
的反应 2Na +2H2O ====2NaOH + H2
6.分类法
在研究物质性质时,运用分类的方法,分门别类地对物质及其变化进行研究,可以总结
出各类物质的通性和特性; 反之,知道某物质的类别, 我们就可推知该物质的一般性质。
7.比较法
运用比较的方法,可以找出物质性质间的异同,认识物质性质间的内在联系,对物质的
性质进行归纳和概括。
8.实验法
(1)含义: 通过实验来验证对物质性质的预测或探究物质未知的性质的方法。
(2)注意的问题:在进行实验时,要注意控制温度、压强、溶液的浓度等条件,这是
因为同样的反应物质在不同的条件下可能会发生不同的反应。
(3)实验法的步骤:实验前,要明确实验的目的要求、实验用品和实验步骤等;实验
中,要仔细研究实验现象,并做好实验记录;实验后,要写好实验报告,并对实验结果
进行分析。
9、金属和氧
气的反应 4Na +O2 ==== 2Na 2O 2Na +O2 ==== 2Na 2O2
10、 Na2O2 与
H2O 反应的化
学原理:
属于自身氧化还原反应; -1 价的氧元素具有强氧化性, 所以能使色质褪色。 表现漂白性。
4.铝箔熔化,失去光泽,但熔化的铝箔并不滴落,好像有一层膜兜着。这是因为铝表面
的氧化膜保护了铝,构成薄膜的氧化铝的熔点( 2050℃)高于铝的熔点( 660℃),包
在铝的外面,所以熔化了的液态铝不会滴落下来。
熔化的铝仍不会滴落,因为铝很活泼,磨去原来的氧化膜后,在空气中又会很快的生成
一层新的氧化膜。这也正是性质活泼的铝在空气中能稳定存在的原因。