- 514.50 KB
- 2021-06-18 发布
化学实验基础
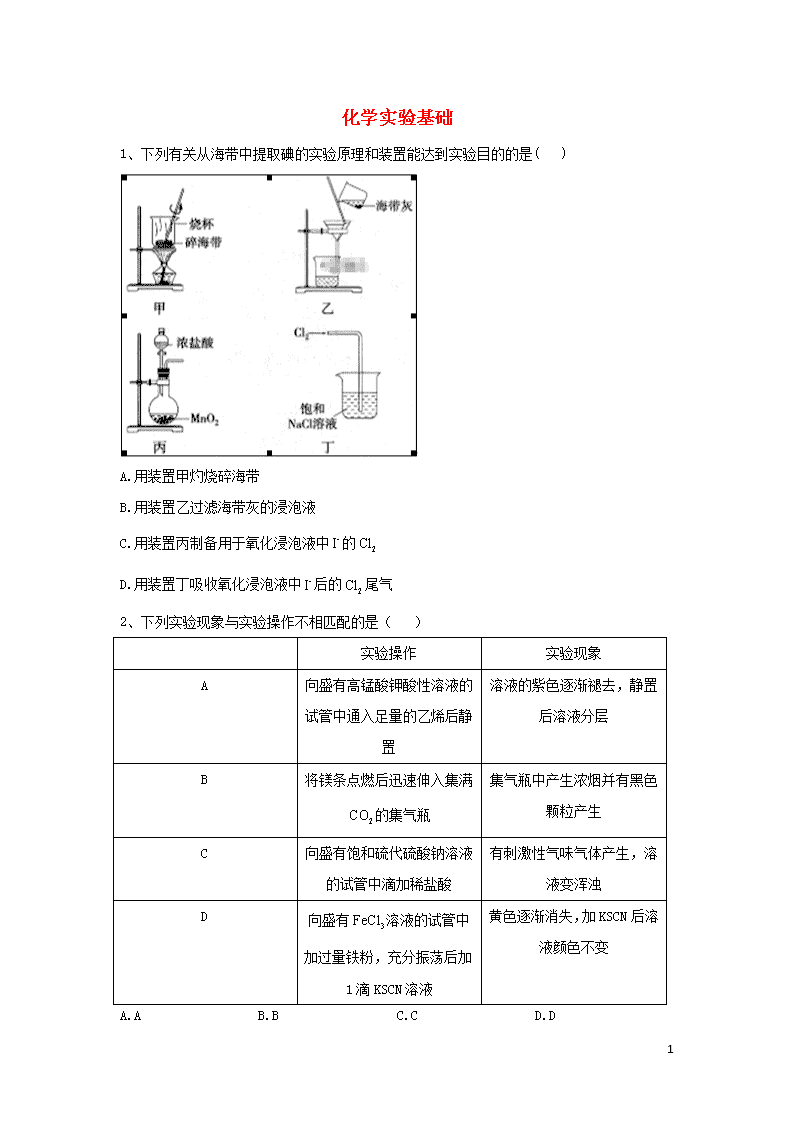
1、下列有关从海带中提取碘的实验原理和装置能达到实验目的的是( )
A.用装置甲灼烧碎海带
B.用装置乙过滤海带灰的浸泡液
C.用装置丙制备用于氧化浸泡液中的
D.用装置丁吸收氧化浸泡液中后的尾气
2、下列实验现象与实验操作不相匹配的是( )
实验操作
实验现象
A
向盛有高锰酸钾酸性溶液的试管中通入足量的乙烯后静置
溶液的紫色逐渐褪去,静置后溶液分层
B
将镁条点燃后迅速伸入集满的集气瓶
集气瓶中产生浓烟并有黑色颗粒产生
C
向盛有饱和硫代硫酸钠溶液的试管中滴加稀盐酸
有刺激性气味气体产生,溶液变浑浊
D
向盛有溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液
黄色逐渐消失,加KSCN后溶液颜色不变
A.A B.B C.C D.D
13
3、分液漏斗中液体为甲、锥形瓶内物质为乙、试剂瓶中液体为丙,利用烧杯内液体吸收尾气。用图中装置进行实验,其实验目的或现象都正确的是( )
选项
甲
乙
丙
实验目的或现象
实验装置
A
稀硫酸
碳酸钠
硅酸钠溶液
验证硫、碳、硅的非金属性强弱
B
浓盐酸
二氧化锰
溴化钠溶液
验证氯气和溴单质的氧化性强弱
C
浓氨水
氧化钙
氯化铝溶液
观察先出现白色沉淀后沉淀逐渐溶解现象
D
浓硫酸
亚硫酸钠
溴水
验证二氧化硫的漂白性
4、由下列实验及现象推出的相应结论正确的是( )
实验
现象
结论
A
某溶液中滴加
产生蓝色沉淀
原溶液中有,无
B
向溶液中通入
溶液变浑浊
酸性:.
C
向含有ZnS和悬浊液中滴加溶液
生成黑色沉淀
D
①某溶液中加入溶液
②再加足量盐酸
①产生白色沉淀
②仍有白色沉淀
原溶液中有
A.A B.B C.C D.D
5、下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
13
选项
实 验
现象
结论
A
将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液
有气体生成,溶液呈血红色
稀硝酸将Fe氧化为Fe3+
B
将铜粉加1.0mol·L-1 Fe2(SO4)3溶液中
溶液变蓝、有黑色固体出现
金属铁比铜活泼
C
用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热
无液态铝滴落
金属铝的熔点高
D
将0.1mol·L-1MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol·L-1CuSO4溶液
先有白色沉淀生成后变为浅蓝色沉淀
Cu(OH)2的溶度积比Mg(OH)2的小
A.A B.B C.C D.D
6、下列实验操作规范且能达到目的的是( )
选项
目的
操作
A
取20.00mL盐酸
在50mL酸式滴定管中装入盐酸,调整初始读数为30.00mL后,将剩余A盐酸放入锥形瓶
B
清洗碘升华实验所用试管
先用酒精清洗,再用水清洗
C
测定醋酸钠溶液pH
用玻璃棒蘸取溶液,点在湿润的pH试纸上
D
配制浓度为0.010 moL的溶液
称取MnO4固体0.158g,放入100mL容量瓶中,加水溶解并稀释至
A.A B.B C.C D.D
7、利用废蚀刻液(含FeCl2、CuCl2及FeCl3)制备碱性蚀刻液[Cu(NH3)4Cl2溶液]和FeCl3·6H2O的主要步骤:用H2O2氧化废蚀刻液,制备氨气,制备碱性蚀刻液[CuCl2+4NH3=Cu(NH3)4Cl2]、固液分离,用盐酸溶解沉淀并制备FeCl3·6H2O。下列装置不能达到实验目的的是( )
13
A.用装置甲制备NH3
B.用装置乙制备Cu(NH3)4Cl2溶液并沉铁
C.用装置丙分离Cu(NH3)4Cl2溶液和Fe(OH)3
D.用装置丁将FeCl3溶液蒸干制备FeCl3·6H2O
8、实验是化学研究的基础,下图关于各实验装置(夹持装置已略去)的叙述,正确的是( )
A.
B.
C.
D.
9、下列实验方案、现象、得出的结论均正确的是( )
选项
实验及现象
结论
A
用玻璃棒蘸取某样品进行焰色反应时观察到黄色火焰
该样品含钠元素
B
向NaHCO3溶液中加入过量盐酸振荡、静置、有气泡产生
证明非金属性:Cl>C
C
向酸化的KMnO4溶液通入SO2,向反应后的溶液中加入 BaCl2产生白色沉淀
证明SO2被氧化为
D
将 10mL 2mol/L 的 KI 溶液与 1mL 1mol/L FeCl3 溶液 混合充分反应后滴加KSCN.溶液颜色变红
KI与FeCl3反应有可逆性
13
A.A B.B C.C D.D
10、下列选项中的实验操作、现象与结论完全一致的是( )
选项
实验操作
现象
结论
A
用玻璃棒蘸取次氯酸钠溶液,点在pH试纸上
试纸最终显蓝色
次氯酸钠溶液显碱性
B
用pH试纸分别测定的溶液和的 溶液的pH
溶液的pH约为10.溶液的pH约为8
结合能力:
C
用坩埚钳夹住一小块用砂纸打磨过的铝箔在酒精灯上加热
熔化后的液态铝滴落下来
金属铝的熔点低
D
分别将乙烯与通入溴水中
溴水均褪色
两种气体使溴水褪色的原理相同
A.A B.B C.C D.D
11、按如图装置进行实验,下列推断正确的是( )
选项
Ⅰ中试剂
Ⅱ中试剂及现象
推断
A
氯化铵
酚酞溶液不变红色
氯化铵稳定
B
硫酸亚铁
品红溶液褪色
FeSO4分解生成FeO和SO2
C
涂有石蜡油的碎瓷片
酸性高锰酸钾溶液褪色
石蜡油发生了化学变化
D
铁粉与水蒸气
肥皂水冒泡
13
铁粉与水蒸气发生了反应
A.A B.B C.C D.D
12、已知草酸晶体()的熔点为101℃,170℃分解。下列选用的装置和药品能达到实验目的的是( )
A.
B.
C.
D.
13、下列实验中,现象及结论都正确,且二者之间有因果关系的是( )
13
选项
实验操作
现象
结论
A
常温下,向等体积、等浓度的 NaHCO3
和CH3COONa 溶液中分别滴加2 滴酚酞
两份溶液均变红,
NaHCO3 溶液红色更深
常温下的水解平衡常数:
Kh(CH3COO-)<Kh()
B
向等量同浓度的 H2O2 溶液中分别加入CuCl2、FeCl3 溶液
加 FeCl3 溶液的 H2O2 产生气泡较快
Fe3+对 H2O2分解的催化效果较好
C
使石蜡油蒸汽通过炽热的碎瓷片,将产生的气体通入酸性 KMnO4 溶液
酸性 KMnO4 溶液褪色
石蜡油裂解一定生成了乙烯
D
用两支试管各取 5 mL 0.1 mol/L 酸性
KMnO4 溶液,分别加入 2 mL 0.1 mol/L和 0.2 mol/L H2C2O4 溶液
两试管溶液均褪色,且加 0.2 mol/L H2C2O4 的试管中褪色更快
其它条件不变,H2C2O4 浓度越大,化学反应速率越大
14、易溶于水,其溶解度随温度升高明显增大。以电镀废渣(主要成分是NiO,还有CuO、FeO等少量杂质)为原料制备该晶体的流程如下。下列说法错误的是( )
A.溶解废渣时不能用稀盐酸代替稀
B.除去可采用FeS
C.流程中a→b的目的是富集
D.操作Ⅰ为蒸发浓缩、冷却结晶
15、实验室以空气和镁为原料制备Mg3N2的装置如图所示(夹持和加热装置略去):
下列说法正确的是( )
A.装置 A、B中可依次加入浓硫酸、NaOH 溶液
B.若去掉装置C,对产品纯度无影响
13
C.实验时应先加热C,通入一段时间空气后再加热D
D.E中碱石灰的作用是吸收尾气
答案以及解析
1答案及解析:
答案:B
解析:灼烧碎海带应使用坩埚,A项错误;海带灰的浸泡液用过滤法分离获得含I-的溶液,B项正确;MnO2与浓盐酸反应制Cl2需要加热,反应的化学方程式为MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,C项错误;Cl2在饱和NaCl溶液中溶解度很小,不能用饱和NaCl溶液吸收尾气Cl2,尾气Cl2应用NaOH溶液吸收,D项错误。
2答案及解析:
答案:A
13
解析:本题涉及的考点有乙烯的化学性质镁单质及其化合物的性质、硫及其化合物的性质、铁及其化合物的性质与检验,考查了学生对元素及其化合物基础知识的复述、再现、辨认并能融会贯通的能力,能从微观层面认识物质的性质和变化并用来解决宏观的实际问题,体现了以宏观辨识与微观探析为主的学科核心素养。
A项,乙烯可被酸性溶液氧化,生成,所以实验现象为溶液紫色逐渐褪去,静置后溶液不分层,故错误;B项,发生反应的化学方程式为,集气瓶中产生浓烟(MgO)并有黑色颗粒(C)产生,故正确;C项,发生反应的离子方程式为,有刺激性气味气体()产生,溶液变浑浊(生成S),故正确;D项,发生反应的离子方程式为,加入过量铁粉,完全反应,黄色逐渐消失,滴加KSCN溶液不变色,故正确。
易错提醒:乙烯被酸性溶液氧化后的产物是,故不会与水溶液分层。
3答案及解析:
答案:A
解析:A. H2SO4、H2CO3、H2SiO3均为对应元素最高价氧化物的水化物,因此通过比较其酸性可比较硫、碳、硅的非金属性强弱,故A正确;
B. 二氧化锰与浓盐酸反应制备氯气需加热,图中缺少加热,故B错误;
C. 氢氧化铝不能溶解在氨水中,生成沉淀不能溶解,故C错误;
D. 二氧化硫与Br2的反应是氧化还原反应,该反应不能表现二氧化硫的漂白性,体现其还原性,故D错误;
故选:A。
4答案及解析:
答案:B
解析:A项,说明原溶液中有,但不能确定是否有,不正确;B项,说明制出了,正确;C项,与直接反应生成CuS黑色沉淀,不能说明,不正确;D项原溶液中若有,酸性条件下可将氧化为,不正确
温馨提示:注意酸性条件下有强氧化性。
5答案及解析:
答案:D
13
解析:A. 过量铁粉,反应生成亚铁离子,加入溶液、溶液不显红色,故A错误;
B. 和发生氧化还原反应,反应方程式为,所以没有黑色沉淀生成,溶液由黄色变为蓝色,故B错误;
C. 将铝箔用坩埚钳夹住放在酒精灯火焰上加热,铝和氧气反应生成了氧化铝,形成氧化膜,三氧化二铝的熔点高于铝的熔点,包住了熔化的铝,所以加热铝箔的时候铝熔化了但是不会滴落,故C错误;
D. 将溶液滴入溶液至不再有沉淀产生,说明完全反应,再滴加溶液,先有白色沉淀生成后变为浅蓝色沉淀,说明发生了沉淀的转化,溶度积大的物质向溶度积小的物质转化,所以的溶度积比的小,故D正确。
故选:D。
6答案及解析:
答案:B
解析:由于在酸式滴定管下端还有较长一段没有刻度的部分,故将滴定管(量程为50mL)中初始读数为30.00mL的液体全部放出后,所得的液体体积大于20.00mL,A错误:碘单质易溶于乙醚、乙醇等有机溶剂,故可先用酒精清洗试管中的碘单质,再用水洗去试管壁上附着的酒精,B正确:润湿的pH试纸会稀释醋酸钠溶液,造成测定的pH偏低,C错误;容量瓶只能用来定容,不能在容量瓶中溶解固体,D错误
7答案及解析:
答案:D
解析:A.实验室制备氨气,可用氢氧化钙、氯化铵在加热条件下进行,故A正确;
B.氨气易溶于水,注意防止倒吸,氨气与溶液反应生成Cu(NH3)4Cl2和氢氧化铁,故B正确;
C.分离固体和液体,可用过滤的方法,故C正确;
D.应在蒸发皿中蒸发,且避免氯化铁水解,更不能直接蒸干,故D错误。
8答案及解析:
答案:A
13
解析:A项,HCl极易溶于水,不溶于四氯化碳,将HC通入四氯化碳中,隔绝与水的接触,四氯化碳有缓冲作用能防止倒吸故A正确;B项,重铬酸钾具有强氧化性,能氧化橡胶,应该用酸式滴定管,故B错误;C项,二氧化碳气体应从长导管进入故C错误D项,从,溶液中获得无水的方法是在不断通入HCl的条件下将,溶液蒸干,故D错误。
知识拓展:碱式滴定管不能用于盛放酸和强氧化性溶液;酸式滴定管不能用于盛放碱液。
9答案及解析:
答案:D
解析:玻璃中含有钠元素,干扰钠离子的检验,应用铁丝或铂丝,故A错误;NaHCO3溶液中加入过董盐酸,可知酸性盐酸大于碳酸,但盐酸为无氧酸,则不能比较Cl、C的非金属性,故B错误;向酸化的KMnO,溶液通入SO2,向反应后的溶液中加入盐酸酸化的 BaCl2产生白色沉淀.如果高锰酸钾溶液使用的是硫酸进行的酸化.则不能确定SO2是后来生成的还是原溶液中的,故C错误; 10mL 2mol/L的KI溶液与1mL 1mol/L FeCl3溶液混合.其中KI过量.混合充分反应后滴加KSCN,溶液颜色变红,证明溶液 中还存在三价铁离子,因此可证明KI与FeCl3反应进行不彻底,有可逆性,故D正确。
10答案及解析:
答案:B
解析:A项, NaCIO具有强氧化性,能把pH试纸漂白,故A错误;B项,依据越弱越水解,溶液的pH约为10, 溶液的pH约为8,说明水解程度大于,即结合能力:故B正确;C项,铝为活泼金属,容易与氧气反应生成氧化铝,氧化铝的熔点高于铝单质,因此现象是熔化而不滴落,故C错误;D项,乙烯与溴水发生加成反应,与溴水发生氧化还原反应褪色原理不相同,故D错误。
11答案及解析:
答案:C
解析:A.氯化铵加热分解生成氨气和HCl,遇冷时氨气与氯化氢又能够反应生成氯化铵,所以酚酞溶液不变红色,故A错误;
B.该反应为氧化还原反应,生成二氧化硫的反应为还原反应,则亚铁离子应该被氧化成+3
13
价的Fe2O3,即FeSO4分解生成Fe2O3和SO2,故B错误;
C.石蜡油蒸气在炽热碎瓷片的作用下,发生裂解生成乙烯,酸性高锰酸钾溶液褪色说明了有乙烯生成,从而证明石蜡油发生了化学变化,故C正确;
D.加热铁粉与水蒸气,由于气体加热膨胀,能够使肥皂水冒泡,所以不能根据肥皂水冒泡得出铁粉与水蒸气发生了反应,故D错误。
故选:C。
12答案及解析:
答案:D
解析:A项,铜和稀硫酸不反应,A错误B项,常温下铝遇浓硝酸钝化而无法制取二氧化氮,B错误;C项,草酸晶体熔化温度低于分解温度,试管口应略向上倾斜,C错误;D项,苯与溴苯的沸点相差较大,可用蒸馏法分离,D正确。
审题方法:充分解读题目信息,“已知草酸晶体()的熔点为101℃,170℃分解”,说明草酸晶体受热未分解先熔化,若试管口向下倾斜,则液体流出。
13答案及解析:
答案:A
解析:A.常温下,向等体积、等浓度的NaHCO3和CH3COONa溶液中分别滴加2滴酚酞,两份溶液均变红,NaHCO3溶液红色更深,说明水解程度大,所以常温下的水解平衡常数:Kh(CH3COO−)
相关文档
- 部编版历史高考复习专题大全集,高分2021-05-25 11:01:1842页
- 高考复习专题陌生方程式的书写2021-05-25 02:32:154页
- 高考复习专题——解题技巧之生物模2021-05-23 01:39:4319页
- 高考复习专题检测政治公民与国家2021-05-22 23:33:468页
- 高考复习专题 感悟真题· 作文题目2021-05-19 18:45:297页
- 2012通用技术高考复习专题一技术及2021-05-19 13:47:368页
- 高考复习专题圆锥曲线技巧总结2021-05-12 17:14:5813页
- 高考复习专题:匀变速直线运动规律应2021-05-12 00:30:513页
- 专题01 锂电池2019高考复习专题—2021-05-08 19:00:0211页
- 高考复习专题 变换的不变量与特征2021-05-08 17:50:033页