- 437.63 KB
- 2021-06-17 发布
一、热化学方程式
1. 概念及表示意义
概念:能表示参加反应的__________和__________的关系的化学方程式,叫热化学方程式。 意义:热化学方程式不仅表明了化学反应中的________变化,也表明了化学反应中的_______变化。
:H2(g)+O2(g)H2O(1) ΔH=−285. 8 kJ·mol−1,表示在25℃,101 kPa下,____ H2与____ O2完全反应生成____态水时______的热量是285. 8 kJ。
2. 书写
热化学方程式各物质前的化学计量数只表示_________,不表示_________,因此,它可以是______数,也可以是_________或_________。对于相同物质的反应,当化学计量数不同时,其ΔH_________。即使化学计量数相同,当反应物、生成物的状态不同时,ΔH_________。
二、中和热
【答案】一、1.物质的量 反应热 物质 能量 1 mol mol 液 放出
2.物质的量 分子(数) 整 小数 分数 不同 也不同
二、1.1 mol H2O −57.3 kJ·mol−1
1.热化学方程式的书写
步骤1 写方程——写出配平的化学方程式;
步骤2 标状态——用“s”、“l”、“g”、“aq”标明物质的聚集状态;
步骤3 标条件——标明反应物的温度和压强(101 kPa、25 ℃时可不标注);
步骤4 标ΔH——在方程式后写出ΔH,并根据信息注明ΔH的“+”或“‒”;
步骤5 标数值——根据化学计量数计算写出ΔH的数值及单位。ΔH的单位一般为kJ·mol‒1。
2.热化学方程式正误判断的“四看”
一看:化学反应原理是否正确,化学方程式是否符合客观事实。
二看:各物质的聚集状态是否注明。
三看:ΔH的“−”和“+”是否正确。
四看:反应热的数值与化学计量数是否相对应。
书写热化学方程式的注意事项
(1)注意测定的条件:需注明反应热测定的温度和压强,如不注明条件,即指25℃,1.01×105 Pa。
(2)注意ΔH的标注:化学方程式的右边必须写上ΔH,若为吸热反应,ΔH为“+”,若为放热反应,ΔH为“−”,单位一般为kJ/mol或kJ·mol−1;根据焓的性质,若化学方程式中各物质的系数加倍,则ΔH的数值也加倍;若反应逆向进行,则ΔH改变符号,但绝对值不变。
(3)注意物质的聚集状态:反应热的数值和符号与反应物和生成物的聚集状态有关,因此必须注明物质的聚集状态(s、l、g、aq)才能完整地体现出热化学方程式的意义。热化学方程式中不需要标出“↑”和“↓”。
(4)注意化学计量数:热化学方程式中化学计量数表示参加反应的各物质的物质的量,可为整数或分数;而普通化学方程式中化学计量数宏观上表示各物质的物质的量,微观上表示原子分子数目,只能为整数,不能为分数。
(5)注意ΔH单位的意义:热化学方程式中,ΔH的单位为kJ·mol−1。这里的“mol−1”不表示具体物质,而是表示“1 mol反应”或“1 mol反应进度”,指“1
mol特定的反应组合”。如“H2(g)+O2(g)H2O(1) ΔH=−285. 8 kJ·mol−1”,“1 mol反应”指“1 mol H2(g)与 mol O2(g)生成1 mol H2O(l)”这一特定反应组合。
(6)注意可逆反应ΔH的意义:不论化学反应是否可逆,热化学方程式中的ΔH都表示反应进行到底时的能量变化。
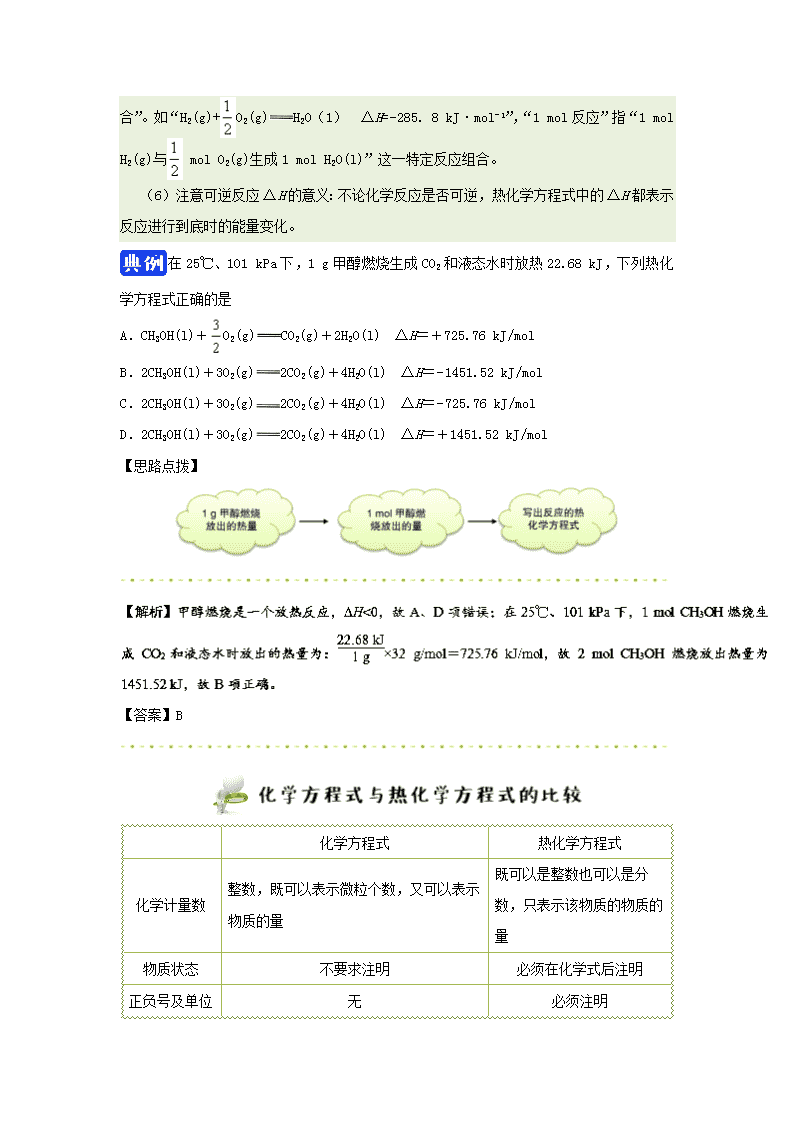
在25℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是
A.CH3OH(l)+O2(g)CO2(g)+2H2O(l) ΔH=+725.76 kJ/mol
B.2CH3OH(l)+3O2(g)2CO2(g)+4H2O(l) ΔH=−1451.52 kJ/mol
C.2CH3OH(l)+3O2(g)2CO2(g)+4H2O(l) ΔH=−725.76 kJ/mol
D.2CH3OH(l)+3O2(g)2CO2(g)+4H2O(l) ΔH=+1451.52 kJ/mol
【思路点拨】
【答案】B
化学方程式
热化学方程式
化学计量数
整数,既可以表示微粒个数,又可以表示物质的量
既可以是整数也可以是分数,只表示该物质的物质的量
物质状态
不要求注明
必须在化学式后注明
正负号及单位
无
必须注明
意义
表明了化学反应中的物质变化
不仅表明化学反应中的物质变化,还表明了化学反应中的能量变化
遵循规律
质量守恒
质量守恒和能量守恒
2.中和热的测定
【实验目的】 测定强酸与强碱反应的反应热,体验化学反应的热效应。
【实验原理】 通过测定一定量的酸、碱溶液在反应前后温度的变化,计算反应放出的热量,由此得中和热。
【实验装置】
【实验用品】
大烧杯(500 mL)、小烧杯(100 mL)、环形玻璃搅拌棒、量筒(50 mL)两个、温度计、泡沫塑料或纸条、泡沫塑料板或硬纸板(中心有两个小孔)、盐酸(0.50 mol·L−1)、氢氧化钠溶液(0. 55 mol·L−1)
【实验说明】
(1)中和热的测定实验中,NaOH溶液的浓度稍大于盐酸的浓度是确保HCl反应完全。若采用的酸、碱浓度相等,可采用碱体积稍过量的方法达到这个目的。
(2)中和热的计算公式
ΔH= kJ/mol
(3)实验中若用弱酸(或弱碱)代替强酸(或强碱),因弱酸(或弱碱)电离出H+(或OH−)需要吸收热量,故测定的中和热的数值偏小;若用浓硫酸与强碱反应测定中和热,因浓硫酸稀释要放热,故测定的中和热的数值偏大。
【实验步骤】
【误差分析】
误差分析依据 各因素主要影响()。若()偏大,则|ΔH |偏大;若()偏小,则|ΔH |偏小。
误差分析
引起误差的实验操作
t终−t始
|ΔH |
保温措施不好
偏小
偏小
搅拌不充分
偏小
偏小
所用酸、碱浓度过大
偏大
偏大
用同浓度的氨水代替NaOH溶液
偏小
偏小
用同浓度的醋酸代替盐酸
偏小
偏小
用等浓度的NaOH溶液和盐酸实验
偏小
偏小
中和热是反应热的一种,其ΔH<0;中和热不包括离子在水溶液中的生成热、物质的溶解热、电解质电离吸收的热量等。
只有强酸和强碱的稀溶液才能保证H+(aq)+OH−(aq)H2O(l)的中和热为57.3 kJ/mol,因为浓酸和浓碱在稀释时会放热,而弱酸和弱碱在中和反应中电离时吸收能量,其中和热一般小于57.3 kJ/mol,。
中和热通常是由实验测得的。在书写表示中和热的热化学方程式时,应以生成1 mol H2O为基准,配平其余物质的化学计量数。
写中和热的热化学方程式时生成的水必须为1 mol,而写中和反应的热化学方程式时生成水的物质的量可为任意值。
50 mL 0.50 mol·L−1盐酸与50 mL 0.55 mol · L−1 NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是________________________________。
(2)烧杯间填满碎纸条的作用是______________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值__________(填“偏大”“偏小”或“无影响”)。
(4)实验中改用60 mL 0.50 mol · L−1盐酸跟50 mL 0.55 mol · L−1 NaOH溶液进行反应,与上述实验相比,所放出的热量__________(填“相等”或“不相等”),所求中和热__________(填“相等”或“不相等”),简述理由:__________________________。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会__________(填“偏大”“偏小”或“无影响”,下同);用50 mL 0.50 mol · L−1 NaOH溶液进行上述实验,测得的中和热的数值会__________。
【答案】 (1)环形玻璃搅拌棒 (2)减少实验过程中的热量损失 (3)偏小
(4)不相等 相等 因为中和热是指酸跟碱发生中和反应生成1 mol H2O所放出的热量,与酸碱的用量无关 (5)偏小 偏小
1.下列说法正确的是
A.热化学方程式的计量数不可以为分数
B.热化学方程式中只需标明生成物的状态
C.反应热指的是反应过程中放出或吸收的热量
D.伴随能量变化的一定是化学变化
2.在做中和反应反应热的测定实验时,应使用的仪器正确的是
①量筒 ②托盘天平 ③烧杯 ④泡沫塑料或纸条 ⑤冷凝管 ⑥温度计
⑦酒精灯 ⑧泡沫塑料板或硬纸板(中心有两个小孔) ⑨环形玻璃搅拌棒
A.①③④⑥⑧⑨ B.②③⑤⑥⑦⑧ C.①②③⑥⑦⑧ D.全部
3.下列热化学方程式书写不正确的是
A.2SO2+O22SO3 ΔH=−196.6 kJ · mol−1
B.H2(g)+O2(g)H2O(1) ΔH=−285.8 kJ · mol−1
C.2H2(g)+O2(g)2H2O(1) ΔH=−571.6 kJ · mol−1
D.C(s)+O2(g)CO2(g) ΔH=−393.5 kJ · mol−1
4.下列说法正确的是
A.强酸跟强碱的反应热一定是中和热
B.1 mol C(碳)完全燃烧放热383.3 kJ,其热化学方程式为:C+O2CO2 ΔH=
−383.3 kJ·mol−1
C.在稀溶液中,酸与碱发生中和反应生成1 mol H2O时的反应热叫做中和热
D.表示中和热的离子方程式为:H+(aq)+OH−(aq)H2O(l);ΔH=57.3 kJ·mol−1
5.含有11.2 g KOH的稀溶液与1 L 0.1 mol/L的H2SO4溶液反应,放出11.46 kJ的热量,表示该反应中和热的热化学方程式为
A.KOH(aq)+H2SO4(aq)K2SO4(aq)+H2O(l) ΔH=+57.3 kJ/mol
B.2KOH(aq)+H2SO4(aq)K2SO4(aq)+2H2O(l) ΔH=+114.6 kJ/mol
C.2KOH(aq)+H2SO4(aq)K2SO4(aq)+2H2O(l) ΔH=−114.6 kJ/mol
D.KOH(aq)+H2SO4(aq)K2SO4(aq)+H2O(l) ΔH=−57.3 kJ/mol
6.利用简易量热计测量室温下盐酸与氢氧化钠溶液中和反应的反应热,下列措施不能提高实验精度的是
A.利用移液管(精确至0.01 mL)代替量筒(精确至0.1 mL)量取反应液
B.快速将两溶液混合,匀速搅拌并记录最高温度
C.在内、外筒之间填充隔热物质,防止热量损失
D.用量程为500℃的温度计代替量程为100℃的温度计测量反应液温度
7.化学反应X2+3Y22XY3的能量变化如图所示,该反应的热化学方程式是
A.X2(g)+3Y2(g)2XY3(l) ΔH =2(a−b−c) kJ/mol
B.X2(g)+3Y2(g)2XY3(g) ΔH =2(b−a) kJ/mol
C.X2(g)+Y2(g)XY3(l) ΔH =(b+c−a) kJ/mol
D.X2(g)+Y2(g)XY3(g) ΔH =(a+b) kJ/mol
8.[2017北京节选]TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:
(1)氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2Cl2(g)TiCl4(g)+ O2(g) ΔH1=+175.4 kJ·mol-1
2C(s)+O2(g)2CO(g) ΔH2=−220.9 kJ·mol-1
① 沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:_______________________。
② 氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的ΔH
_____0(填“>”“<”或“=”),判断依据:________________________________________。
1.【答案】C
2.【答案】A
【解析】中和反应反应热测定的实验装置如图,温度计用于测定溶液的温度,环形玻璃搅拌棒用于搅拌使溶液混合均匀,量筒用于量取一定量的酸、碱溶液。
3.【答案】A
【解析】书写热化学方程式要注明反应物和生成物的状态。
4.【答案】C
5.【答案】D
【解析】中和热是以生成1 mol H2O(l)所放出的热量来定义的,故书写中和热的热化学方程式时,应以生成1 mol H2O(l)为标准来配平其余物质的化学计量数。
6.【答案】D
【解析】A项,提高所用试剂量的准确度可提高测量反应热的精确度;B、C项都能减少热量散失,可提高实验精度;D项,温度计用500℃量程,最小刻度变大,测定温度不准确,使实验精度降低。
7.【答案】A
【解析】由题图可知, mol X2(g)和 mol Y2(g)断键生成1 mol X和3 mol Y吸收的能量为a kJ,同时,1 mol X和3 mol Y形成新键生成1 mol XY3(g)或1 mol XY3(l)放出的能量分别为b kJ、(b+c) kJ,故 mol X2(g)和 mol Y2(g)生成1 mol XY3(g)或1 mol XY3(l)放出的热量分别为(b−a) kJ、(b+c−a) kJ,故对应的ΔH分别为(a−b) kJ/mol、(a−b−c) kJ/mol。
8.【答案】(1)①TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g) △H=-45.5 kJ/mol
②> 随温度升高,CO含量增大,说明生成CO的反应是吸热反应
空气净化器
空气净化器又称空气清洁器、空气清新机、净化器,是指能够吸附、分解或转化各种空气污染物(一般包括PM2.5、粉尘、花粉、异味、甲醛之类的装修污染、细菌、过敏原等),有效提高空气清洁度的家电产品,主要分为家用、商用、工业、楼宇。
空气净化器中有多种不同的技术和介质,使它能够向用户提供清洁和安全的空气。常用的空气净化技术有:吸附、负(正)离子、催化、光触媒技术等;材料技术主要有:光触媒、活性炭、合成纤维、HEAP高效材料、负离子发生器等。现有的空气净化器多采用复合型,即同时采用了多种净化技术和材料介质。