- 128.50 KB
- 2021-06-17 发布
江南中学2016-2017学年第二学期第一次月考
高二(文科)化学试题
(分值:100分 考试时间:90分钟)
常见原子相对原子质量:C—12 H—1 O—16 N—14 Na—23 S—32
第一卷 选择题(共48分)
一、 选择题(本题共16小题,每题只有一个选项符合题意。每小题3分,共48分)
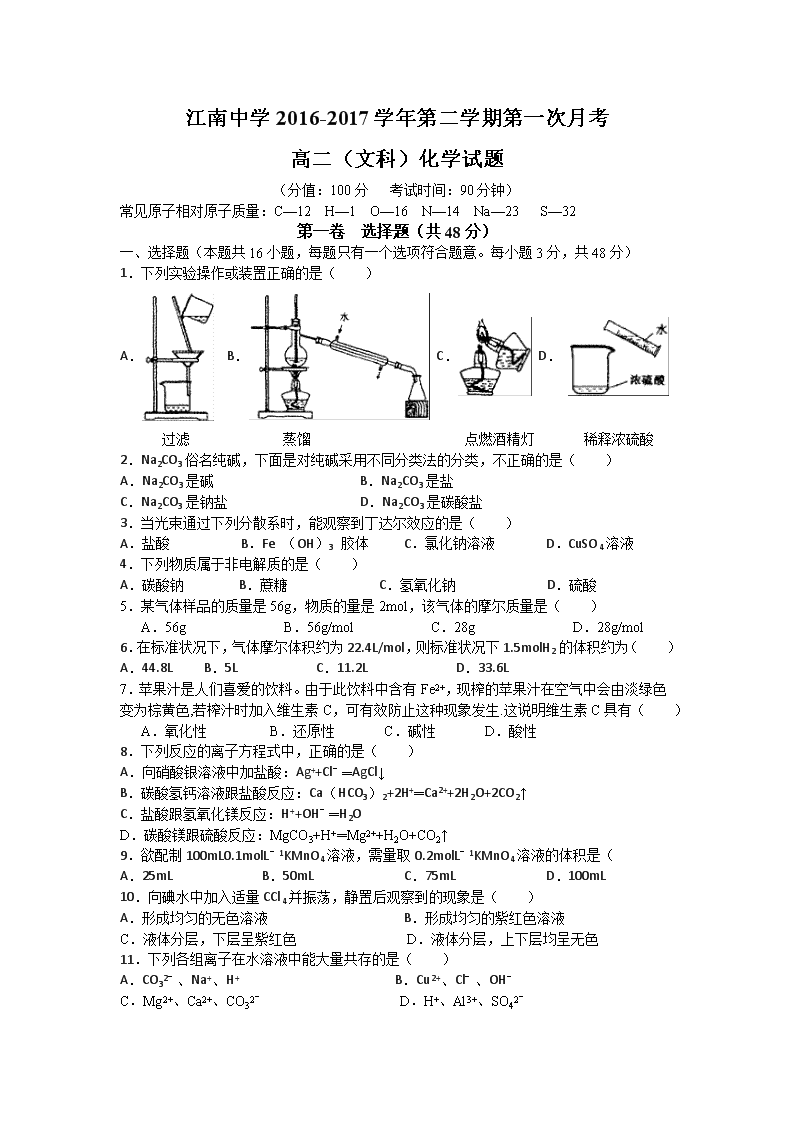
1.下列实验操作或装置正确的是( )
A. B. C. D. 过滤 蒸馏 点燃酒精灯 稀释浓硫酸
2.Na2CO3俗名纯碱,下面是对纯碱采用不同分类法的分类,不正确的是( )
A.Na2CO3是碱 B.Na2CO3是盐
C.Na2CO3是钠盐 D.Na2CO3是碳酸盐
3.当光束通过下列分散系时,能观察到丁达尔效应的是( )
A.盐酸 B.Fe (OH)3 胶体 C.氯化钠溶液 D.CuSO4溶液
4.下列物质属于非电解质的是( )
A.碳酸钠 B.蔗糖 C.氢氧化钠 D.硫酸
5.某气体样品的质量是56g,物质的量是2mol,该气体的摩尔质量是( )
A.56g B.56g/mol C.28g D.28g/mol
6.在标准状况下,气体摩尔体积约为22.4L/mol,则标准状况下1.5molH2的体积约为( )
A.44.8L B.5L C.11.2L D.33.6L
7.苹果汁是人们喜爱的饮料。由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色变为棕黄色,若榨汁时加入维生素C,可有效防止这种现象发生.这说明维生素C具有( )
A.氧化性 B.还原性 C.碱性 D.酸性
8.下列反应的离子方程式中,正确的是( )
A.向硝酸银溶液中加盐酸:Ag++Cl﹣═AgCl↓
B.碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+═Ca2++2H2O+2CO2↑
C.盐酸跟氢氧化镁反应:H++OH﹣═H2O
D.碳酸镁跟硫酸反应:MgCO3+H+═Mg2++H2O+CO2↑
9.欲配制100mL0.1molL﹣1KMnO4溶液,需量取0.2molL﹣1KMnO4溶液的体积是(
A.25mL B.50mL C.75mL D.100mL
10.向碘水中加入适量CCl4并振荡,静置后观察到的现象是( )
A.形成均匀的无色溶液 B.形成均匀的紫红色溶液
C.液体分层,下层呈紫红色 D.液体分层,上下层均呈无色
11.下列各组离子在水溶液中能大量共存的是( )
A.CO32﹣、Na+、H+ B.Cu2+、Cl﹣、OH﹣
C.Mg2+、Ca2+、CO32﹣ D.H+、Al3+、SO42﹣
12.下列说法正确的是( )
A.C元素的相对分子质量是12,则1mol C的质量为12g/mol
B.1mol Cl2的体积为22.4L
C.1mol CO2中含有3个原子
D.已知NaOH溶液的物质的量浓度为0.5mol/L,则2L该溶液中含NaOH 1mol
13.配制一定物质的量浓度的溶液时,由于操作不慎,转移时有些液体溅到外面,下列说法正确的是( )
A.再加点溶质到容量瓶中去 B.影响不大,不再处理
C.重新配制 D.以上措施都不正确
14.下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )
A.Fe+CuSO4=Cu+FeSO4 B.3CO+Fe2O32Fe+3CO2
C.AgNO3+NaCl=NaNO3+AgCl↓ D.2KMnO4 K2MnO4+MnO2+O2↑
15.某无色溶液中存在大量的NH4+、H+、SO42﹣,该溶液中还可能大量存在的离子是( )
A.Cu2+ B.Al3+ C.CH3COO﹣ D.HCO3﹣
16.用NA表示阿伏加德罗常数的值.下列说法正确的是( )
A.标准状况下,4.48 L乙醇中含有的分子数目为0.2NA
B.常温常压下,6.4 g SO2中含有的氧原子数目为0.2NA
C.1 L 0.1 mol•L﹣1 K2CO3溶液中含有的钾离子数目为0.1 NA
D.100 mL 1.0 mol•L﹣1 FeCl3溶液中含Cl﹣数目为0.2NA
第二卷 非选择题(共52分)
17.(16分)在Fe2O3+2AlAl2O3+2Fe的反应中,_______元素的化合价升高,则该元素的原子________电子,被________;而________元素的化合价降低,则该元素的原子_________电子,被________;该反应中Fe2O3发生了_________反应 Al发生了________反应.
18.(10分)等物质的量的CO和CO2中所含O原子个数之比 ,C原子数之比 ,原子数之比 ,二者的物质的量之比 ,在同温同压下的体积之比
19. (14分)盐酸广泛应用在稀有金属的湿法冶金、漂染工业、金属加工、无机药品及有机药物的生产等领域中。HCl极易溶于水,工业上用HCl气体溶于水的方法制取盐酸。
(1)用12.0mol/L浓盐酸配置500mL 0.3mol/L的稀盐酸,需要浓盐酸的体积 mL
(2)溶液稀释过程中需要的玻璃仪器有烧杯、玻璃棒、量筒、 、 。
(3)溶液稀释过程中有以下操作:
a.量取浓盐酸和一定体积的水,在烧杯中稀释;
b.计算所需浓盐酸的体积;
c.上下颠倒摇匀;
d.加蒸馏水至刻度线1-2cm地方,改用胶头滴管加蒸馏水至凹液面与刻度线相切;
e.将稀释液转移入容量瓶,洗涤烧杯和玻璃棒,并将洗涤液转移入容量瓶,振荡;
以上正确的操作顺序为 。
(4)实验过程中的以下操作会导致最终所配溶液浓度(填“偏大”、“偏小”或“不变”)
a.定容时俯视刻度线: ;
b.没有洗涤烧杯和玻璃棒: ;
c.实验前,容量瓶中有少量残留蒸馏水: ;
20.(12分)
某同学将21.2g Na2CO3溶于水配成500毫升溶液,求
(1) Na2CO3的物质的量
(2) Na2CO3溶液的物质的量浓度
(3)Na2CO3溶液中Na +的数目
江南中学2016-2017学年第二学期第一次月考
高二(文科)化学答案
一、选择题(每题3分,共48分)
1
2
3
4
5
6
7
8
A
A
B
B
D
D
B
A
9
10
11
12
13
14
15
16
B
C
D
D
C
B
B
B
二、非选择题(共52分)
17、(16分,每空2分)
铝,失去,氧化,铁,得到,还原,还原,氧化。
18.(10分,每空2分)
1:2 , 1:1 , 2:3 , 1:1 ,1:1
19. (14分,每空2分)
(1) 12.5
(2) 容量瓶、胶头滴管。
(3) b a e d c
(4) a.偏大; b.偏小; c.不变;
20.(12分,3分+4分+5分)
(1)0.2mol
(2)0.4mol/L
(3)2.408*1024 个