- 301.03 KB
- 2021-06-04 发布
2019学年高一化学下学期期末考试试题 理
可能用到的相对原子质量:H-1 C-12 O-16 S-32 Fe-56 Cu-64 Ag-108
一、选择题(每小题只有一个选项符合题意,每题3分,共计45分)
1.列设备工作时,将化学能转化为电能的是( )
A
B
C
D
硅太阳能电池
铅蓄电池
燃气灶
电烤箱
2.化学与生活密切相关,下列说法正确的是( )
A.医用酒精的浓度通常为95%
B.漂白粉可以在敞口容器中长期存放
C.常温下可用铁制容器贮藏运输浓硫酸
D.干电池用完后,应回收并进行填埋处理
3.下列属于放热反应的是( )
A.铝热反应 B.煅烧石灰石(CaCO3)制生石灰(CaO)
C. C与CO2共热 D.Ba(OH)2·8H2O晶体与NH4Cl晶体反应
4.下列分子式只能表示一种物质的是( )
A.CH2Cl2 B.C4H10 C.C5H12 D.C6H12
5.反应C(s)+H2O(g)CO(g)+H2(g)在一密闭容器中进行,下列条件的改变能加快反应速率的是( )
A.增加C的量 B.压缩容器体积
C.保持容器体积不变,充入N2 D.保持压强不变,降低容器内的温度
6.下列烯烃和H2O发生加成反应所得产物有同分异构体的是( )
A.CH3CH=CH2 B.CH3CH=CHCH3
C.CH2=CH2 D.(CH3)2C=C(CH3)2
7.巴豆酸的结构简式为CH3—CH = CH—COOH。下列关于该物质的说法不正确的是( )
A.分子式为C4H6O2 B.含有两种不同的官能团
C.能发生氧化、取代、加成、酯化等反应 D.分子中所有原子有可能在同一平面
7
8.下列实验操作不当的是( )
A.用稀硫酸和锌粒制取H2时,加几滴CuSO4溶液以加快反应速率
B.利用酸性高锰酸钾溶液除甲烷中的少量乙烯
C.用铂丝蘸取某碱金属的盐溶液灼烧,火焰呈黄色,证明其中含有Na+
D.向溴水中加入苯,可以萃取溴水中的溴
9.a、b、c、d、e为元素周期表前3周期中的部分元素,它们在元素周期表中的相对位置如右图所示。下列叙述正确的是( )
a
d
b
e
c
A.b元素除0价外,只有一种化合价 B.五种元素中,c元素的化学性质最稳定
C.d气态氢化物溶于水,溶液显碱性 D.元素原子半径大小:d<e<c
10.设NA为阿伏加德罗常数值,下列有关叙述正确的是( )
A.1 mol乙烷和1 mol乙烯中,化学键数相同
B.0.1 mol Na2O2与足量的二氧化碳反应转移的电子数为0.1 NA
C.1.7g 羟基(-OH)所含电子的数目为NA
D.56g Fe与足量的水蒸汽充分反应生成氢气,转移电子数为3 NA
11.制取一氯乙烷的最佳方法是 ( )
A.乙烷和氯气反应
B.乙烯和氯气反应
C.乙烯和氯化氢反应
D.乙烯和氢气反应后,所得产物再和氯气反应
12.列实验操作能达到实验目的的是( )
实验目的
实验操作
A
比较水和乙醇中氢的活泼性
分别将少量钠投入到盛有水和乙醇的烧杯中
B
配制稀硫酸
先将浓硫酸加入烧杯中,后倒入蒸馏水
C
除去Cu粉中混有的CuO
加入稀硝酸溶液,过滤、洗涤、干燥
D
证明SO2具有漂白性
把SO2通入紫色石蕊试液中
13.短周期主族元素X、Y、Z、W的原子序数依次增大,其中X是组成有机物的基本骨架元素,常温下,Y的块状单质在Z的最高价氧化物对应水化物的浓溶液中会发生钝化。下列说法一定正确的是( )
A.氧化物对应水化物的酸性:W>X
B.单质沸点:W>Z
C.最简单氢化物的稳定性:W>Z
D.Y、W形成的化合物中既含有离子键,又含有共价键
14.某烷烃相对分子质量为72,跟氯气反应生成的一氯代物只有一种,该烷烃是( )
7
A.丁烷 B.己烷 C.2—甲基丁烷 D.2,2—二甲基丙烷
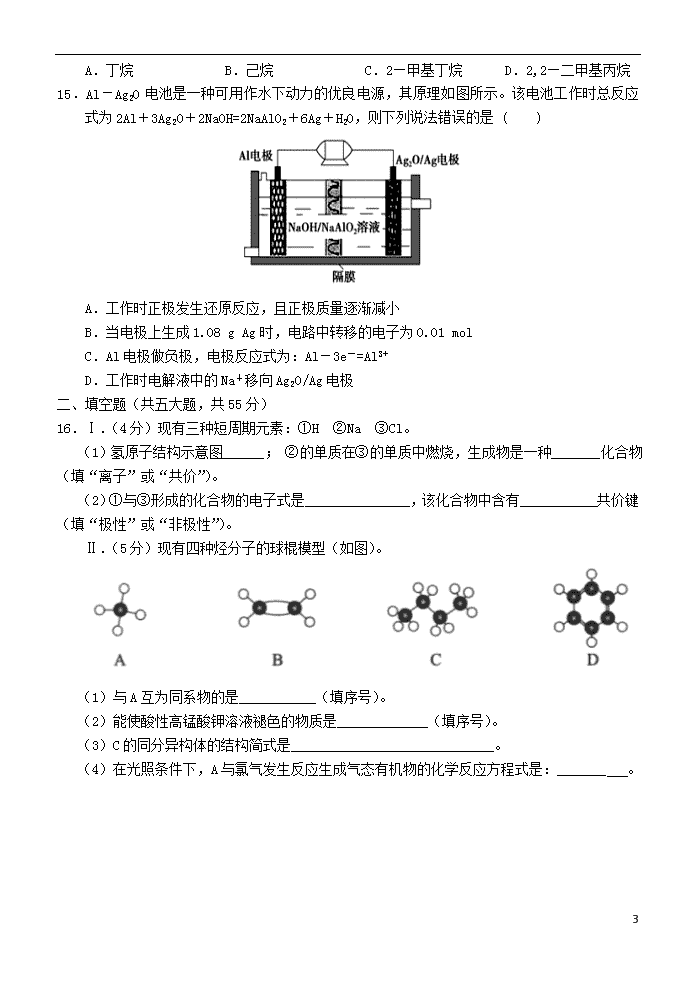
15.Al-Ag2O电池是一种可用作水下动力的优良电源,其原理如图所示。该电池工作时总反应式为2Al+3Ag2O+2NaOH=2NaAlO2+6Ag+H2O,则下列说法错误的是 ( )
A.工作时正极发生还原反应,且正极质量逐渐减小
B.当电极上生成1.08 g Ag时,电路中转移的电子为0.01 mol
C.Al电极做负极,电极反应式为:Al-3e-=Al3+
D.工作时电解液中的Na+移向Ag2O/Ag电极
二、填空题(共五大题,共55分)
16.Ⅰ.(4分)现有三种短周期元素:①H ②Na ③Cl。
(1)氢原子结构示意图______; ②的单质在③的单质中燃烧,生成物是一种_______化合物(填“离子”或“共价”)。
(2)①与③形成的化合物的电子式是_______________,该化合物中含有___________共价键(填“极性”或“非极性”)。
Ⅱ.(5分)现有四种烃分子的球棍模型(如图)。
(1)与A互为同系物的是___________(填序号)。
(2)能使酸性高锰酸钾溶液褪色的物质是_____________(填序号)。
(3)C的同分异构体的结构简式是_____________________________。
(4)在光照条件下,A与氯气发生反应生成气态有机物的化学反应方程式是:_______ 。
7
17.(7分)海洋资源的利用具有广阔前景.
(1)如图是从海水中提取镁的简单流程.
工业上常用于沉淀Mg2+的试剂A是 (填物质名称),Mg(OH)2转化为MgCl2的离子方程式是 .
(2)海带灰中富含以I﹣形式存在的碘元素。实验室提取I2的途径如下所示:
干海带海带灰滤液I2
①灼烧海带至灰烬时所用的主要仪器名称是 .
②向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式 .
③反应结束后,加入CCl4作萃取剂,采用萃取﹣分液的方法从碘水中提取碘,主要操作步骤如图:
甲、乙、丙3步实验操作中,不正确的是 (填“甲”、“乙”或“丙”).
18.(15分)从能量的变化和反应的快慢等角度研究化学反应具有重要意义。
(1)已知一定条件下,反应N2+3H22NH3为放热反应;:
①下图能正确表示该反应中能量变化的是________;
7
②根据下表数据,计算生成1molNH3时该反应放出的热量为______kJ;
化学键
H-H
N≡N
N-H
断开1mol键所吸收的能量
436kJ
946kJ
391kJ
③一定温度下,将3molH2和1molN2通入容积为2 L的密闭容器中发生反应。若5min达到平衡,测得c(NH3)=0.4mol/L,则0至5min内N2的平均化学反应速率v(N2)=______,反应开始与平衡时气体的物质的量之比为__________;若达到平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0 ,请用p0、p来表示达到平衡时H2的转化率为__________。
④ 在③反应条件下,能够判断该反应已经达到化学平衡状态的是______________。
A.容器内混合气体密度不变
B.混合气体的压强不变
C.单位时间内生成n mol N2 的同时生成2n mol NH3
D. v (N2)=2v(NH3)
(2)原电池可将化学能转化为电能。由A、B、C、D四种金属按下表中装置进行实验:
①装置甲中SO向________ 极移动(填“A”或“B”);
②四种金属活动性由强到弱的顺序是 ;
③若装置丙中的电极为质量相等的铁棒和铜棒,电池工作一段时间后,取出洗净、干燥、称量,两电极质量差为6g,则导线中通过电子的物质的量为______mol。
19.(12 分)为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验.
实验I:反应产物的定性探究
按如图装置(固定装置已略去)进行实验
7
A装置的试管中发生反应的化学方程式是 ;B装置的作用是
E装置中的现象是 ;
(2)实验过程中,能证明无氢气生成的现象是 。
(3)F装置的烧杯中发生反应的离子方程式是 。
实验Ⅱ:反应产物的定量探究
(4)为测定硫酸铜的产率,将该反应所得溶液中和后配制成250.00 mL溶液,取该溶液25.00mL加入足量KI溶液中振荡,生成的I2恰好与20.00 mL 0.30 mol•L﹣1的Na2S2O3溶液反应,若反应消耗铜的质量为6.4g,则硫酸铜的产率为 。
(已知2Cu2++4I﹣=2CuI+I2, 2S2O32﹣+I2=S4O62﹣+2I﹣)
【注:硫酸铜的产率指的是硫酸铜的实际产量与理论产量的比值】
20.(12分)已知:A是石油裂解气的主要产物之一,其产量是衡量一个国家石油化工发展水平的标志。下列是有机物A~G之间的转化关系:
请回答下列问题:
(1)A、D中所含官能团的名称分别是______ _________ ;
C的结构简式是________________;
(2)E是一种具有香味的液体,由B + D→E的反应方程式为:______________,反应类型是________。
(3)G是一种高分子化合物,其结构简式是____________________________________;
(4)俄罗斯足球世界杯激战正酣,在比赛中当运动员肌肉扭伤时,队医立即对其受伤部位喷射物质F进行应急处理。写出由A制F的化学反应方程式:___________。
(5)H是E的同分异构体,且H能与NaHCO3反应,则H的结构简式可能为(写出2种):
_____________________________________________________________________。
7
高一期考理科化学答案
1-5 BCAAB 6-10ADBDB 11-15CACDC
16.(方程式2分,其余每空1分,共9分) Ⅰ.(1) 离子 (2) 极性
Ⅱ.(1)C (2)B (3)
(4)CH4+Cl2→CH3Cl+HCI
17、(方程式2分,其余每空1分,共7分)(1)石灰乳或氧化钙; Mg(OH)2+2H+=Mg2++2H2O;
(2)①坩埚;②2H++2I﹣+H2O2═I2+2H2O; ③丙
18、(共15分(1)①A (1分) ② 46(2分) ③ 0.04moI/(L·min) (2分)
5:4 (2分) ( 2P0-2P)/ P0 (2分) ④BC (2分)
(2)① A (1分) ② D>A>B>C(1分) 0.1 (2分)
19、(每空2分,共12分)((1)Cu+2H2SO4(浓)= CuSO4+SO2↑+2H2O
检验是否有水生成; 褪色
(2)D装置中黑色固体颜色无变化
(3)SO2+2OH﹣=SO32﹣+H2O
(4)60%
20.(共12分)
(1)碳碳双键 (1分)羧基(1分); CH3CHO(1分);
(2)CH3COOH + CH3CH2OHCH3COOCH2CH3 + H2O(2分)
取代反应或酯化反应(1分)
(3) (2分)
(4)CH2=CH2 + HCl CH3CH2Cl (2分)
(5)CH3 CH2 CH2COOH (1分)、(CH3)2 CHCOOH(1分)
7
相关文档
- 高中数学必修3教案:2_2用样本估计总2021-06-04 20:31:295页
- 高中开学演讲稿【五篇】2021-06-04 20:29:037页
- 2020高中物理 每日一题之快乐暑假 2021-06-04 20:28:254页
- 2020年高中语文第三单元第10课过秦2021-06-04 20:28:016页
- 2020学年高中物理 第五章 章交变电2021-06-04 20:27:477页
- 2020版高中历史 第4单元 中国特色2021-06-04 20:27:353页
- 高中数学讲义微专题36 向量的数量2021-06-04 20:26:558页
- 高中英语学业水平考试模拟卷二(附参2021-06-04 20:26:4312页
- 2020高中数学 第三章 指数函数与对2021-06-04 20:24:294页
- 高中化学 4_1《改善大气质量》课件2021-06-04 20:17:5839页