- 256.53 KB
- 2021-06-04 发布
题组34 综合实验探究专练
类型一 物质制备型实验题
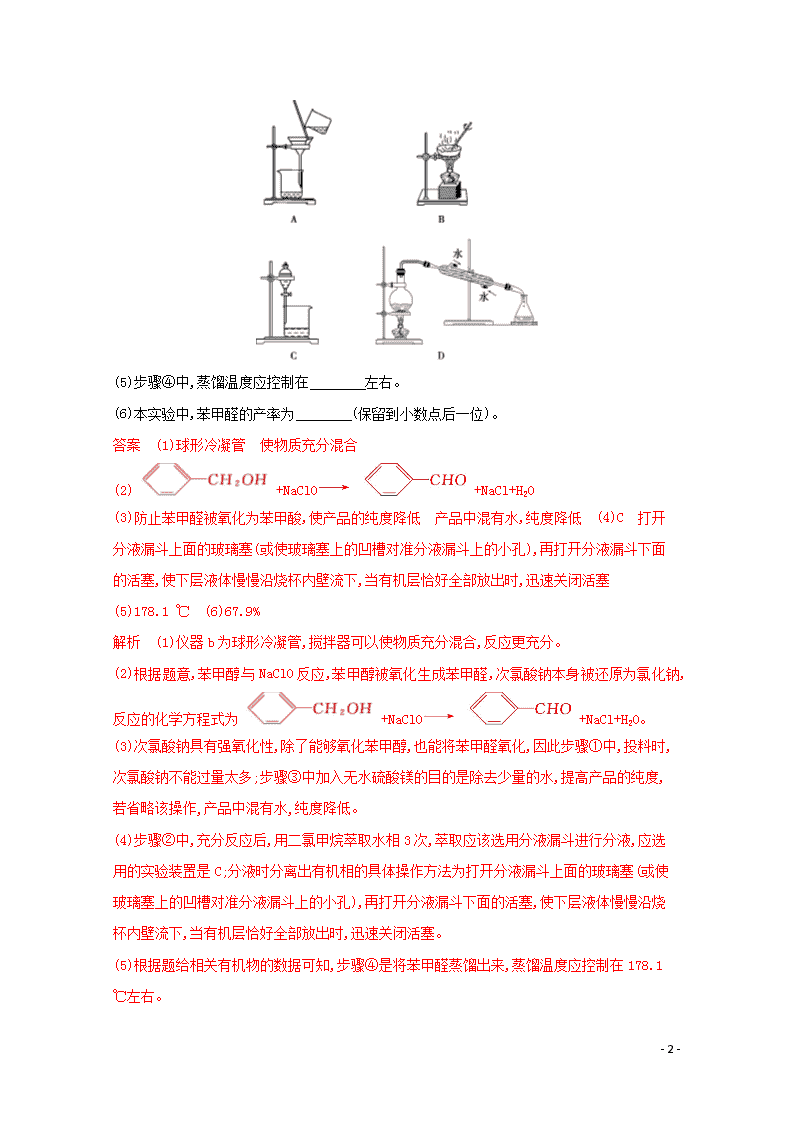
1.苯甲醛是一种重要的化工原料,某小组同学利用如图所示实验装置(夹持装置已略去)制备苯甲醛。
已知有机物的相关数据如下表所示:
有机物
沸点/℃
密度/
g·cm-3
相对分
子质量
溶解性
苯甲醛
178.1
1.04
106
微溶于水,易溶于乙醇、醚和卤代烃
苯甲醇
205.7
1.04
108
微溶于水,易溶于乙醇、醚和卤代烃
二氯甲烷
39.8
1.33
难溶于水,易溶于有机溶剂
实验步骤:
①向容积为500 mL的三颈烧瓶中加入90.0 mL质量分数为5%的次氯酸钠溶液(稍过量),调节溶液的pH为9~10后,加入3.0 mL苯甲醇、75.0 mL二氯甲烷,不断搅拌。
②充分反应后,用二氯甲烷萃取水相3次,并将有机相合并。
③向所得有机相中加入无水硫酸镁,过滤,得到有机混合物。
④蒸馏有机混合物,得到2.08 g苯甲醛产品。
请回答下列问题:
(1)仪器b的名称为 ,搅拌器的作用是 。
(2)苯甲醇与NaClO反应的化学方程式为 。
(3)步骤①中,投料时,次氯酸钠不能过量太多,原因是
;步骤③中加入无水硫酸镁,若省略该操作,可能造成的后果是
。
(4)步骤②中,应选用的实验装置是 (填序号),该操作中分离出有机相的具体操作方法是
。
- 8 -
(5)步骤④中,蒸馏温度应控制在 左右。
(6)本实验中,苯甲醛的产率为 (保留到小数点后一位)。
答案 (1)球形冷凝管 使物质充分混合
(2)+NaClO +NaCl+H2O
(3)防止苯甲醛被氧化为苯甲酸,使产品的纯度降低 产品中混有水,纯度降低 (4)C 打开分液漏斗上面的玻璃塞(或使玻璃塞上的凹槽对准分液漏斗上的小孔),再打开分液漏斗下面的活塞,使下层液体慢慢沿烧杯内壁流下,当有机层恰好全部放出时,迅速关闭活塞 (5)178.1 ℃ (6)67.9%
解析 (1)仪器b为球形冷凝管,搅拌器可以使物质充分混合,反应更充分。
(2)根据题意,苯甲醇与NaClO反应,苯甲醇被氧化生成苯甲醛,次氯酸钠本身被还原为氯化钠,反应的化学方程式为+NaClO +NaCl+H2O。
(3)次氯酸钠具有强氧化性,除了能够氧化苯甲醇,也能将苯甲醛氧化,因此步骤①中,投料时,次氯酸钠不能过量太多;步骤③中加入无水硫酸镁的目的是除去少量的水,提高产品的纯度,若省略该操作,产品中混有水,纯度降低。
(4)步骤②中,充分反应后,用二氯甲烷萃取水相3次,萃取应该选用分液漏斗进行分液,应选用的实验装置是C;分液时分离出有机相的具体操作方法为打开分液漏斗上面的玻璃塞(或使玻璃塞上的凹槽对准分液漏斗上的小孔),再打开分液漏斗下面的活塞,使下层液体慢慢沿烧杯内壁流下,当有机层恰好全部放出时,迅速关闭活塞。
(5)根据题给相关有机物的数据可知,步骤④是将苯甲醛蒸馏出来,蒸馏温度应控制在178.1 ℃左右。
- 8 -
(6)根据+NaClO +NaCl+H2O可知,1 mol苯甲醇理论上生成1 mol苯甲醛,则3.0 mL苯甲醇的质量为1.04 g·cm-3×3.0 cm3=3.12 g,其物质的量为3.12 g108 g·mol-1,则理论上生成苯甲醛的质量为3.12 g108 g·mol-1×106 g·mol-1,苯甲醛的产率=2.08 g3.12 g×106 g·mol-1108 g·mol-1×100%≈67.9%。
类型二 物质性质探究型实验题
2.某小组同学探究物质的溶解度大小与沉淀转化方向之间的关系。已知:
物质
BaSO4
BaCO3
AgI
AgCl
溶解度/g
(20 ℃)
2.4×10-4
1.4×10-3
3.0×10-7
1.5×10-4
(1)探究BaCO3和BaSO4之间的转化,实验操作如下:
试剂A
试剂B
试剂C
加入盐酸后的现象
实验Ⅰ
BaCl2
Na2CO3
Na2SO4
……
实验Ⅱ
Na2SO4
Na2CO3
有少量气泡产生,沉淀部分溶解
①实验Ⅰ说明BaCO3全部转化为BaSO4,依据的现象是加入盐酸后, 。
②实验Ⅱ中加入稀盐酸后发生反应的离子方程式是 。
③实验Ⅱ说明沉淀发生了部分转化,结合BaSO4的沉淀溶解平衡解释原因:
。
(2)探究AgCl和AgI之间的转化
实验Ⅲ:
实验Ⅳ:在试管中进行溶液间反应时,同学们无法观察到AgI转化为AgCl,于是又设计了如下实验(电压表读数:a>c>b>0)。
- 8 -
装置
步骤
电压表读数
ⅰ.如图连接装置并加入试剂,闭合K
a
ⅱ.向B中滴入AgNO3(aq),至沉淀完全
b
ⅲ.再向B中投入一定量NaCl(s)
c
ⅳ.重复i,再向B中加入与ⅲ等量NaCl(s)
a
注:其他条件不变时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大;离子的氧化性(或还原性)强弱与其浓度有关。
①实验Ⅲ证明了AgCl转化为AgI,甲溶液可以是 (填序号)。
a.AgNO3溶液 b.NaCl溶液 c.KI溶液
②实验Ⅳ的步骤ⅰ中,B中石墨上的电极反应式是 。
③结合信息,解释实验Ⅳ中bb说明加入Cl-使c(I-)增大,证明发生了反应AgI+Cl- AgCl+I-
解析 (1)①因为BaCO3能溶于盐酸,放出CO2气体,BaSO4不溶于盐酸,所以实验Ⅰ说明BaCO3全部转化为BaSO4,依据的现象是加入盐酸后,沉淀不溶解或无明显现象;②实验Ⅱ加入稀盐酸有少量气泡产生,沉淀部分溶解,说明BaCO3和盐酸发生反应,离子方程式为BaCO3+2H+ Ba2++CO2↑+H2O;③实验Ⅱ中A溶液为0.1 mol/L BaCl2溶液,B溶液为0.1 mol/L的Na2SO4溶液,先发生反应Ba2++SO42- BaSO4↓,所以溶液中存在着BaSO4(s) Ba2+(aq)+SO42-(aq),当加入浓度较高的Na2CO3溶液,CO32-与Ba2+结合生成BaCO3沉淀,使上述平衡向右移动,所以BaSO4沉淀也可以转化为BaCO3沉淀。
(2)①甲溶液可以是NaCl溶液,滴入少量的AgNO3溶液后产生白色沉淀,再滴入KI溶液有黄色沉淀产生,说明有AgCl转化为AgI;②实验Ⅳ的步骤ⅰ中,B中为0.01 mol/L的KI溶液,A中为0.1 mol/L的AgNO3溶液,Ag+具有氧化性,作原电池的正极,I-
- 8 -
具有还原性,作原电池的负极,所以B中石墨上的电极反应式是2I--2e- I2;③B中加入AgNO3溶液后,产生了AgI沉淀,使B溶液中c(I-)减小,I-还原性减弱,根据已知其他条件不变时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大,所以实验Ⅳ中bb,说明发生了AgI+Cl- AgCl+I-反应,平衡向右移动,c(I-)增大。
类型三 物质组成定量测定型实验题
3.有机物的元素定量分析最早是由德国人李比希提出的,某实验室模拟李比希法测定某种氨基酸(CxHyOzNp)的分子组成。取一定量的该氨基酸放在纯氧气中燃烧,燃烧后生成的水用装置D(无水氯化钙)吸收,二氧化碳用装置C(KOH浓溶液)吸收,N2的体积用装置E进行测量,所需装置如图所示(夹持仪器的装置及部分加热装置已略去):
(1)该实验装置的合理连接顺序为:A、 、E(部分装置可以重复选用)。
(2)实验开始时,首先打开止水夹a,关闭止水夹b,通一段时间的纯氧,这样做的目的是 。
(3)A中放入CuO的作用是 ,装置B的作用是
。
(4)为了确定此氨基酸的分子式,除了准确测量N2的体积、生成二氧化碳和水的质量外,还需得到的数据有 。
(5)在读取E装置中所排水的体积时,液面左低右高,则所测气体的体积 (填“偏大”“偏小”或“无影响”)。
(6)已知分子式为C2H4O2的有机物也含有氨基酸中的某个官能团,请设计实验证明该官能团(试剂任选): 。
- 8 -
答案 (1)DCDB (2)将装置中的N2(或空气)排除干净 (3)将未充分燃烧的产物CO转化为CO2(或使氨基酸中的碳完全转化为CO2) 除去多余的O2,保证E装置最终收集的气体全为N2 (4)该氨基酸的摩尔质量 (5)偏小 (6)取该有机物少许于试管中,滴加NaHCO3溶液,有气泡产生(或其他合理答案)
解析 用燃烧法测定某种氨基酸(CxHyOzNp)的分子组成,用氧气氧化氨基酸(CxHyOzNp)生成二氧化碳、水和氮气,利用装置D(无水氯化钙)测定水的质量,利用装置C(KOH浓溶液)测定二氧化碳的质量,利用装置E测量N2的体积,从而求出氨基酸中含有的C、H、O、N的质量,进而求出该氨基酸的分子组成。
(1)根据以上分析,应先吸收水,再吸收CO2,最后测量N2体积,装置B中加热的铜网可除去多余的O2,保证装置E最终收集的气体全为N2,所以该实验装置的合理连接顺序为A、D、C、D、B、E。
(2)装置内的空气中含有N2、CO2和H2O,实验开始前需通一段时间的纯氧,将装置中的N2(或空气)排除干净,减小实验误差。
(4)根据上面的分析可知,为了确定此氨基酸的分子式,除了准确测量生成二氧化碳气体的质量、生成水的质量、N2的体积外,还需得到的数据是该氨基酸的摩尔质量。
(5)如果液面左低右高(即瓶中液面低于量筒中液面)说明集气瓶中压强大于外界大气压,气体体积被压缩,实际测得的气体体积偏小。
(6)根据分子式为C2H4O2及氨基酸中的官能团可知,该分子中有羧基,实验证明该官能团的方法为取该有机物少许于试管中,滴加NaHCO3溶液,有气泡产生。
类型四 方案的设计与评价类实验题
4.FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性。
Ⅰ.实验室制备FeBr2
实验室用如图所示装置制取溴化亚铁。其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管,e是两个耐高温的瓷皿,其中盛有细铁粉。
- 8 -
实验开始时,先将铁粉加热至600~700 ℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始。不断将d中液溴滴入温度为100~120 ℃的D中。经过几小时的连续反应,在E管的一端沉积有黄绿色鳞片状溴化亚铁。
(1)若在A中盛固体CaCO3,a中盛6 mol/L盐酸。为使导入D中的CO2为干燥纯净的气体,则图中B、C处的装置和其中的试剂应是:B为 ,C为 。为防止污染空气,实验时应在F处连接盛 的尾气吸收装置。
(2)反应过程中要不断通入CO2,其主要作用是
。
Ⅱ.探究FeBr2的还原性
(3)实验需要200 mL 0.1 mol/L FeBr2溶液,配制FeBr2溶液除烧杯、量筒、胶头滴管、玻璃棒外,还需要的玻璃仪器是 ,需称量FeBr2的质量为 。
(4)取10 mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+
设计实验证明假设2是正确的: 。
(5)请用一个离子方程式来证明还原性Fe2+>Br-: 。
(6)若在40 mL上述FeBr2溶液中通入3×10-3 mol Cl2,则反应的离子方程式为
。
答案 (1)盛有饱和NaHCO3溶液的洗气瓶 盛有浓H2SO4的洗气瓶 NaOH溶液 (2)用CO2把装置中的空气赶尽,同时将溴蒸气带入E管中 (3)250 mL容量瓶 5.4 g (4)取适量黄色溶液,向其中加入少量KSCN溶液,若溶液变为红色,则证明假设2正确 (5)2Fe2++Br2 2Fe3++2Br- (6)4Fe2++2Br-+3Cl2 4Fe3++Br2+6Cl-
解析 (1)实验时用碳酸钙和盐酸制取二氧化碳,盐酸易挥发,制得的二氧化碳中混有氯化氢气体和水蒸气,装置B的作用是除去二氧化碳中的氯化氢气体,可以用盛有饱和NaHCO3溶液的洗气瓶洗气,装置C的作用是干燥二氧化碳,可以用盛有浓H2SO4的洗气瓶干燥;溴蒸气有毒,不能排到空气中,氢氧化钠溶液能够与溴单质反应,为防止污染空气,实验时应在F处连接盛有氢氧化钠溶液的尾气吸收装置。(2)反应前先通入一段时间CO2,将装置中的空气赶尽,避免空气中的氧气干扰实验;反应过程中要不断通入CO2
- 8 -
,将装置D中的溴蒸气带入E管中,使溴能够与铁粉充分反应。(3)配制200 mL 0.1 mol/L FeBr2溶液所需的玻璃仪器有烧杯、量筒、胶头滴管、玻璃棒和250 mL容量瓶;250 mL 0.1 mol/L FeBr2溶液中FeBr2的物质的量为0.025 mol,则FeBr2的质量为0.025 mol×216 g/mol=5.4 g。(4)若假设2正确,向FeBr2溶液中滴加少量新制的氯水,Fe2+被Cl2氧化成Fe3+,向反应后的黄色溶液中加入KSCN溶液,溶液会变为红色。(5)溶液中Fe2+和Br2能够发生氧化还原反应生成Fe3+和Br-,反应的离子方程式为2Fe2++Br2 2Fe3++2Br-。(6)40 mL 0.1 mol/L FeBr2溶液中FeBr2的物质的量为0.004 mol,0.004 mol Fe2+消耗Cl2的物质的量为0.002 mol,则3×10-3 mol Cl2中有0.001 mol Cl2与Br-反应,反应消耗Br-的物质的量为0.002 mol,参与反应的Fe2+、Br-和Cl2的物质的量之比为0.004 mol∶0.002 mol∶0.003 mol=4∶2∶3,则反应的离子方程式为4Fe2++2Br-+3Cl2 4Fe3++Br2+6Cl-。
- 8 -