- 240.00 KB
- 2021-06-02 发布
康杰中学2017—2018学年度第一学期第二次月考
高二化学试题
2018.1
相对原子质量;H-1 C-12 N-14 O-16 Na-23 S-32 Cl-35.5 K-39
Fe-56 Cu-64 Mn-55
一、选择题(在每题给出的四个选项中,只有一个选项符合题意。每题3分,共60分)
1.下列有关说法错误的是
A.电解质溶液导电,SO2使品红褪色,缓慢氧化,酸碱指示剂变色一定都属于化学变化
B.钢铁在海水中比在河水中更易被腐蚀,主要原因是海水含氧量高
C.“看似风平浪静,实则暗流涌动”形象地描述了溶解平衡的状态
D.FeSO4溶液存放在加有少量铁粉和稀硫酸的试剂瓶中
2. 下面有关“核外电子的运动状态”的说法,错误的是
A. 各原子轨道的伸展方向种数按p、d、f的顺序分别为3、5、7
B. 在一个多电子原子中,N层上的电子能量肯定比M层上的电子能量高
C. 氮原子核外电子的运动状态有7种
D. 原子轨道伸展方向与能量大小是无关的
3.下列事实能说明甲酸属于弱酸的是
①1mol/L HCOOH溶液的pH=2 ②甲酸能与水以任意比互溶
③20mL 1mol/L HCOOH溶液与20mL 1mol/L NaOH溶液恰好中和
④HCOONa溶液的pH>7
A. ①② B. ②③ C. ③④ D. ①④
4.室温下,下列各组离子在指定的环境中一定能大量存在的是
A.1×10-12的溶液中:SO42—、Fe3+、Na+、Cl—
B.能使石蕊试纸变蓝色的溶液中:Na+、K+、S2—、CO32—
C.加入铝粉能产生H2的溶液中:NH4+、Na+、Fe2+、NO3—
D.水电离出的c(H+)=1×10-12mol/L的溶液中: K+、Na+、Cl—、OH—
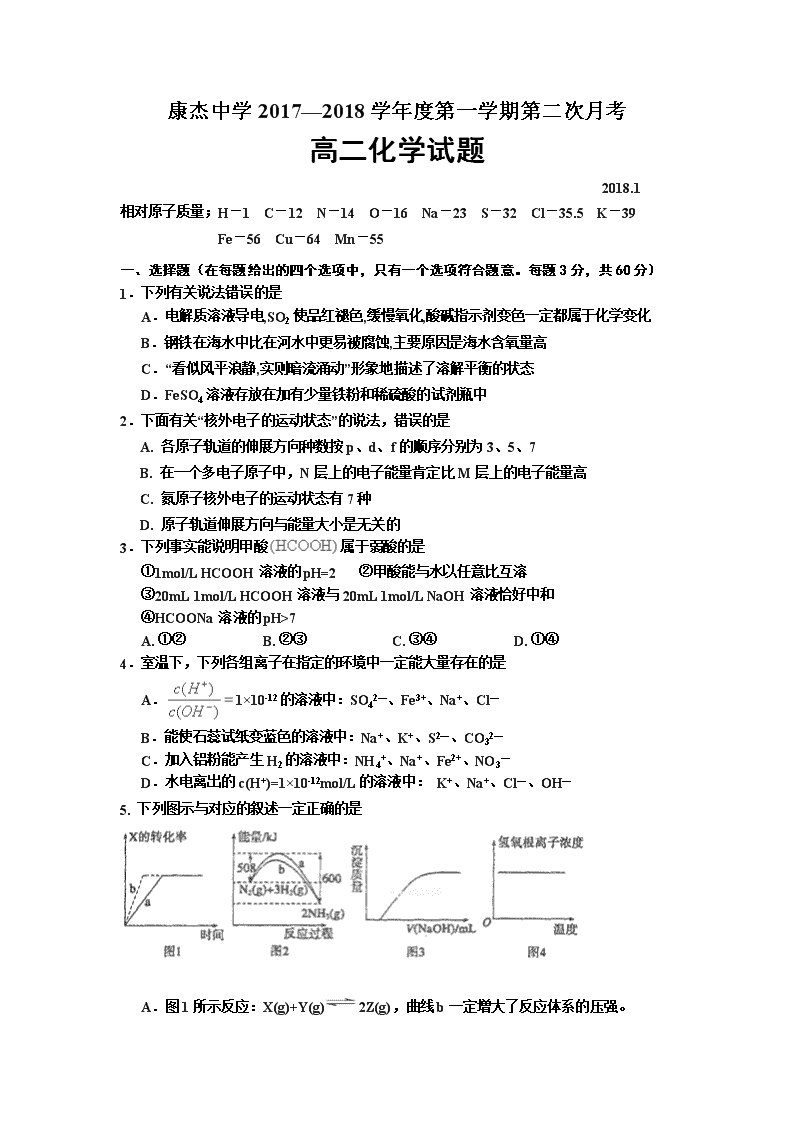
5. 下列图示与对应的叙述一定正确的是
A.图1所示反应:X(g)+Y(g) 2Z(g),曲线b一定增大了反应体系的压强。
B.图2表明合成氨反应是放热反应,b表示在反应体系中加入了催化剂
C.图3表示向Ca(HCO3)2溶液中滴入NaOH溶液所得沉淀的质量变化
D.图4表示明矾溶液受热时氢氧根离子浓度随温度的变化
6.对于可逆反应2AB3(g) A2(g) + 3B2(g) ΔH>0,下列图像正确的是
7. 下列溶液中有关微粒的物质的量浓度关系正确的是
A. 常温下,等物质的量浓度的三种溶液①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2中c(NH4+):①<③<②
B. 0.2mol/L HCN溶液与0.1mol/L NaOH溶液等体积混合后,溶液显碱性,则:
c (HCN) < c (CN-)
C. 常温下,将醋酸钠、盐酸两溶液混合呈中性的溶液中:c(Na+)>c(Cl-)>c(CH3COOH)
D. pH=2的HA溶液与pH=12的MOH溶液以任意比混合:
c(H+)+c(M+)=c(OH-)+c(A-)
8. 下列有关实验现象和解释或结论都正确的是
选项
实验操作
现象
解释或结论
A
向盛有10mL 0.1 mol·L-1 AgNO3溶液的试管中滴加1mL 0.1 mol·L-1 NaCl溶液,产生白色沉淀,再向其中滴加0.1 mol·L-1 Na2S溶液
有黑色沉淀出现
Ag2S比AgI更难溶
B
向浓度均为0.1 mol·L-1
NaCl和NaI混合溶液中滴加少量AgNO3溶液
出现黄色沉淀
Ksp(AgCl)>Ksp(AgI)
C
将NO2球浸泡在热水中
红棕色变浅
反应2NO2N2O4的△H<0
D
向AgCl沉淀中滴加KI溶液
白色沉淀变为黄色
溶度积:AgCl比AgI更小
9.现有四种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4 ②1s22s22p63s23p3③1s22s22p3 ④1s22s22p5
则下列有关比较中正确的是
A.第一电离能:④>③>②>① B.原子半径:④>③>②>①
C.电负性:④>③>②>① D.最高正化合价:④>③=②>①
10. 下列物质的分子中既有σ键,又有键的是
①HCHO ②H2O ③HSCN ④H2O2 ⑤C2H4 ⑥CO2
A.①②③ B.③④⑤⑥ C.①③⑤⑥ D.①③⑥
11. 研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为5MnO2+2Ag+2NaClNa2Mn5O10+2AgCl,下列“水”电池在海水中放电时的有关说法正确的是
A. 正极反应式为Ag+Cl--e-AgCl B. 每生成1 mol Na2Mn5O10转移2 mol电子
C. Na+不断向“水”电池的负极移动 D. AgCl是还原产物
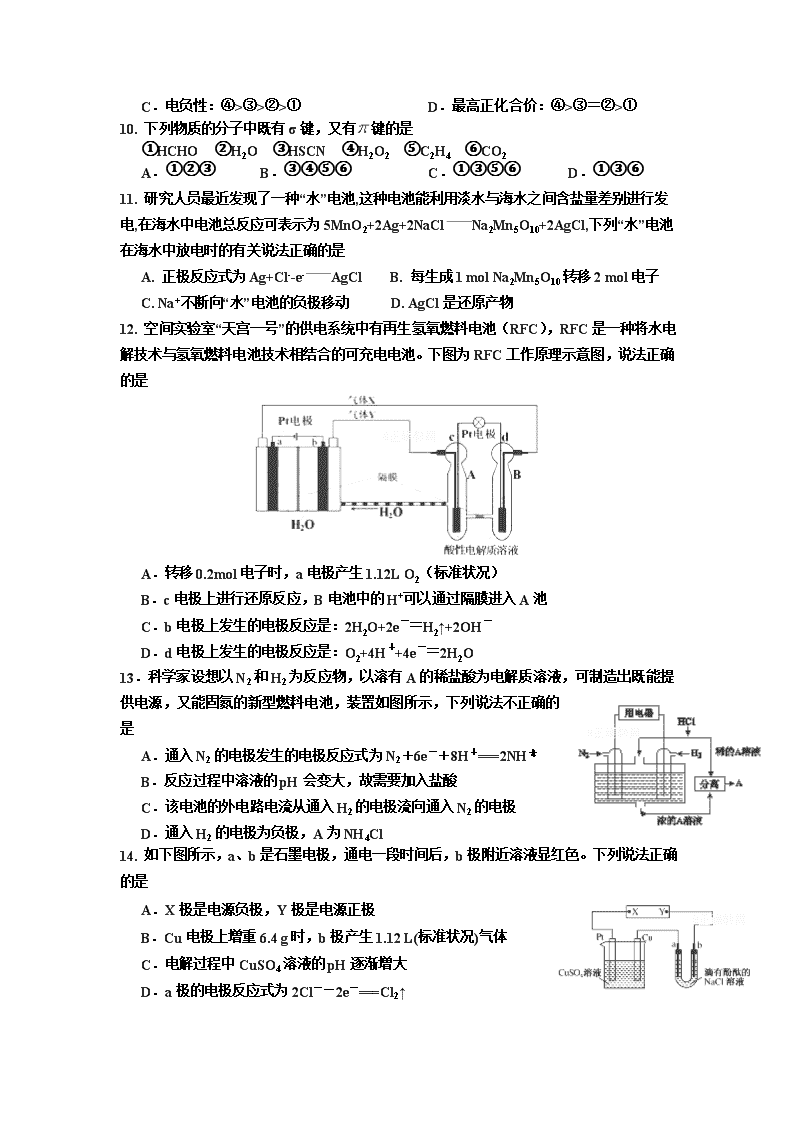
12. 空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,说法正确的是
A.转移0.2mol电子时,a电极产生1.12L O2(标准状况)
B.c电极上进行还原反应,B电池中的H+可以通过隔膜进入A池
C.b电极上发生的电极反应是:2H2O+2e-=H2↑+2OH-
D.d电极上发生的电极反应是:O2+4H++4e-=2H2O
13.科学家设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电源,又能固氮的新型燃料电池,装置如图所示,下列说法不正确的是
A.通入N2的电极发生的电极反应式为N2+6e-+8H+===2NH
B.反应过程中溶液的pH会变大,故需要加入盐酸
C.该电池的外电路电流从通入H2的电极流向通入N2的电极
D.通入H2的电极为负极,A为NH4Cl
14. 如下图所示,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法正确的是
A.X极是电源负极,Y极是电源正极
B.Cu电极上增重6.4 g时,b极产生1.12 L(标准状况)气体
C.电解过程中CuSO4溶液的pH逐渐增大
D.a极的电极反应式为2Cl--2e-===Cl2↑
15. 室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是
A. 溶液中导电粒子的数目减少
B. 溶液中不变
C. 醋酸的电离程度增大,c(H+)亦增大
D. 再加入10 mL pH=11的NaOH溶液,混合液pH=7
16.在下列各组的比较中,前者比后者大的是
A.25 ℃时,pH均为2的H2SO4溶液和盐酸中氢离子的物质的量浓度
B.25 ℃时,pH均为2的盐酸和CH3COOH溶液中溶质的物质的量浓度
C. 同温度、同浓度的NaCl溶液和氨水的导电能力
D. 25 ℃时,pH均为3的盐酸和FeCl3溶液中水的电离程度
17. 已知NaHSO3溶液呈酸性、NaHCO3溶液呈碱性。现有浓度均为0.1 mol·L-1的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中一定正确的是
A.c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-)
B.c(Na+)+c(H+)=c(HRO3-)+c(RO32-)+c(OH-)
C.c(H+)+c(H2RO3)=c(RO32-)+c(OH-)
D.两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等
18. 室温下,将1.000 mol·L-1盐酸滴入20.00 mL 1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如下图所示。下列有关说法正确的是
A. a点由水电离出的c(H+)=1.0×10-14 mol·L-1
B. b点:c(NH)+c(NH3·H2O)=c(Cl-)
C. c点:c(Cl-)=c(NH)
D. d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
19. 工业上可用“四室电渗析法”制备一元中强酸H3PO2,工作原理如图所示,图中X、Y代表阳膜或阴膜,阳膜和阴膜分别只允许阳离子、阴离子通过,电极M和N材质均为石墨。下列说法错误的是
A. NaH2PO2溶液一定呈碱性
B.图中X为阳膜,Y为阴膜
C.电极M上的反应为:4OH--4e- O2↑ + 2H2O
D.电解过程中,H+ 会从阳极室穿过X膜扩散至产品室,Na+会从阴极室扩散至原料室
20.设NA为阿伏加德罗常数的数值,下列说法错误的是
A. 一定条件下,2mol SO2和1mol O2混合在密闭容器中充分反应后容器中的分子数大于2NA
B. 256g S8分子中含S−S键为7NA个
C. 由1mol CH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA个
D. 1 mol Na与O2完全反应,生成Na2O和Na2O2的混合物,转移电子总数为NA个
二、非选择题(本题包括4小题,共40分)
21.(10分)已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期。A位于周期表的s区,其电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子最外层电子数是次外层电子数的3倍。E有“生物金属”之称,E4+和氩原子的核外电子排布相同。
请回答下列问题:
(1)B、C、D三种元素的电离能由小到大的顺序为______________(填元素符号,下同)
(2)E在周期表中的位置__________;其基态原子的电子排布式为______________。
(3)D原子核外共有_____个未成对电子,能量最高的电子为______轨道上的电子,其轨道呈______形。
(4)BD2的电子式为_______;与BD32-互为等电子体的分子是_______,阴离子是_____(填化学式)。
22.(10分)(1)图1是某研究机构开发的给笔记本电脑供电的甲醇燃料电池,电池总反应为2CH3OH+3O2 + 4KOH===2K2CO3+6H2O。一个甲醇分子经过电化学氧化,可以产生________个电子的电量,其负极的电极反应式为________________________。
(2)用间接电化学法除去NO的过程如图2所示。
已知电解池的阴极室中溶液的pH在4~6之间,写出阴极的电极反应式:_______________________________。
(3)我国的科技人员为了消除SO2的污染,利用原电池原理,变废为宝,设计由SO2和O2来制备硫酸,设计装置如图3所示,电极A、B为多孔的材料。
A极为________(填“正极”或“负极”)。B极的电极反应式是__________________________________。
(4)用石墨作电极电解含有0.1mol CuSO4和0.1mol NaCl的混合溶液100 mL,当溶液中的Cu2+全部转化为Cu时,阳极产生的气体的物质的量为________;将电解后的溶液加水稀释至1L,此时溶液的pH=________。
23.(10分)Ⅰ. 氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用。请回答下列问题:
(1)氮的氧化物与悬浮在大气中的海盐颗粒相互作用时,涉及如下反应:
(I)2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g) K1 ΔH1<0
(II)2NO(g)+Cl2(g)2ClNO(g) K2 ΔH2<0
4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=________(用K1、K2表示)。
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10 min后反应(Ⅱ)达到平衡。测得10 min内v(ClNO)=8.0×10-3mol/(L·min),则NO的转化率α1=________。其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2________ α1(填“>”“<”或“=”),平衡常数K2________(填“增大”“减小”或“不变”)。
Ⅱ. 常温下,向100mL 0.01mol/L的HA溶液中逐滴加入0.02mol/L的MOH溶液,图中所示的曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。回答下列问题:
(1)由图中信息可知HA为 酸(填“强”或“弱”);
(2)请写出K点所对应的溶液中离子浓度的大小关系:________ ;
(3)常温下一定浓度的MA稀溶液的pH=a,则溶液中水电离出的c(OH—)= ________;
若加水稀释10倍后pH=b,则a_____b-1 (填“>”“ <”或“=”)
24.(10分)工业上以软锰矿(主要成分MnO2)为原料,通过液相法生产KMnO4。即在碱性条件下用氧气氧化MnO2得到K2MnO4,分离后得到的K2MnO4,再用惰性材料为电极电解K2MnO4溶液得到KMnO4,其生产工艺简略如下:
(1)反应器中反应的化学方程式为______________________________________。
(2)生产过程中最好使用含MnO2 80%以上的富矿,因为MnO2含量低的贫矿中Al、Si的氧化物含量较高,会导致KOH消耗量________(填“偏高”或“偏低”)。
(3)电解槽中阳极的电极反应式为:___________________,总的离子反应方程式为____________________________________________。
(4)用高锰酸钾测定草酸结晶水合物(H2C2O4·2H2O)的纯度:称草酸晶体样品0.500 g溶于水配制成100 mL溶液,取出20.00 mL用0.020 0 mol·L-1的酸性KMnO4溶液滴定(杂质不反应),至溶液呈浅粉红色且半分钟内不褪去,消耗KMnO4溶液10.00 mL,则该草酸晶体的纯度为________。(结果保留3位有效数字)(已知该草酸结晶水合物的相对分子质量为126)
高二化学答案
一、选择题(在每题给出的四个选项中,只有一个选项符合题意。每题3分,共60分)
1
2
3
4
5
6
7
8
9
10
B
B
D
B
B
A
D
B
A
C
11
12
13
14
15
16
17
18
19
20
B
B
C
D
B
C
C
C
D
B
二、非选择题(本题包括4小题,共40分)
21.(9分)(每空各1分)
(1)C c(A-) > c(OH-) > c(H+) (2分)
(3) 1×10-a mol/L (1分) > (1分)
24. (9分)
(1) 4KOH+2MnO2+O2===2K2MnO4+2H2O (2分)
(2) 偏高(1分)
(3) MnO— e-= MnO (2分) 2MnO+2H2O2MnO+2OH-+H2↑(2分)
(4) 63.0%(2分)