- 611.57 KB
- 2021-06-02 发布
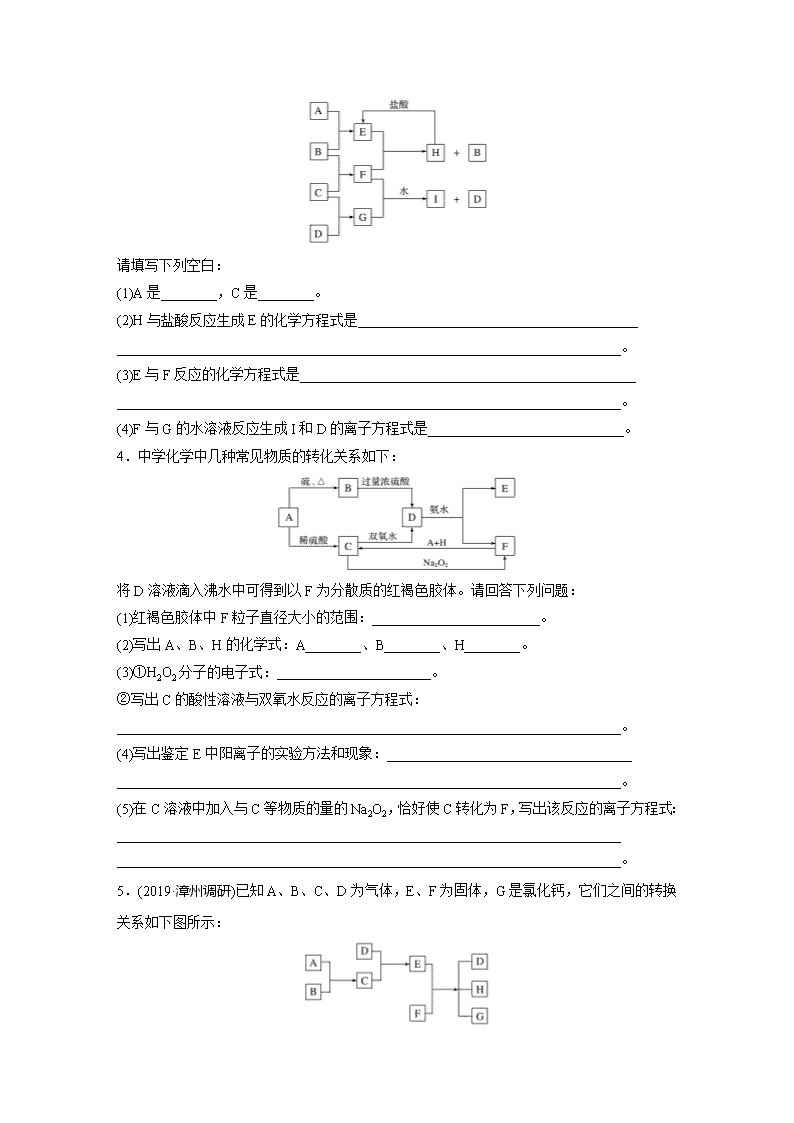
1.(2020·黄冈调研)已知 A~I 均为中学化学中的常见物质,它们之间的转化关系如图所示,
其中 A、D 为金属单质,反应过程中需要或生成的水及其他部分产物已略去。
请回答以下问题:
(1)B 和 F 分别是____________________(填化学式)。
(2)写出下列反应的化学方程式。
①A 与 B 在高温下反应:____________________________________________________。
②H 在空气中转化为 I:______________________________________________________。
(3)E 溶液中所有离子浓度由大到小的顺序是______________________________________
________________________________________________________________________。
(4)用离子方程式表示 G 溶液呈酸性的原因:_______________________________________
________________________________________________________________________;
该反应的平衡常数为__________________(已知常温下,H 的溶度积常数 Ksp=8.0×10-16)。
2.以下一些氧化物和单质之间可发生如下图所示的反应:其中,氧化物Ⅰ是红棕色固体,氧
化物Ⅱ、Ⅲ、Ⅳ在反应条件下都是气体。
(1)氧化物Ⅰ的化学式是__________,氧化物Ⅱ的化学式是____________。
(2) 反 应 ① 的 化 学 方 程 式 是 ________________________ ; 反 应 ② 的 化 学 方 程 式 是
__________________________;反应③的化学方程式是____________________________。
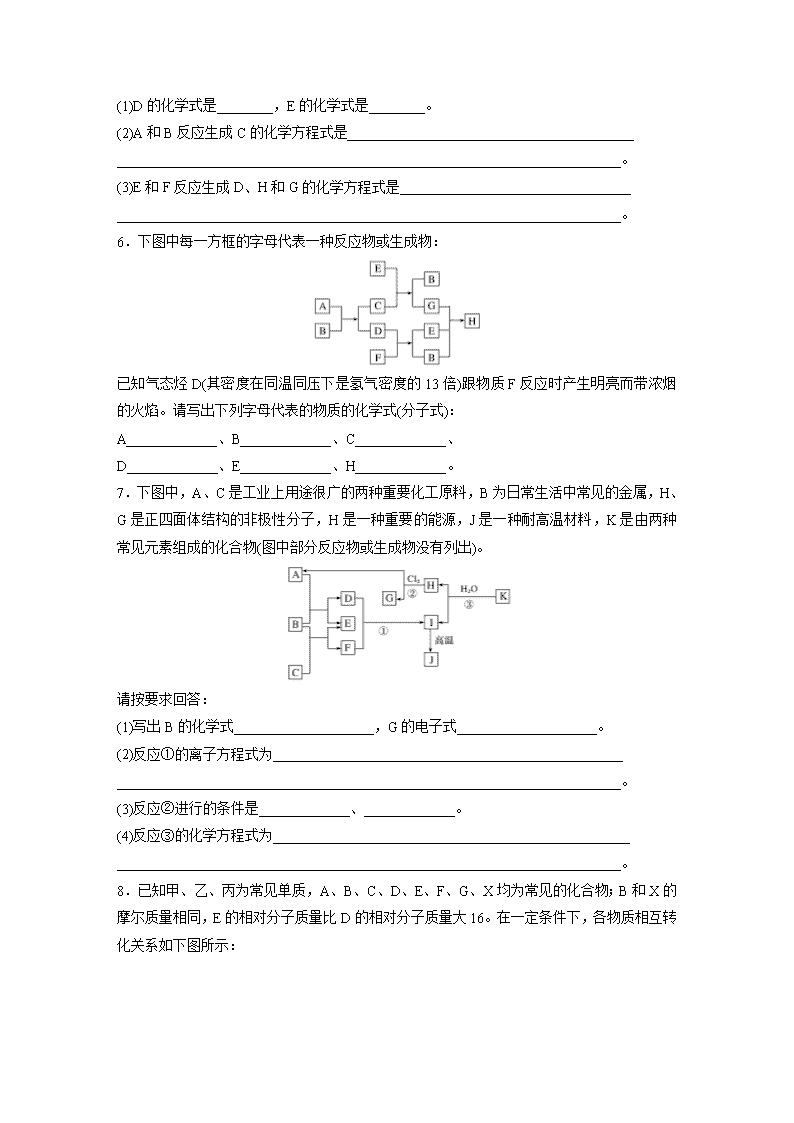
3.A、B、C、D 是按原子序数由小到大排列的第二、三周期元素的单质。B、E 均为组成空
气的成分。化合物F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1∶2。
在一定条件下,各物质之间的相互转化关系如下图(图中部分产物未列出):
请填写下列空白:
(1)A 是________,C 是________。
(2)H 与盐酸反应生成 E 的化学方程式是________________________________________
________________________________________________________________________。
(3)E 与 F 反应的化学方程式是________________________________________________
________________________________________________________________________。
(4)F 与 G 的水溶液反应生成 I 和 D 的离子方程式是____________________________。
4.中学化学中几种常见物质的转化关系如下:
将 D 溶液滴入沸水中可得到以 F 为分散质的红褐色胶体。请回答下列问题:
(1)红褐色胶体中 F 粒子直径大小的范围:________________________。
(2)写出 A、B、H 的化学式:A________、B________、H________。
(3)①H2O2 分子的电子式:______________________。
②写出 C 的酸性溶液与双氧水反应的离子方程式:
________________________________________________________________________。
(4)写出鉴定 E 中阳离子的实验方法和现象:___________________________________
________________________________________________________________________。
(5)在 C 溶液中加入与 C 等物质的量的 Na2O2,恰好使 C 转化为 F,写出该反应的离子方程式:
________________________________________________________________________
________________________________________________________________________。
5.(2019·漳州调研)已知 A、B、C、D 为气体,E、F 为固体,G 是氯化钙,它们之间的转换
关系如下图所示:
(1)D 的化学式是________,E 的化学式是________。
(2)A 和 B 反应生成 C 的化学方程式是_________________________________________
________________________________________________________________________。
(3)E 和 F 反应生成 D、H 和 G 的化学方程式是_________________________________
________________________________________________________________________。
6.下图中每一方框的字母代表一种反应物或生成物:
已知气态烃 D(其密度在同温同压下是氢气密度的 13 倍)跟物质 F 反应时产生明亮而带浓烟的
火焰。请写出下列字母代表的物质的化学式(分子式):
A_____________、B_____________、C_____________、
D_____________、E_____________、H_____________。
7.下图中,A、C 是工业上用途很广的两种重要化工原料,B 为日常生活中常见的金属,H、
G 是正四面体结构的非极性分子,H 是一种重要的能源,J 是一种耐高温材料,K 是由两种
常见元素组成的化合物(图中部分反应物或生成物没有列出)。
请按要求回答:
(1)写出 B 的化学式____________________,G 的电子式____________________。
(2)反应①的离子方程式为__________________________________________________
________________________________________________________________________。
(3)反应②进行的条件是_____________、_____________。
(4)反应③的化学方程式为___________________________________________________
________________________________________________________________________。
8.已知甲、乙、丙为常见单质,A、B、C、D、E、F、G、X 均为常见的化合物;B 和 X 的
摩尔质量相同,E 的相对分子质量比 D 的相对分子质量大 16。在一定条件下,各物质相互转
化关系如下图所示:
(1)写出 X 的电子式和 G 的化学式:X______________,G________________。
(2)写出有关变化的化学方程式:
B+H2O:____________________________________________________________________;
D+丙:________________________________________________________________________。
9.(2019·安庆质检)有一化合物 X,其水溶液为浅绿色,可发生如下的转化关系(部分反应物、
生成物已略)。其中 B、D、E、F 均为无色气体,M、L 为常见的金属单质,C 为难溶于水的
红褐色固体。在混合液中加入 BaCl2 溶液可生成不溶于稀盐酸的白色沉淀,H 和 M 反应可放
出大量的热。
请回答下列问题:
(1)B 的电子式为__________________。
(2)画出元素 M 的原子结构示意图___________________________________________。
(3)物质 X 的化学式为_____________________________________________________。
(4)电解混合液时阳极反应式为_______________________________________________
________________________________________________________________________。
(5)按要求写出上述转化关系中有关反应的化学方程式:
①含有 L 元素的化合反应:________________________________________________
________________________________________________________________________。
②含有 L 元素的置换反应:_________________________________________________
________________________________________________________________________。
(6)已知 a g E 气体在 D 中完全燃烧生成稳定的化合物时,放出 b kJ 的热量,写出 E 气体燃烧
热的热化学方程式为_______________________________________________________
________________________________________________________________________。
答案精析
1.(1)Fe2O3、Al(OH)3 (2)①Fe2O3+2Al=====
高温
2Fe+Al2O3
②4Fe(OH)2+2H2O+O2===4Fe(OH)3
(3)c(Na+)>c(AlO-
2 )>c(OH-)>c(H+)
(4)Fe2++2H2O Fe(OH)2+2H+ 1.25×10-13
解析 根据框图中转化关系及题干信息,可以确定 I 为氢氧化铁。A、D 为金属单质,根据 A
和 B 的反应条件就可以联想到铝热反应,推测 A、D 分别为铝和铁,则 B 为氧化铁,C 为氧
化铝,E 为偏铝酸钠,G 为氯化亚铁,F 为氢氧化铝,H 为氢氧化亚铁。偏铝酸钠水解使溶
液呈碱性,所以溶液中离子浓度的大小顺序为 c(Na+)>c(AlO-
2 )>c(OH-)>c(H+);FeCl2 溶液
中,Fe2+发生水解:Fe2++2H2O Fe(OH)2+2H+,平衡常数 K=c2H+
cFe2+
= c2H+·c2OH-
cFe 2+·c2OH-
=1.0×10-142
8.0×10-16
=1.25×10-13。
2.(1)Fe2O3 CO (2)Fe2O3+3CO=====
高温
2Fe+3CO2
CO+H2O(g)=====
高温
CO2+H2 C+H2O(g)=====
高温
CO+H2
3 . (1) 碳 ( 或 C) 钠 ( 或 Na) (2)Na2CO3 + 2HCl===2NaCl + H2O + CO2↑ (3)2CO2 +
2Na2O2===2Na2CO3+O2 (4)Na2O2+S2-+2H2O===4OH-+S↓+2Na+
4.(1)1~100 nm (2)Fe FeS H2SO4
(3)① ②2Fe2++H2O2+2H+===2Fe3++2H2O
(4)取少量 E 于试管中,用胶头滴管滴入 NaOH 溶液,加热试管,可观察到试管口处湿润的红
色石蕊试纸变蓝(或其他合理答案)
(5)4Fe2++4Na2O2+6H2O===4Fe(OH)3↓+O2↑+8Na+
解析 本题的突破口为“D 溶液滴入沸水中可得到以 F 为分散质的红褐色胶体”,可推断 D
溶液中含有 Fe3+,进而推知 A 为 Fe,B 为 FeS,C 为 FeSO4,D 为 Fe2(SO4)3,F 为 Fe(OH)3,
H 为 H2SO4。因为 F 为胶体分散系,则其粒子直径大小为 1~100 nm。C 为 FeSO4,具有还原
性,与双氧水发生氧化还原反应:2Fe2++H2O2+2H+===2Fe3++2H2O。E 中阳离子为 NH+
4 ,
其检验方法为利用 NH +
4 与 OH-在加热条件下产生的 NH3,然后利用湿润的红色石蕊试纸检
验(变蓝色)或用蘸有浓盐酸的玻璃棒靠近试管口,看是否有白烟产生。
5.(1)NH3 NH4Cl (2)H2+Cl2=====
点燃
2HCl
(3)2NH4Cl+Ca(OH)2=====
△
CaCl2+2NH3↑+2H2O
解析 本题的突破口为“D(气体)→E(固体)→D(气体)”这一系列转化过程,可联想到中学化
学中“氨气→铵盐→氨气”这一转化过程,据此可推测 D 为 NH3,结合 G 为 CaCl2,可知 E
为 NH4Cl,F 为 Ca(OH)2。其余物质可以逐一确定:A 为 H2(或 Cl2),B 为 Cl2(或 H2),C 为
HCl,H 为 H2O。
6.CaC2 H2O Ca(OH)2 C2H2 CO2 Ca(HCO3)2
解析 据同温同压下,两气体的密度之比等于其相对分子质量之比,可计算出气态烃 D 的相
对分子质量为 26,即 D 为 C2H2。根据 D 与 F 反应时产生明亮而带浓烟的火焰,可推断 F 为
O2。由 D+F→E+B(C2H2+O2→CO2+H2O)、A+B→C+D[CaC2+H2O→Ca(OH)2+C2H2]可
确定 A、B、C、E 分别为 CaC2、H2O、Ca(OH)2、CO2。进而可确定 G 为 CaCO3、H 为 Ca(HCO3)2。
7 . (1)Al (2)Al3 + + 3AlO -
2 + 6H2O===4Al(OH)3↓ (3) 光 照 过 量 Cl2
(4)Al4C3+12H2O===3CH4↑+4Al(OH)3↓
解析 由 H、G 是正四面体形结构的非极性分子,H 是一种重要的能源,可确定 H 为 CH4,
再结合 H+Cl2→G,推断 G 为 CCl4,则 A 为 HCl。日常生活中常见的金属主要有 Fe、Al 等,
再结合化学课本上介绍过的一种耐高温材料 Al2O3,可大胆推测 B 可能是 Al。把 Al 带入框
图分析,便可逐一推出其他物质。反应①的离子方程式为 Al3++3AlO-
2 +6H2O===4Al(OH)3↓;
反应②进行的条件是光照、过量 Cl2;反应③的化学方程式为 Al4C3+12H2O===4Al(OH)3↓+
3CH4↑。
8 . (1) SO3 (2)2Na2O2 + 2H2O===4NaOH + O2↑ 2Na2SO3 +
O2===2Na2SO4
9.(1) (2)
(3)(NH4)2Fe(SO4)2 (4)4OH--4e-===O2↑+2H2O
(5)①4Fe(OH)2+O2+2H2O===4Fe(OH)3
②Fe2O3+2Al=====
高温
2Fe+Al2O3
(6)H2(g)+1
2O2(g)===H2O(l)
ΔH=-2b
a kJ·mol-1
解析 由颜色可知 C 为 Fe(OH)3,则 A 为 Fe(OH)2、H 为 Fe2O3,由 M、L 为常见的金属单质,
可知 M、L 分别为 Al、Fe;X 与 NaOH 反应生成气体 B,B 一定是 NH3;在混合液中加入
BaCl2 溶液可生成不溶于稀盐酸的白色沉淀,可知含有 SO2-
4 ,所以 X 为(NH4)2Fe(SO4)2,混合
液为 NaOH 和 Na2SO4 溶液,电解生成 H2、O2,D、E 分别为 O2、H2,F 为 NO、G 为 HNO3。