- 305.13 KB
- 2021-06-01 发布
考点一 反应热的有关概念
考点清单
考点基础
一、反应热(焓变)
1.定义:化学反应过程中放出或吸收的热量,叫作反应热,在恒压条件下,它
等于反应前后体系的焓变。
2.符号:①
Δ
H
。
3.单位:②
kJ/mol或kJ·mol
-1
。
4.测量:可用量热计测量。
5.表示方法:吸热反应的Δ
H
③
>
0,放热反应的Δ
H
④
<
0。
6.产生原因:化学反应过程中
旧键断裂吸收的能量与新键形成放出的能量
不相等
,故化学反应均伴随着能量变化。
二、燃烧热和中和反应的反应热
1.燃烧热
(1)定义:101 kPa时,⑤
1 mol
纯物质完全燃烧生成⑥
稳定
的氧化物
时所放出的热量,叫作该物质的燃烧热。
(2)表示意义
CH
4
(g)+2O
2
(g)
CO
2
(g)+2H
2
O(l) Δ
H
=-890.31 kJ/mol,表示101 kPa条件
下,1 mol CH
4
完全燃烧生成CO
2
(g)和H
2
O(l)时⑦
放出
的热量是
⑧
890.31 kJ
。
2.中和反应的反应热
(1)定义:在稀溶液中,酸跟碱发生⑨
中和
反应生成
1 mol
H
2
O时
所释放的热量,叫作中和反应的反应热。
(2)热化学方程式:H
+
(aq)+OH
-
(aq)
H
2
O(l)
Δ
H
=-57.3 kJ·mol
-1
。
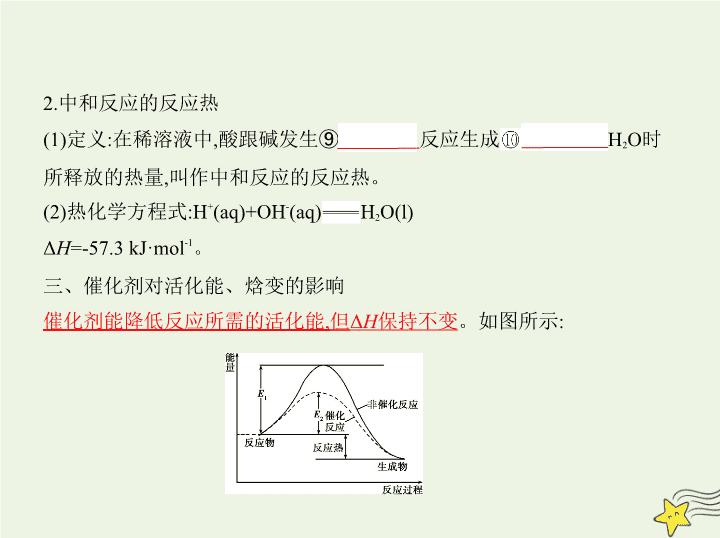
三、催化剂对活化能、焓变的影响
催化剂能降低反应所需的活化能,但Δ
H
保持不变
。如图所示:
重点突破
一、放热反应和吸热反应的比较
类型比较
放热反应
吸热反应
定义
有热量放出的化学反应
吸收热量的化学反应
形成原因
反应物具有的总能量大于生成物具有的总能量
反应物具有的总能量小于生成
物具有的总能量
与化学
键强弱
的关系
生成物分子成键时释放出的总能量大于反应物分子断键时吸收的总能量
生成物分子成键时释放出的总
能量小于反应物分子断键时吸
收的总能量
表示方法
Δ
H
<0
Δ
H
>0
图示
实例
H
2
(g)+Cl
2
(g)
2HCl(g)
Δ
H
=-184.6 kJ·mol
-1
C(s)+H
2
O(g)
CO(g)+H
2
(g)
Δ
H
=+131.3 kJ·mol
-1
二、常见的放热反应和吸热反应
1.常见的放热反应
(1)活泼金属与水或酸的反应,例如:
2Na+2H
2
O
2NaOH+H
2
↑
2Al+6HCl
2AlCl
3
+3H
2
↑
(2)酸碱中和反应,例如:
2KOH+H
2
SO
4
K
2
SO
4
+2H
2
O
CH
3
COOH+NaOH
CH
3
COONa+H
2
O
(3)燃烧反应,例如:
2CO+O
2
2CO
2
CH
3
CH
2
OH+3O
2
2CO
2
+3H
2
O
(4)一些化合反应,例如:
SO
3
+H
2
O
H
2
SO
4
CaO+H
2
O
Ca(OH)
2
CuSO
4
+5H
2
O
CuSO
4
·5H
2
O
2.常见的吸热反应
(1)一些分解反应,例如:
CaCO
3
CaO+CO
2
↑
CuSO
4
·5H
2
O
CuSO
4
+5H
2
O
(2)一些复分解反应,例如:
2NH
4
Cl(s)+Ba(OH)
2
·8H
2
O(s)
BaCl
2
+2NH
3
↑+10H
2
O
(3)一些置换反应,例如:C+H
2
O(g)
CO+H
2
(4)一些化合反应,例如:CO
2
+C
2CO
3.反应条件与放热反应、吸热反应的关系
不同的化学反应发生的条件不同,放热反应和吸热反应均能在一定条件下
发生。反应开始需要加热的反应可能是吸热反应,也可能是放热反应。吸
热反应开始时加热,反应后需要不断加热才能维持反应继续进行;放热反应
开始时加热,反应后会放出一定的热量,此热量能够使反应继续进行,则反
应过程中不需要再加热,如煤的燃烧,一旦热量足够使煤燃烧起来,之后煤
就可以继续燃烧下去,不再需要外界加热。由此可见
,
反应是吸热还是放热
与反应的条件没有必然的联系
,而是取决于反应物和生成物具有的总能量
(或焓)的相对大小。
考点二 热化学方程式 盖斯定律及其应用
考点基础
一、热化学方程式
1.定义:表示参加反应物质的量和①
反应热
的关系的化学方程式。
2.书写要求
(1)注明反应的温度和压强(25 ℃、101 kPa下进行的反应可不注明)。
(2)
注明反应物和生成物的状态
:固态(②
s
或注明晶型)、液态(③
l
)、气态(④
g
)、溶液(aq)。
(3)热化学方程式中的化学计量数只表示物质的量,而不代表⑤
分子个数
,
因此
可以写成分数
。
二、盖斯定律及其应用
1.内容:不管化学反应是一步完成还是分几步完成,其反应热是相同的,即化
学反应的
反应热只与反应体系的始态和终态有关,而与反应的途径无关
。
2.应用:很多反应很难直接测其反应热,这时可
利用盖斯定律来间接计算
。
方法 反应热大小的比较与反应热的计算
1.反应热大小比较方法
(1)同一反应的生成物状态不同时
A(g)+B(g)
C(g) Δ
H
1
<0
A(g)+B(g)
C(l) Δ
H
2
<0
C(g)
C(l) Δ
H
3
<0
因为Δ
H
3
=Δ
H
2
-Δ
H
1
,Δ
H
3
<0,所以Δ
H
2
<Δ
H
1
。
也可以按以下思路分析:
方法技巧
C(g)
C(l)
C(l)
因为Δ
H
1
+Δ
H
3
=Δ
H
2
,Δ
H
1
<0,Δ
H
2
<0,Δ
H
3
<0,所以Δ
H
2
<Δ
H
1
。
(2)同一反应的反应物状态不同时
S(g)+O
2
(g)
SO
2
(g) Δ
H
1
<0
S(s)+O
2
(g)
SO
2
(g) Δ
H
2
<0
S(g)
S(s) Δ
H
3
<0
因为Δ
H
2
+Δ
H
3
=Δ
H
1
,Δ
H
1
<0,Δ
H
2
<0,Δ
H
3
<0,所以Δ
H
1
<Δ
H
2
。
(3)两个有联系的不同反应相比
C(s)+O
2
(g)
CO
2
(g) Δ
H
1
<0
C(s)+
O
2
(g)
CO(g) Δ
H
2
<0
C(s)
CO
2
(g)
C(s)
CO(g)
CO
2
(g)
因为Δ
H
2
+Δ
H
3
=Δ
H
1
,Δ
H
1
<0,Δ
H
2
<0,Δ
H
3
<0,所以Δ
H
1
<Δ
H
2
。
并且据此可写出下面的热化学方程式:
CO(g)+
O
2
(g)
CO
2
(g) Δ
H
=Δ
H
1
-Δ
H
2
。
2.反应热的计算方法
(1)应用盖斯定律计算反应热
某化学反应无论一步完成,还是分几步完成,反应的总热效应相同。即反应
热只与反应体系的始态和终态有关,而与反应途径无关,这就是盖斯定律。
此定律的主要应用是用已知反应的反应热来推知相关反应的反应热。
注意 应用盖斯定律进行简单计算的注意事项
①设计合理的反应过程。
②当反应方程式乘或除某数时,Δ
H
也应乘或除该数。
③反应方程式进行加减运算时,Δ
H
也同样要进行加减运算,且计算过程中
要带“+”“-”。
④应用盖斯定律进行计算并比较反应热的大小时,同样要把Δ
H
看作一个
整体。
⑤在设计的反应过程中常会遇到同一物质固、液、气三态的相互转化,状
态由固→液→气变化时,会吸热;反之会放热。
⑥当设计的反应逆向进行时,其反应热与正反应的反应热数值相等,符号相
反。运用盖斯定律的关键在于分析总反应可由哪些中间过程构成,化简要
细心。
(2)根据化学键键能计算
Δ
H
=反应物的键能总和-生成物的键能总和
(3)根据反应物和生成物的能量计算
Δ
H
=生成物具有的总能量-反应物具有的总能量
相关文档
- 高中化学教案新人教版必修2 化学能2021-05-31 12:39:334页
- 高考化学第一轮复习课件第1讲 化学2021-05-28 16:33:356页
- 高考化学第一轮复习课件第1讲 化学2021-05-28 15:16:268页
- 高一化学课件:2化学反应与能量 化学2021-05-28 10:13:2225页
- 2019届一轮复习人教版化学能与热能2021-05-27 00:48:4324页
- 2018届一轮复习鲁科版专题五化学能2021-05-25 13:51:557页
- 2020届高考化学一轮复习 化学能2021-05-25 12:04:1327页
- 2020届高考化学一轮复习化学能与热2021-05-25 02:16:376页
- 2021届高考化学一轮复习第6章化学2021-05-25 00:43:3617页
- 2018届一轮复习鲁科版专题五化学能2021-05-24 23:54:1210页