- 301.52 KB
- 2021-04-20 发布
十、化学实验操作及实验方案正误辨析
(一)表格实验中的逻辑关系正误判断
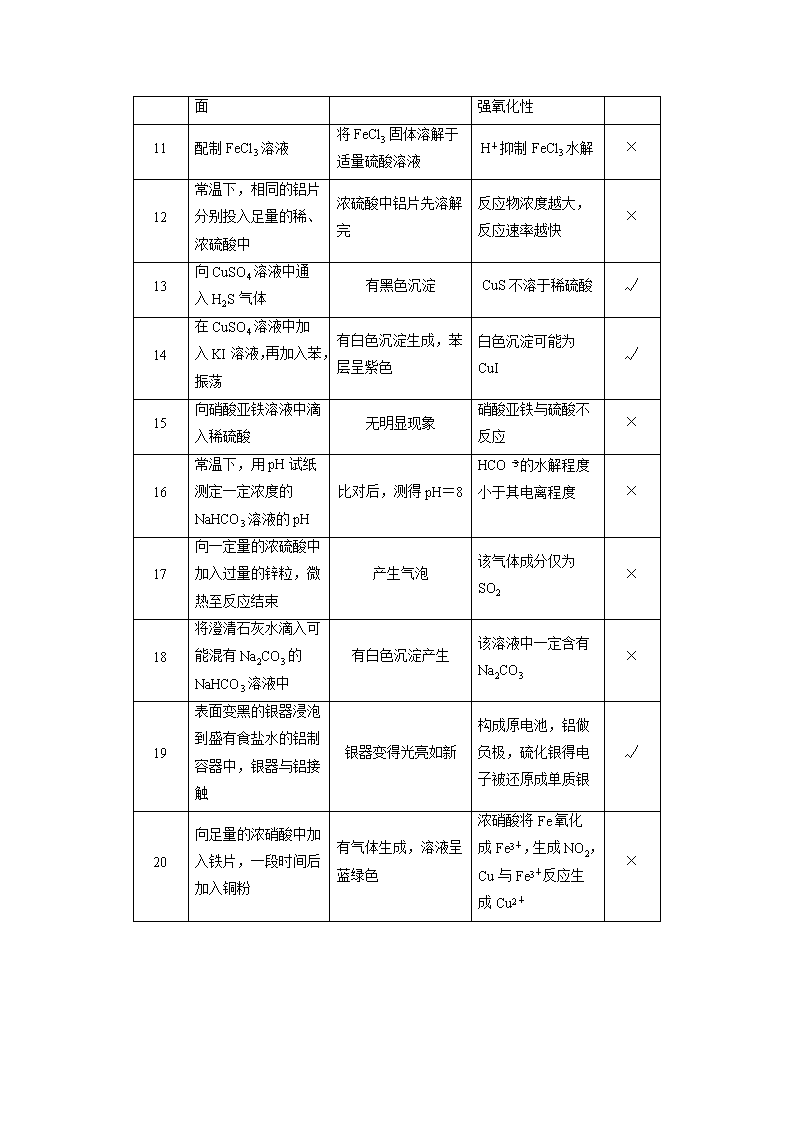
题号 实验 现象 解释与结论 正误
1
用洁净铂丝蘸取溶液
进行焰色反应
火焰呈黄色
原溶液中有 Na+无
K+
×
2
滴加几滴稀 NaOH 溶
液,将湿润红色石蕊
试纸置于试管口
试纸不变蓝 原溶液中无 NH+
4 ×
3
用坩埚钳夹住一小块
用砂纸仔细打磨过的
铝箔在酒精灯上加热
熔化后的液态铝滴落
下来
金属铝的熔点较低 ×
4
硝酸银溶液中加入足
量 NaCl 溶液,再加
入 KI 溶液
先出现白色沉淀,后
变为黄色沉淀 Ksp(AgCl)>Ksp(AgI) √
5
2 mL 2% CuSO4 溶液
中加 4~6 滴 2%
NaOH 溶液,振荡后
加入 0.5 mL X 溶液,
加热煮沸
未出现红色沉淀 X 不含有醛基 ×
6
等体积 pH=3 的 HA
和 HB 两种酸分别与
足量的锌反应
相同时间内,HA 收
集到氢气多
HA 是强酸 ×
7
将铝片和镁条作为电
极,插入 1.0 mol·L-1
的 NaOH 溶液中
电流表指针偏向镁片 金属铝比镁活泼 ×
8
向 1.0 mol·L-1 的
NaHCO3 溶液中滴加
2 滴甲基橙
溶液呈黄色
NaHCO3 溶
液呈碱性
×
9
向 NaBr 溶液中加入
氯水,再加入淀粉KI
溶液
溶液变蓝 氧化性:Cl2>Br2>I2 ×
10 将浓硫酸滴到蔗糖表 固体变黑膨胀 浓硫酸有脱水性和 √
面 强氧化性
11 配制 FeCl3 溶液
将 FeCl3 固体溶解于
适量硫酸溶液
H+抑制 FeCl3 水解 ×
12
常温下,相同的铝片
分别投入足量的稀、
浓硫酸中
浓硫酸中铝片先溶解
完
反应物浓度越大,
反应速率越快
×
13
向 CuSO4 溶液中通入
H2S 气体
有黑色沉淀 CuS 不溶于稀硫酸 √
14
在 CuSO4 溶液中加入
KI 溶液,再加入苯,
振荡
有白色沉淀生成,苯
层呈紫色
白色沉淀可能为
CuI
√
15
向硝酸亚铁溶液中滴
入稀硫酸
无明显现象
硝酸亚铁与硫酸不
反应
×
16
常温下,用 pH 试纸
测定一定浓度的
NaHCO3 溶液的 pH
比对后,测得 pH=8
HCO -
3 的水解程度
小于其电离程度
×
17
向一定量的浓硫酸中
加入过量的锌粒,微
热至反应结束
产生气泡
该气体成分仅为
SO2
×
18
将澄清石灰水滴入可
能混有 Na2CO3 的
NaHCO3 溶液中
有白色沉淀产生
该溶液中一定含有
Na2CO3
×
19
表面变黑的银器浸泡
到盛有食盐水的铝制
容器中,银器与铝接
触
银器变得光亮如新
构成原电池,铝做
负极,硫化银得电
子被还原成单质银
√
20
向足量的浓硝酸中加
入铁片,一段时间后
加入铜粉
有气体生成,溶液呈
蓝绿色
浓硝酸将 Fe 氧化成
Fe3+,生成 NO2,
Cu 与 Fe3+反应生成
Cu2+
×
(二)表格实验中实验操作与实验目的正误判断
题号 实验操作 实验目的 正误
1
向 2 mL 1 mol·L-1 NaOH
溶液中先加入 3 滴 1
mol·L-1 FeCl3 溶液,再加
入 3 滴 1 mol·L-1 MgCl2
溶液
证明
Ksp[Mg(OH)2]>Ksp[Fe(OH)3]
×
2
相同温度下,向两支盛有
相同体积不同浓度 H2O2
溶液的试管中分别滴入适
量相同浓度的 CuSO4 溶液
和 FeCl3 溶液
探究 Cu2+、Fe3+对 H2O2 分
解速率的影响
×
3
室温下,用 pH 试纸分别
测定浓度为 0.1 mol·L-1
NaClO 溶液和 0.1 mol·L-1
CH3COONa 溶液的 pH
比较 HClO 和 CH3COOH 的
酸性强弱
×
4
向含有酚酞的 Na2CO3 溶
液中加入少量 BaCl2固体,
溶液红色变浅
证明 Na2CO3 溶液中存在水
解平衡
√
5
分别测定室温下等物质的
量浓度的 Na2SO3 与
Na2CO3 溶液的 pH,后者
较大
证明非金属性:S>C ×
6
将 NaOH 溶液滴入某溶液
中加热,放出的气体能使
湿润的红色石蕊试纸变蓝
证明溶液中有 NH+
4 √
7
分别通入硝酸银溶液中,
产生淡黄色沉淀的是溴蒸
气
鉴别溴蒸气和 NO2 √
8
在醋酸钠溶液中滴入酚酞
溶液,加热后红色加深
证明盐类水解是吸热反应 √
9
用硫酸酸化的 H2O2 溶液
滴入 Fe(NO3)2 溶液中,溶
证明氧化性:H2O2 比 Fe3+
强
×
液变黄色
10
往黄色固体难溶物 PbI2 中
加水,振荡,静置。取上
层清液,然后加入 NaI 固
体,产生黄色沉淀
证明难溶物存在沉淀溶解
平衡
√
11
向 AgCl 悬浊液中加入 NaI
溶液时出现黄色沉淀 Ksp(AgCl)