- 579.50 KB
- 2021-05-23 发布
- 1、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 2、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报QQ:3215808601
2009年安徽卷理综化学部分
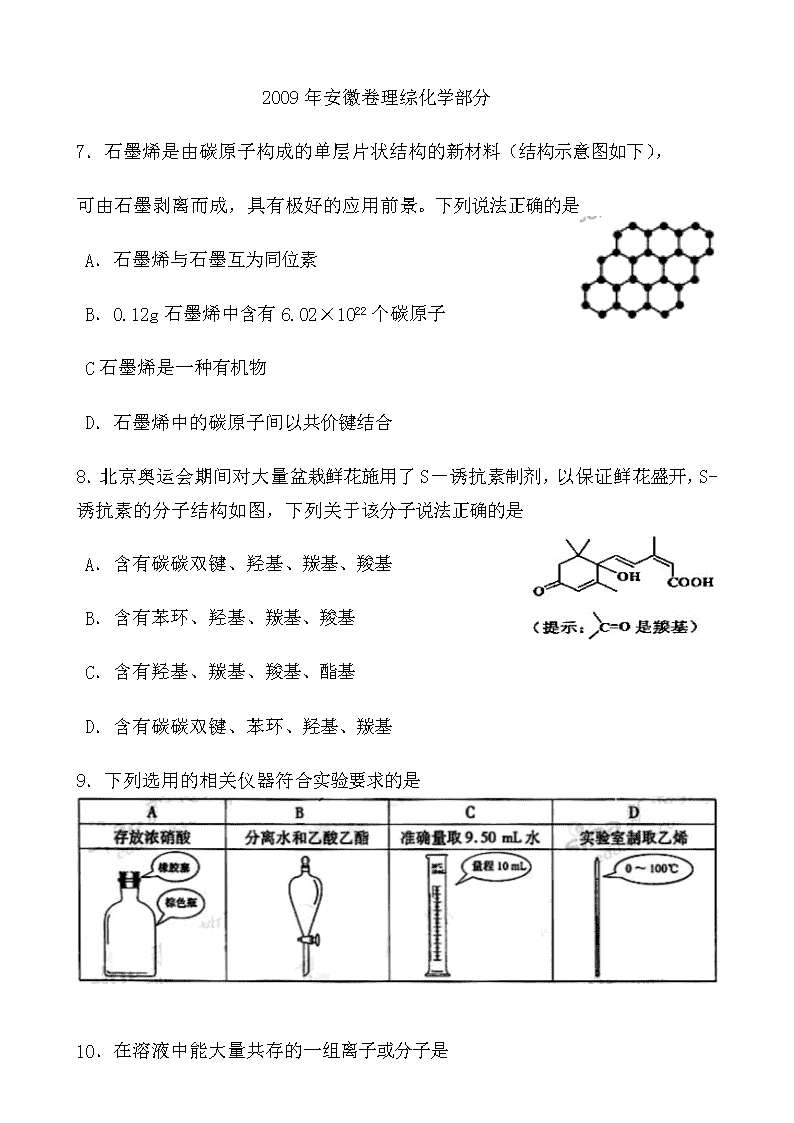
7.石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如下),
可由石墨剥离而成,具有极好的应用前景。下列说法正确的是
A.石墨烯与石墨互为同位素
B.0.12g石墨烯中含有6.02×1022个碳原子
C石墨烯是一种有机物
D.石墨烯中的碳原子间以共价键结合
8.北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开,S-诱抗素的分子结构如图,下列关于该分子说法正确的是
A.含有碳碳双键、羟基、羰基、羧基
B.含有苯环、羟基、羰基、羧基
C.含有羟基、羰基、羧基、酯基
D.含有碳碳双键、苯环、羟基、羰基
9.下列选用的相关仪器符合实验要求的是
10.在溶液中能大量共存的一组离子或分子是
A. 、、、 B.K+ 、Al3+、 、NH3·H2O
C.Na+、K+、、Cl2 D.Na+ 、CH3COO-、、OH-
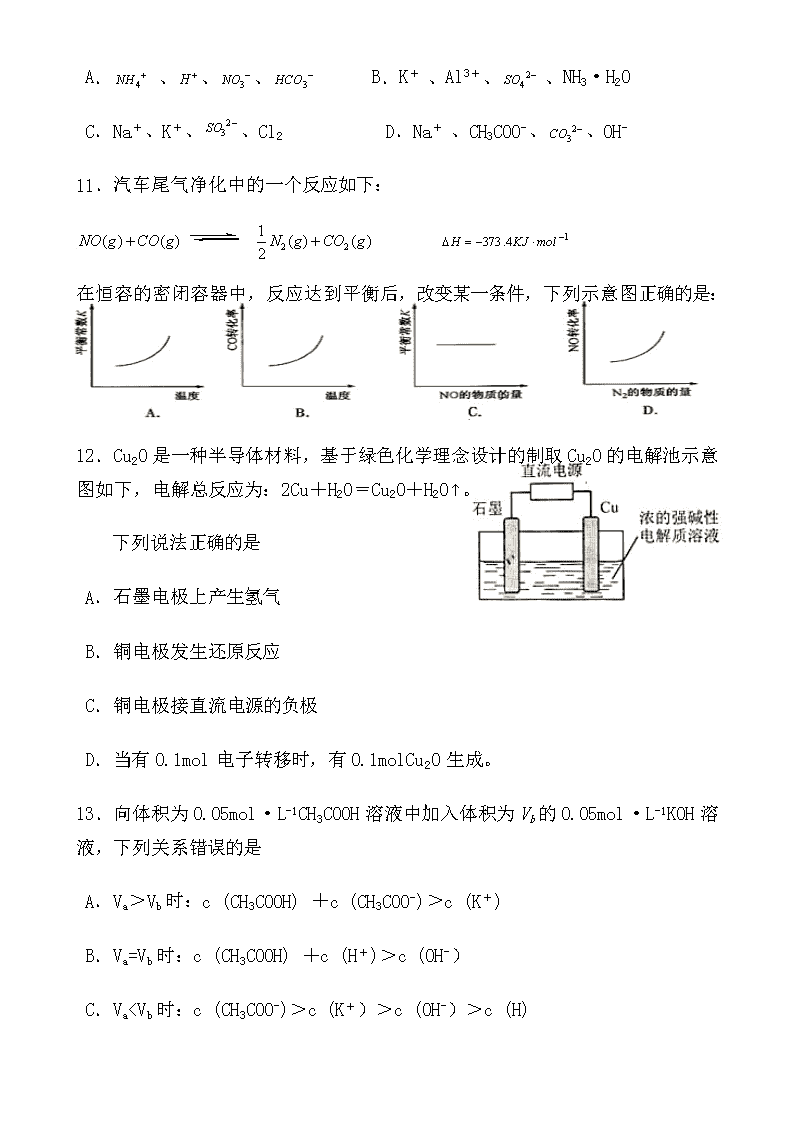
11.汽车尾气净化中的一个反应如下:
在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是:
12.Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如下,电解总反应为:2Cu+H2O=Cu2O+H2O。
下列说法正确的是
A.石墨电极上产生氢气
B.铜电极发生还原反应
C.铜电极接直流电源的负极
D.当有0.1mol电子转移时,有0.1molCu2O生成。
13.向体积为0.05mol·L-1CH3COOH溶液中加入体积为Vb的0.05mol·L-1KOH溶液,下列关系错误的是
A.Va>Vb时:c (CH3COOH) +c (CH3COO-)>c (K+)
B.Va=Vb时:c (CH3COOH) +c (H+)>c (OH-)
C.VaVb,醋酸过量,根据物料守恒可知,n(CH3COOH)+ n(CH3COO-)=0.05Va,n(K+)= 0.05VVb,则A选项正确;若Va=Vb,反应后为CH3COOK溶液,由于的CH3COO-水解而显碱性,根据质子守恒可知,B选项正确;若Vac(CH3COO-),C选项错误;D选项符合电荷守恒,正确。
25.⑴ 二 VA 弱 ⑵ 1s22s22p63s23p4 大
⑶ Cu + 2H2SO4(浓)CuSO4 + SO2↑+ 2H2O
⑷ 3FeO(s) + 2Al(s) Al2O3(s) + 3Fe(s) DH=-859.7KJ/mol
解析:首先推出题中几种元素,W、Y的氧化物是导致酸雨的主要物质,在结合原子序数的大小可知,W是氮元素,Y是硫元素,X的基态原子核外有7个原子轨道填充了电子,根据基态原子核外电子所遵循的原则,可以写出电子排布式为:1s22s22p63s23p1,X为铝元素,Z能够形成红色的Z2O和黑色的ZO两种氧化物,推知Z为铜元素,两种氧化物分别为Cu2O和CuO。
26
解析:
(1)A与银氨溶液反应有银镜生成,则A中存在醛基,由流程可知,A与氧气反应可以生成乙酸,则A为CH3CHO;(2)由B和C的结构简式可以看出,乙酸分子中的羟基被氯原子取代,发生了取代反应;(3)D与甲醇在浓硫酸条件下发生酯化反应生成E,E的结构为;(4)由F的结构简式可知,C和E 在催化剂条件下脱去一个HCl分子得到F,F中存在酯基,在碱液中可以发生水解反应,方程式为:+3NaOH→+CH3COONa+CH3OH+H2O;(5)G分子的结构中存在苯环、酯基、羟基、碳碳双键,所以能够与溴单质发生加成反应或者取代反应,能够与金属钠反应产生氢气,A和B选项正确;1molG中1mol碳碳双键和1mol苯环,所以需要4mol氢气,C选项错误;G的分子式为C9H6O3,D选项正确。
27.⑴ Cr2O72- + 6Fe2+ + 14H+ 2Cr3+ + 6Fe3+ + 7H2O
(2)将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照。
⑶ Fe(OH)3、Fe(OH)2 ⑷ 13.9
解析:(1)第①步是Cr2O72-与Fe2+发生氧化还原反应,方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;(2)测定溶液的pH的方法是:用玻璃棒蘸取待测溶液滴在pH试纸的中心位置,然后对照标准比色卡,读出对应颜色的数据;(3)从最终所得磁性材料的化学式可知,滤渣中主要有Cr(OH)3、Fe(OH)2、Fe(OH)3;(4)1L废水中的n(Cr2O72-)=5.00×10-3mol,根据关系式:Cr2O72-~4Cr0.5Fe1.5FeO4~10FeSO4·7H2O,所以理论上n(FeSO4·7H2O)=0.05mol,m(FeSO4·7H2O)= 0.05mol×278g·mol-1=13.9g。
28. ⑴
⑵ 8.0×10-6
⑶ 过氧化氢在温度过高时迅速分解。
⑷ 反应速率趋向于零(或该降解反应趋于停止)
⑸ 将所取样品迅速加入到一定量的NaOH溶液中,使pH约为10(或将所取样品骤冷等其他合理答案均可)
解析:(1)实验①是参照实验,所以与实验①相比,实验②和③只能改变一个条件,这样才能起到对比实验的目的,则实验②是探究温度对反应速率的影响,则T=313K,pH=3,c(H2O2)=6.0 mol·L-1,c(Fe2+)=0.30 mol·L-1,实验③显然是探究pH的大小对反应速率的影响;(2)在50~150s内,△c(p-CP)=0.8mol·L-1,则v (p-CP)=0.08mol·L-1·s-1;(3)温度过高时,H2O2分解,c(H2O2)浓度减小,导致反应速率减小;(4)从图中看出,pH=10时,c(p-CP)不变,即反应速率为零,说明碱性条件下,有机物p-CP不能降解;(5)从第(4)可以得出,在发言液中加入NaOH溶液,使溶液的pH迅速增大,反应停止。
相关文档
- 高考语文阅读题精练:在西域读李白2021-05-23 02:13:132页
- 高考语文一轮复习专题十四实用类文2021-05-23 02:12:5813页
- 人教版必修1高考地理强化复习农业2021-05-23 02:12:575页
- 湖北省2020届高三(4月)线上调研考试2021-05-23 02:12:5621页
- 2019全国各地高考语文重点卷作文题2021-05-23 02:12:5218页
- 高考新课标Ⅰ卷文数试题解析正式版2021-05-23 02:12:5113页
- 重庆市实验中学校2020-2021学年高2021-05-23 02:12:4017页
- 八年级下册英语单元检测题参考答案2021-05-23 02:12:403页
- 高考部分遗传学应用题型举例2021-05-23 02:12:205页
- 2020-2021学年高考数学(理)考点:一元2021-05-23 02:12:109页