- 1.59 MB
- 2021-05-23 发布
- 1、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 2、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报QQ:3215808601
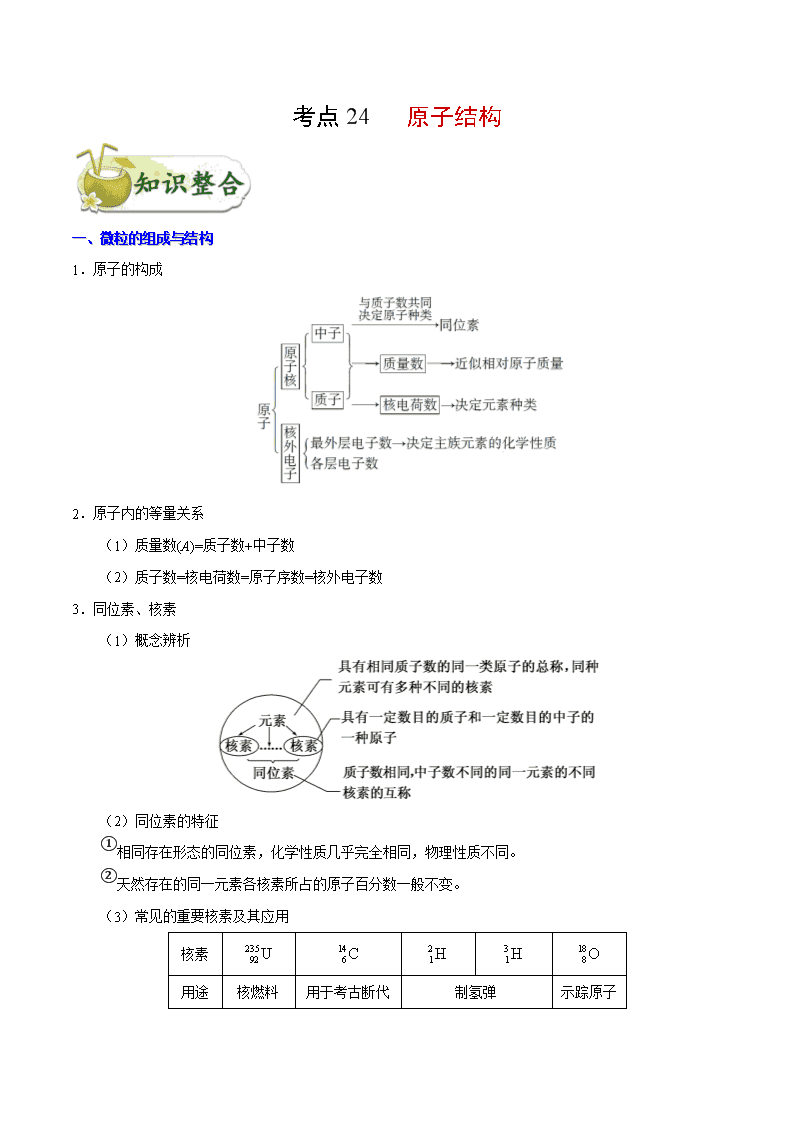
考点 24 原子结构
一、微粒的组成与结构
1.原子的构成
2.原子内的等量关系
(1)质量数(A)=质子数+中子数
(2)质子数=核电荷数=原子序数=核外电子数
3.同位素、核素
(1)概念辨析
(2)同位素的特征
①相同存在形态的同位素,化学性质几乎完全相同,物理性质不同。
②天然存在的同一元素各核素所占的原子百分数一般不变。
(3)常见的重要核素及其应用
核素
235
92 U 14
6C 2
1H 3
1H 18
8O
用途 核燃料 用于考古断代 制氢弹 示踪原子
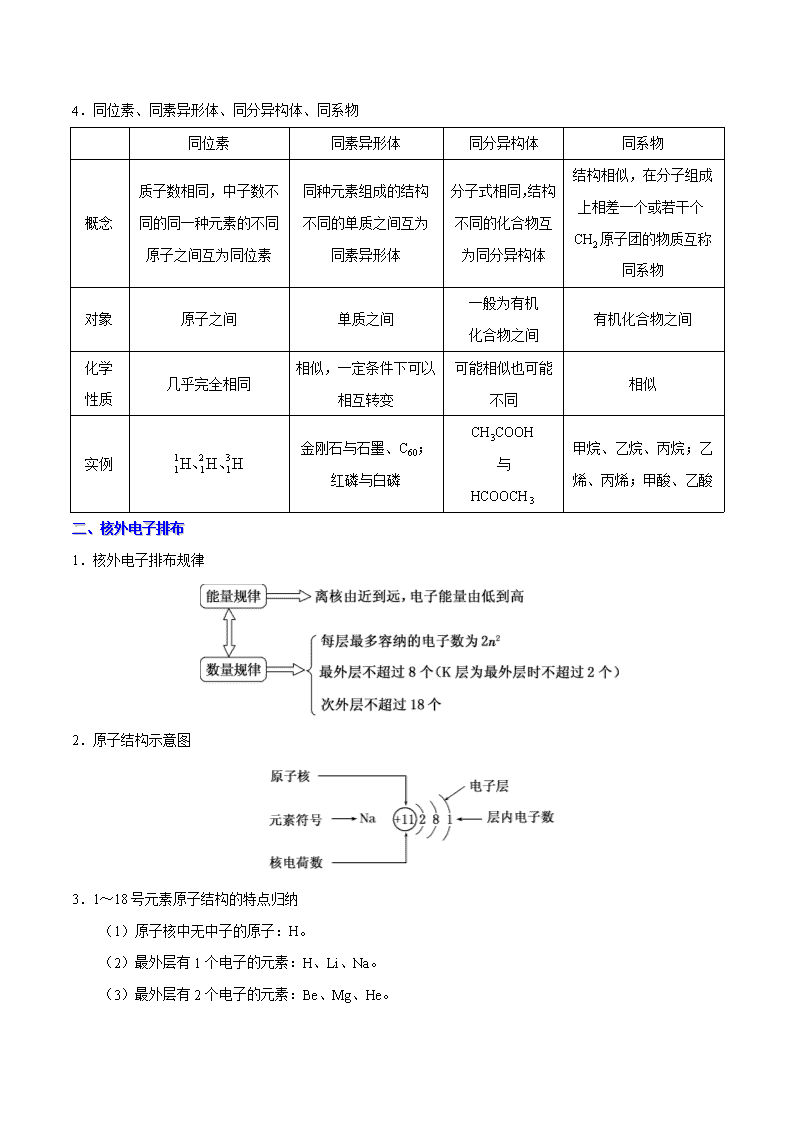
4.同位素、同素异形体、同分异构体、同系物
同位素 同素异形体 同分异构体 同系物
概念
质子数相同,中子数不
同的同一种元素的不同
原子之间互为同位素
同种元素组成的结构
不同的单质之间互为
同素异形体
分子式相同,结构
不同的化合物互
为同分异构体
结构相似,在分子组成
上相差一个或若干个
CH2 原子团的物质互称
同系物
对象 原子之间 单质之间
一般为有机
化合物之间
有机化合物之间
化学
性质
几乎完全相同
相似,一定条件下可以
相互转变
可能相似也可能
不同
相似
实例
1 2 3
1 1 1H H H、 、
金刚石与石墨、C60;
红磷与白磷
CH3COOH
与
HCOOCH3
甲烷、乙烷、丙烷;乙
烯、丙烯;甲酸、乙酸
二、核外电子排布
1.核外电子排布规律
2.原子结构示意图
3.1~18 号元素原子结构的特点归纳
(1)原子核中无中子的原子:H。
(2)最外层有 1 个电子的元素:H、Li、Na。
(3)最外层有 2 个电子的元素:Be、Mg、He。
(4)最外层电子数等于次外层电子数的元素:Be、Ar。
(5)最外层电子数是次外层电子数 2 倍的元素:C;最外层电子数是次外层 3 倍的元素:O;最外层电
子数是次外层 4 倍的元素:Ne。
(6)电子层数与最外层电子数相等的元素:H、Be、Al。
(7)电子总数为最外层电子数 2 倍的元素:Be。
(8)次外层电子数是最外层电子数 2 倍的元素:Li、Si。
(9)内层电子总数是最外层电子数 2 倍的元素:Li、P。
(10)电子层数是最外层电子数 2 倍的元素:Li。
(11)最外层电子数是电子层数 2 倍的元素:He、C、S。
(12)最外层电子数是电子层数 3 倍的元素:O。
考向一 原子中各种微粒数目之间的关系及计算
典例 1 Se 是人体必需的微量元素,硒元素的核电荷数为 34,下列关于 80Se 的说法正确的是( )
A.80Se 的核内有 80 个质子 B.80Se 的质量数是 46
C.80Se 的核内有 34 个中子 D.80Se 的核外有 34 个电子
【答案】D
【解析】
A.硒元素的核电荷数为 34,由于核电荷数=核内质子数,所以 80Se 的质子数是 34,A 错误;
B.原子符号左上角表示的是质量数,则 80Se 的质量数是 80,B 错误;
C.硒元素的核电荷数为 34,则其质子数是 34,由于质量数等于质子数与中子数的和,则 80Se 的质量数是
80,所以其中子数为 80-34=46,C 错误;
D.硒元素的核电荷数为 34,由于核电荷数=核外电子,所以 80Se 的核外有 34 个电子,D 正确;
故合理选项是 D。
1.现有下列几组粒子:①N2、CO、C2H2;②NH+
4 、H3O+、OH-;③C2-2 、O2+2 、CN-;④PO3-4 、SO2-4 、ClO-
4 。
对上述四组粒子归类正确的是
A.质子数相等、电子数和原子数不相等:①
B.质子数和电子数相等、原子数不相等:②
C.电子数相等、质子数和原子数不相等:③
D.原子数和电子数相等、质子数不相等:④
【答案】D
【解析】阳离子:电子总数=质子总数-所带的电荷总数;阴离子:电子总数=质子总数+所带的电
荷总数。①N2、CO、C2H2 的质子数和电子数都等于 14,原子数不等;②NH+
4 、H3O+、OH-的原子数和质
子数不等,电子数都为 10;③C2-2 、O2+2 、CN-
的原子数和电子数都相等,质子数不同;④P、S、Cl 所含的
电子数分别为 15、16、17,酸根离子中所含氧原子数均相等,所带负电荷数依次为 3、2、1,三种酸根离
子所含的总电子数相等(18+32)、原子数都为 5,但三种酸根离子的质子数不相等。
考向二 核外电子排布规律
典例 2 X、Y、Z、W 是短周期主族元素,原子序数依次增大。X 是原子半径最小的元素;Y 元素原子的
最外层电子数是电子层数的 2 倍;Z 元素的-1 价阴离子、W 元素的+3 价阳离子的核外电子排布均与
氖原子相同。下列说法正确的是
A.X 的三种核素为氕、氘、氚,三者均含有中子和质子
B.W 离子结构示意图为
C.X 与 Y 只能形成一种化合物
D.Z 的氢化物的水溶液与 SiO2可以反应
【答案】D
【解析】由题可知 X 为 H,Y 为 C,Z 为 F,W 为 Al。
2.Mg 和 Mg2+两种粒子中,不相同...的是
①核内质子数 ②核外电子数 ③最外层电子数 ④核外电子层数
A.①②③ B.①②④ C.①③④ D.②③④
【答案】D
【解析】
①Mg 原子失去 2 个电子变为 Mg2+,核内质子数不变, Mg 和 Mg2+具有相同质子数,故①不选; ②Mg 原子核外
电子数为 12,Mg 原子失去最外层的 2 个电子变为 Mg2+,核外电子数为 10,故②选; ③Mg 失去 2 个电子变为
Mg2+,最外层电子数由 2 个变成 8 个,故③选; ④Mg 失去 2 个电子变为 Mg2+,电子层数由 3 个变成 2 个,故④
选; 答案选 D.
短周期元素原子核外电子排布的特征
Be
Ar
Al
最外层电子数等于次外层电子数
电子层数与最外层电子数相等
P
S
最外层电子数是内层电子总数的一半
Li 次外层电子数是最外层电子数的2倍 i
电子层数是最外层电子数的2倍
C
S最外层电子数是电子层数的2倍
最外层电子数是次外层电子数的2倍
O←最外层电子数是次外层电子数的 3 倍
Ne←最外层电子数是次外层电子数的 4 倍
考向三 “等电子微粒”的判断与应用
典例 3 已知 A、B、C、D 是中学化学中常见的四种不同多核粒子,它们之间存在如下关系:
(1)如果 A、B、C、D 均是 10 电子的粒子,请写出:
A 与 B 反应的离子方程式为_________________________________。
(2)如果 A 和 C 是 18 电子的粒子,B 和 D 是 10 电子的粒子,举例写出:
①A 与 B 在溶液中反应的离子方程式为________________________。
②根据上述离子方程式,可以判断 C 与 B 结合质子的能力大小是(用化学式或离子符号表示)____
________________。
(3)已知肼(H2N—NH2)和甲胺(H3C—NH2)都是 18 电子的分子。分析肼和甲胺的结构特点并从中得到
启发,写出与其具有相同电子数的有机化合物的结构简式:________________________________(至少
写两个)。
【答案】(1)NH+
4 +OH-=====
△
NH3↑+H2O
(2)①H2S+OH-===HS-
+H2O
②OH->HS-(答案合理即可)
(3)CH3—CH3、CH3—F、CH3—OH(任写两个)
【解析】(1)若 A、B、C、D 均为 10e-
粒子,根据图可知 A 为 NH+
4 ,B 为 OH-
,C 为 NH3,D 为 H2O。
(2)若 A、C 为 18e-
粒子,B、D 为 10e-
粒子,由图示可知 A 可以为 H2S,B 为 OH-
,则 C 为 HS-
,
D 为 H2O。
(3)根据 H2N—NH2、H3C—NH2均为 18e-
的分子,可得—NH2、—CH3 均为 9e-
基团,其他为 9e-
基
团的还有—OH、—F。故构成 18e-
的有机分子为 CH3—OH、CH3—F、CH3—CH3。
3.X、Y、Z 三种短周期元素,原子半径的大小关系为 r(Y)>r(X)>r(Z),原子序数之和为 16。X、Y、Z 三
种元素的常见单质在适当条件下发生如图所示变化,其中乙和丙均为 10 电子分子。下列说法不正确的是
A.元素 X 位于第ⅥA 族
B.甲不能溶解于乙中
C.甲和丙在一定条件下能发生氧化还原反应
D.乙的沸点低于丙的沸点
【答案】D
【解析】由题给信息和框图可以推出,X 为 O,Y 为 N,Z 为 H,甲为 NO,乙为 H2O,丙为 NH3。O 位
于第ⅥA 族,A 正确;NO 不溶于水,B 正确;NO 和 NH3在一定条件下能发生氧化还原反应,C 正确;
H2O 的沸点高于 NH3 的沸点,D 错误。
推断 10e−和 18e−微粒的思维模型
1.10 电子微粒
2.18 电子微粒
(1)
(2)“双九”微粒:—F、—OH、—NH2、—CH3的相互组合,如:F2、H2O2、N2H4、C2H6、CH3F、CH3OH、
CH3NH2。
1.下列说法正确的是
A.
12
6 C 和
14
6 C 是同一种核素
B.液氯和氯气互为同素异形体
C.甲醇(CH3OH)和甘油( )互为同系物
D.Fe 与 Ca 位于元素周期表的同一周期
【答案】D
【解析】
A.
12
6 C 和
14
6 C 是同一种元素的不同核素,A 不正确;
B.液氯和氯气为不同状态的同种物质,B 不正确;
C.甲醇(CH3OH)和甘油( )虽然官能团的种类相同,但数目不同,二者不互为同系物,
C 不正确;
D.Fe 与 Ca 都位于元素周期表的第四周期,D 正确;故选 D。
2.“玉兔”号月球车用
238
94 Pu 作为热源材料。下列关于
238
94 Pu 的说法不正确的是( )
A.
238
94 Pu 与
239
94 Pu 互为同位素
B. 238
94 Pu 与
239
94 Pu 具有相同的最外层电子数
C. 238
94 Pu 与
239
94 Pu 具有相同的中子数
D.
238
94 Pu 与
238
92 U 质子数不同
【答案】C
【解析】A.
238
94 Pu 与
239
94 Pu 是质子数相同、中子数不同的原子,互为同位素,故 A 正确;
B. 238
94 Pu 与
239
94 Pu 核外电子数都是 94,具有相同的最外层电子数,故 B 正确;
C. 238
94 Pu 中子数是 238-94=144, 239
94 Pu 中子数是 239-94=145,中子数不同,故 C 错误;
D.
238
94 Pu 质子数是 94, 238
92 U 质子数是 92,故 D 正确;选 C。
3.下列分子中所有原子都满足最外层为 8 电子结构的是( )
A.BF3 B.H2O C.SiCl4 D.PCl5
【答案】C
【解析】
A.B 位于ⅢA 族,B 的化合价+3 价,形成 3 个 B-F 键,B 原子最外层是 6 个电子,故 A 不选;
B.H2O 中 H 原子为 2 个电子结构,故 B 不选;
C.Si 位于ⅣA 族,Si 的化合价为+4,形成 4 个 Si-Cl 键,4+4=8,Cl 为-1 价,1+7=8,所有原子都满足最
外层为 8 电子结构,故 C 选;
D.P 位于ⅤA 族,P 的化合价为+5 价,形成 5 个 P-Cl 键,5+5=10,最外层为 10 个电子结构,故 D 不选;
故选 C。
4.下列说法错误的是
A.
1
1H、
2
1H 、H+
和 H2是氢元素的四种不同粒子
B. 40
20 Ca 和
42
20 Ca 、石墨和金刚石均互为同位素
C. 1
1H和
2
1H 是不同的核素
D.12C 和 14C 互为同位素,物理性质不同,但化学性质几乎完全相同
【答案】B
【解析】
A. 1
1H、 2
1H 、H+
和 H2中,前两者是氢的核素,第三种是离子,第四个是单质,均是氢元素的四种不同微
粒,A 正确;
B.40
20Ca 和
42
20 Ca 是钙的不同核素,互为同位素,石墨和金刚石是 C 的不同单质,互为同素异形体,B 错误;
C. 1
1H和 2
1H 是氢的不同核素,C 正确;
D.12C 和 14C 是 C 的不同核素,互为同位素,其化学性质几乎完全相同,但物理性质不同,D 正确;答案
选 B。
5.Cl 和 Cl-两种微粒,相同的是( )
A.核外电子层数 B.核外电子数
C.最外层电子数 D.化学性质
【答案】A
【解析】
A.Cl 和 Cl-两种微粒核外都有 3 个电子层,故 A 正确;
B.Cl 核外有 17 个电子,Cl-核外有 18 个电子,Cl 和 Cl-两者的核外电子数不同;故 B 错误;
C.Cl 的最外层有 7 个电子,Cl-最外层有 8 个电子,故 C 错误;
D.Cl 和 Cl-核外电子结构不同,Cl 不是稳定结构,Cl-是稳定结构,化学性质不同,故 D 错误。
答案选 A。
6.核内中子数为 N 的 R2+的离子,质量数为 A,则 ng 此 R2+离子的氧化物中所含的质子的物质的量为( )
A.
n
A+16
(A-N +8)mol B.
n
A+16
(A-N +10)mol
C.(A-N+2) mol D.
n
A
(A-N)mol
【答案】A
【解析】
该氧化物的摩尔质量为 ( )gA+16 /mol ,ng 它的氧化物的物质的量为
ng
(A+16)g/mol
;
一个氧化物分子中含有(A−N+8)个质子,所以 ng 它的氧化物中所含质子的物质的量为
ng nA-N( )+8 A-N+8
A+16 g/mol A+16
( )
( )
mol。
故答案选:A。
7.如图是某元素原子结构示意图,下列关于该元素的判断正确的的是()
A.位于第三周期元素
B.属于第 VII 族元素
C.该元素的化合价只有-2 价
D.该原子在化学反应中容易得到 2 个电子
【答案】D
【解析】
A. 该元素是 34 号元素,原子的电子层数为 4,位于第四周期,故 A 错误;
B. 该元素是 34 号元素,原子最外层有 6 个电子,位于第 VIA 族,故 B 错误;
C. 该元素的原子最外层有 6 个电子,化合价可以是-2、+6 价等,故 C 错误;
D. 最外层电子数⩾ 4,在化学反应中易得电子,该原子在化学反应中容易得到 2 个电子,故 D 正确;
故选 D。
8.下列叙述正确的是
A.两种微粒,若核外电子排布完全相同,则其化学性质一定相同
B.失去电子数越多,金属越活泼
C.两原子的核外电子排布相同,则一定属于同种元素
D.各种元素原子核都是由质子和中子组成的
【答案】C
【解析】
【分析】
【详解】
A.两种微粒,如 Na+和 O2-,核外电子排布都为 2、8,但化学性质不同,A 不正确;
B.金属失去电子数越多,金属性不一定越活泼,金属活泼性要看金属原子失电子的能力,越容易失电子,
金属越活泼,(如 Na 与 Al),B 不正确;
C.两原子的核外电子排布相同,则一定属于同种元素,可能是同种原子,可能互为同位素,C 正确;
D.各种元素原子核都是由质子组成,但不一定含有中子,如氕原子,D 不正确;
故选 C。
9.如图所示,a、b、c 均为非金属单质,d、e 均为含有 10 个电子的共价化合物,且分子中所含原子个数:
d>e,f 为离子化合物。则下列说法错误的是
A.常温下,单质 a 呈气态
B.单质 c 具有强氧化性
C.稳定性:d>e
D.f 受热易分解为 d 和 e
【答案】C
【解析】非金属单质形成的含有 10 个电子的共价化合物有 CH4、NH3、H2O、HF。由于 f 为离子化合物且
分子中所含原子个数:d>e,则 d 是 NH3,e 是 HF,f 是 NH4F。因此 a、b、c 分别是 N2、H2、F2。根据
元素周期律可知 HF 的稳定性大于 NH3,故 C 错误。
10.设 X、Y、Z 代表元素周期表中前 4 周期的三种元素,已知 X+和 Y-具有相同的电子层结构;Z 元素的
原子核内质子数比 Y 元素的原子核内质子数少 9;Y 和 Z 两种元素可形成含 4 个原子核、42 个电子的负
一价阴离子。下列说法不正确的是
A.元素 Z 的气态氢化物分子中含有 10 个电子
B.元素 Y 的气态氢化物分子中含有 18 个电子
C.元素 Z 与元素 X 形成的化合物 X2Z 中离子都达到稳定结构
D.元素 Y、Z 组成的化合物属于离子化合物
【答案】D
【解析】由“X+和 Y-具有相同的电子层结构”知 X+和 Y-的最外层都是 8 电子,推知 X 为ⅠA 族元素、Y
为ⅦA 族元素;又因“Z 元素的原子核内质子数比 Y 元素的原子核内质子数少 9”,故 Y 为氯、Z 为氧、X
为钾。水分子中含有 10 个电子,氯化氢分子中含有 18 个电子,K2O 中的钾离子、氧离子均达到最外层
8 电子稳定结构,氯、氧组成的化合物为共价化合物。
11.A、B、C、D 4 种元素的核电荷数依次增大,它们的离子的电子层数相同且最外层电子数均为 8。A 原
子的 L 层电子数与 K、M 层电子数之和相等,D 原子的 K、L 层电子数之和等于电子总数的一半。
(1)这 4 种元素的元素符号依次是 A________、B________、C________、D________。
(2)C 的原子结构示意图为________。
(3)D 的离子结构示意图为________。
(4)B 的单质与 D 的最高价氧化物对应的水化物反应的化学方程式为_________________________。
(5)A 单质与浓硫酸共热的化学方程式为_________________________。
【答案】(1)S Cl K Ca
(2)
(4)2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
(5)S+2H2SO4(浓)=====
△
3SO2↑+2H2O
【解析】A 原子的 L 层电子数与 K、M 层电子数之和相等,所以 A 的核电荷数为 2×8=16,A 为硫元素。
D 原子的 K、L 层电子数之和等于电子总数的一半,所以 D 原子的核电荷数是(2+8)×2=20,D 为钙元
素。根据核电荷数依次增大,它们的离子的电子层数相同且最外层电子数均为 8,可以判断出 B 为氯元
素,C 为钾元素。
12.元素 X、Y、Z、M、N 均为短周期主族元素,且原子序数依次增大。已知 Y 元素原子最外层电子数与
核外电子总数之比为 3∶4,M 元素原子的最外层电子数与次外层电子数之比为 3∶4,且 M 原子的质子
数是 Y 原子的 2 倍;N-、Z+、X+的半径逐渐减小;化合物 XN 在常温下为气体。
据此回答下列问题。
(1)写出 Z 与 N 形成的化合物的电子式________________。
(2)X 与 Y 可分别形成 10 电子和 18 电子的分子,写出该 18 电子分子转化成 10 电子分子的化学方程
式________________(分解反应)。
(3)如图表示由上述元素组成的两种气体分子在一定条件下的密闭容器中充分反应前后的转化关系,请
写出该转化过程的化学方程式:________________。
(4)A、B 均为由上述五种元素中的三种元素组成的强电解质,且组成元素的原子个数之比为 1∶1∶1。
若在各自的水溶液中,A 能抑制水的电离,B 能促进水的电离,则 A 的化学式为______________,B 的
化学式为______________。
【答案】(1)
(2)2H2O2 2H2O+O2↑
(3)2SO2+O2 2SO3
(4)NaOH NaClO 或 NaHS
【解析】根据 Y 元素原子最外层电子数与核外电子总数之比为 3∶4,则 Y 是 O;M 元素原子的最外层
电子数与次外层电子数之比为 3∶4,则 M 是 S;N 为短周期主族元素,原子序数大于 S,N 为 Cl;根据
化合物 XN 在常温下为气体,推断 X 为 H;根据 N-、Z+、X+的半径逐渐减小,推断 Z 为 Na。
(1)Na 与 Cl 形成的化合物是 NaCl,其电子式为
( 2)H 与 O 形成的 10 电子分子是 H2O,形成的 18 电子分子是 H2O2 ,二者之间的转化为
2H2O2 2H2O+O2↑。
(3)由图示可知图中表示的是 SO2与 O2 反应生成 SO3,即 2SO2+O2 2SO3。
(4)A 能抑制水的电离,且三种元素的原子个数比为 1∶1∶1,则 A 是 NaOH;B 能促进水的电离,则
是能水解的盐,且组成元素的原子个数比也为 1∶1∶1,则是 NaClO 或 NaHS。
1.(2020·浙江高考真题)下列说法正确的是( )
A.同一原子中,在离核较远的区域运动的电子能量较高
B.原子核外电子排布,先排满 K 层再排 L 层,先排满 M 层再排 N 层
C.同一周期中,随着核电荷数的增加,元素的原子半径逐渐增大
D.同一周期中,Ⅱ A 与Ⅲ A 族元素原子的核电荷数都相差 1
【答案】A
【解析】A.电子能量越低,挣脱原子核束缚的能力弱,在距离原子核近的区域运动;电子能量高,挣脱原
子核束缚的能力强,在距离原子核远的区域运动,正确;B. M 能层中 d 能级的能量高于 N 能层中 s
能级能量,填充完 4s 能级后才能填充 3d 能级,错误;C.同一周期中,主族元素随着核电荷数的增加,
元素的原子半径逐渐减小,错误;D.第四周期中,Ⅱ A 与Ⅲ A 族元素原子的核电荷数相差 11,错误;
故答案为 A。
2.(2020·浙江高考真题)下列说法正确的是( )
A. 和 是两种不同的元素 B.单晶硅和石英互为同素异形体
C. 和 互为同系物 D.H 与 在元素周期表中处于同一主族
【答案】D
【解析】A.35Cl 和 37Cl 是 Cl 元素的两种不同核素,属于同种元素,错误;B.同素异形体是指同种元素组
成的不同种单质,而单晶硅为硅单质,而石英是 SiO2,两者不属于同素异形体,错误;C.同系物是指
结构相似,分子组成上相差若干个 CH2的有机化合物,HCOOH 和 HOCH2CHO 结构不相似,不属于同
系物,错误;D.H 和 Na 在元素周期表种均处于第 IA 族,正确;答案选 D。
3.[2019江苏] 反应NH4Cl+NaNO2 NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示
反应中相关微粒的化学用语正确的是
A.中子数为18的氯原子:
18
17 Cl
B.N2的结构式:N=N
C.Na+的结构示意图:
D.H2O的电子式:
【答案】D
【解析】
A.核素的表达式
A
Z X中 A 表示 X 原子的质量数,Z 表示 X 原子的质子数,则中子数=A-Z,中子数为 18
的氯原子为
35
17 Cl,A 项错误;
B.氮原子最外层电子数为 5,还需要 3 个电子(或形成 3 对共用电子对)达到 8 电子稳定结构,所以两
个氮原子共用 3 对电子,氮气的结构式为 N≡N,B 项错误;
C.钠原子的核外有 11 个电子,钠离子是由钠原子失去一个电子形成的,则钠离子核外有 10 个电子,
Na+的结构示意图为 ,C 项错误;
D.氧原子最外层有 6 个电子,两个氢原子分别和氧原子形成 1 对共用电子对,D 项正确。故选 D。
4.[2018 江苏]用化学用语表示 NH3+ HCl NH4Cl 中的相关微粒,其中正确的是
A.中子数为 8 的氮原子: B.HCl 的电子式:
C.NH3 的结构式: D.Cl−的结构示意图:
【答案】C
【解析】A 项,中子数为 8 的氮原子的质量数为 15,表示为 ,A 项错误;B 项,HCl 中只含共价键,
HCl 的电子式为 ,B 项错误;C 项,NH3中含 3 个 N-H 键,NH3 的结构式为 ,C 项正确;
D 项,Cl-最外层有 8 个电子,Cl-的结构示意图为 ,D 项错误;故选 C。
5.[2018 新课标Ⅲ]下列叙述正确的是
A.24 g 镁与 27 g 铝中,含有相同的质子数
B.同等质量的氧气和臭氧中,电子数相同
C.1 mol 重水与 1 mol 水中,中子数比为 2∶1
D.1 mol 乙烷和 1 mol 乙烯中,化学键数相同
【答案】B
【解析】本题考查的是物质结构,需要先分析该物质中含有的微观粒子或组成的情况,再结合题目说明
进行计算。
A.1 个 Mg 原子中有 12 个质子,1 个 Al 原子中有 13 个质子。24 g 镁和 27 g 铝各自的物质的量都是 1 mol,
所以 24 g 镁含有的质子数为 12 mol,27 g 铝含有的质子的物质的量为 13 mol,选项 A 错误。
B.设氧气和臭氧的质量都是 Xg,则氧气(O2)的物质的量为 mol,臭氧(O3)的物质的量为 mol,
所以两者含有的氧原子分别为 ×2= mol 和 ×3= mol,即此时氧气和臭氧中含有的氧原子是一
样多的,而每个氧原子都含有 8 个电子,所以同等质量的氧气和臭氧中一定含有相同的电子数,选项 B
正确。
C.重水为 ,其中 含有 1 个中子, 含有 8 个中子,所以 1 个重水分子含有 10 个中子,1 mol
重水含有 10 mol 中子。水为 ,其中 没有中子, 含有 8 个中子,所以 1 个水分子含有 8 个
中子,1 mol 水含有 8 mol 中子。两者的中子数之比为 10:8=5:4,选项 C 错误。
D.乙烷(C2H6)分子中有 6 个 C-H 键和 1 个 C-C 键,所以 1 mol 乙烷有 7 mol 共价键。乙烯(C2H4)
分子中有 4 个 C-H 键和 1 个 C=C,所以 1 mol 乙烯有 6 mol 共价键,选项 D 错误。
点睛:本题考查的是物质中含有的各种粒子或微观结构的问题,一般来说先计算物质基本微粒中含有多
少个需要计算的粒子或微观结构,再乘以该物质的物质的量,就可以计算出相应结果。
6.[2017 北京]2016 年 IUPAC 命名 117 号元素为 Ts(中文名“ ”,tián),Ts 的原子核外最外层电子数是
7。下列说法不正确...的是
A.Ts 是第七周期第ⅦA 族元素 B.Ts 的同位素原子具有相同的电子数
C.Ts 在同族元素中非金属性最弱 D.中子数为 176 的 Ts 核素符号是
176
117 Ts
【答案】D
【解析】元素周期表中第七周期 0 族应当排列 118 号元素。A、117 号元素位于 118 号左侧即ⅦA 族,所
以 Ts 是第七周期第ⅦA 族元素,A 正确;B、同位素是同种元素不同原子之间的互称,因此 Ts 的同位
素原子具有相同的电子数,B 正确;C、元素周期表同一列从上往下非金属性依次减弱,所以 Ts 在同族
元素中非金属性最弱,C 正确;D、中子数为 176 的 Ts 核素,其质量数为 176+117=293,所以这种核素
符号是
293
117 Ts ,D 错误。答案选 D。
7.[2016·江苏]下列有关化学用语表示正确的是
A.中子数为 10 的氧原子: 10
8 O
B.Mg2+的结构示意图:
C.硫化钠的电子式:
D.甲酸甲酯的结构简式:C2H4O2
【答案】B
【解析】A、在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数。因为质子数和中子
数之和是质量数,因此中子数为 10 的氧原子可表示为
18
8 O ,A 错误;B、Mg2+的质子数是 12,核外电子
数是 10,则镁离子的结构示意图为可表示为 ;B 正确;C、硫化钠为离子化合物,含有离子键,
电子式为 ,C 错误;D、甲酸甲酯的结构简式为 HCOOCH3,D 错误。答案选 B。
8.[2015·上海]中国科学技术名词审定委员会已确定第 116 号元素 Lv 的名称为 。关于
293
116 Lv 的叙述错误
的是
A.原子序数 116 B.中子数 177
C.核外电子数 116 D.相对原子质量 293
【答案】D
【解析】A.元素符号左下角表示的是原子核内的质子数,原子核内的质子数等于该元素的原子序数,
所以该元素的原子序数是 116,正确。B.在元素符号的左上角表示的是该元素原子的质量数,质量数就
是质子数与中子数的和,所以该原子的中子数是 293-116=177,正确。C.对于元素的原子来说,原子
核内的质子数等于原子核外的电子数,等于元素的原子序数,所以该原子的原子核外电子数 116,正确。
D.293 只表示该同位素原子的质量数,由于不知道该元素有几种同位素原子,各种同位素原子的含量是
多少,因此不能确定该元素的相对原子质量,错误。
相关文档
- 2021版新高考化学一轮复习专题7化2021-05-23 00:47:367页
- 高考化学一轮复习43硫及其重要化合2021-05-23 00:41:267页
- 2020版新高考化学(鲁京津琼)一轮复习2021-05-23 00:26:244页
- 新课程高考化学复习方法介2021-05-23 00:22:0766页
- 高考化学速率平衡图像专题练习题2021-05-23 00:17:214页
- 2020届高考化学一轮复习(苏教版)化学2021-05-23 00:14:256页
- 2020届高考化学一轮复习铁、铜及其2021-05-23 00:08:4710页
- 2014年版高考化学题目型十四有机反2021-05-22 23:58:455页
- 四川攀枝花市十二中新课标高考化学2021-05-22 23:57:3617页
- 备战2021 高考化学 加餐练1 物质的2021-05-22 23:55:348页