- 1.42 MB
- 2021-05-21 发布
- 1、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 2、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报QQ:3215808601
2017中考化学试题分类汇编——常见的酸和碱
1、(福州)几种常见物质的pH范围如表1,其中酸性最强的是
物质
酸奶
鸡蛋清
牙育
肥皂水
pH范围(常温)
4 ~ 5
7 ~ 8
8 ~ 9
10 ~ 11
表1
A. 酸奶 B. 鸡蛋清 C. 牙育 D. 肥皂水
2. (福州)下列应用与中和反应原理无关的是
A. 用浓硫酸干燥湿润的氧气
B. 用熟石灰改良酸性土壤
C. 服用含氢氧化铝的药物治疗胃酸过多
D. 用氢氧化钠溶液洗涤石油产品中的残留硫酸
3. (广州)常温下,下列说法错误的是
A. pH=2的溶液显酸性 B. pH=7的溶液显中性
C. 溶液的pH由5变成2,其酸性减弱
D. pH>10的土壤不适于种植农作物,因为碱性太强
4. (重庆A卷) 同样是清洁剂,炉具清洁剂有强碱性,而厕所清洁剂则有强酸性,用这两种清洁剂进行实验得到的结果一定有误的是B
A.测得炉具清洁剂pH=13 B. 测得厕所清洁剂pH=8
C. 炉具清洁剂使无色酚酞溶液变红 D. 厕所清洁剂使紫色石蕊溶液变红
5. (重庆B卷) 某同学用pH 试纸测得以下液体的pH ,实验过程中pH 试纸变成蓝色的是(C )
A、雨水pH=6 B、食醋pH=3
C、肥皂水pH=10 D、食盐水pH=7
(天津)一些食物的近似pH如下:
食物
葡萄汁
苹果汁
牛奶
鸡蛋清
pH
3.5~4.5
2.9~3.3
6.3~6.6
7.6~8.0
其中显碱性的食物是D
A. 葡萄汁 B. 苹果汁 C. 牛奶 D. 鸡蛋清
6. (宜宾)一些食物的近似pH值如下,下列说法中不正确的是
A.葡萄汁比苹果汁的酸性强 B.葡萄汁和苹果汁都能使石蕊试液变红
C.牛奶和鸡蛋清都接近中性 D.胃酸过多的人应少饮苹果汁
7. (上海)向一定量4%的氢氧化钠溶液中逐滴加入稀盐酸,有关分析错误的是( D )
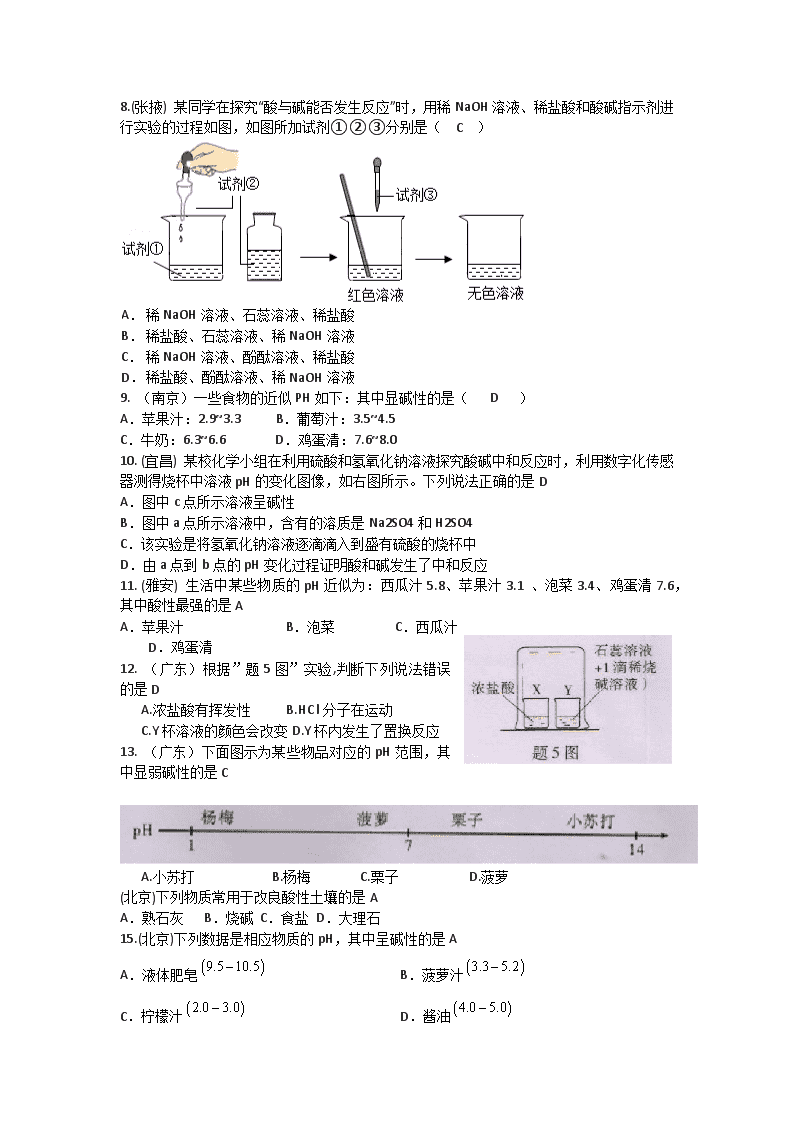
8.(张掖) 某同学在探究“酸与碱能否发生反应”时,用稀NaOH溶液、稀盐酸和酸碱指示剂进行实验的过程如图,如图所加试剂①②③分别是( C )
A.
稀NaOH溶液、石蕊溶液、稀盐酸
B.
稀盐酸、石蕊溶液、稀NaOH溶液
C.
稀NaOH溶液、酚酞溶液、稀盐酸
D.
稀盐酸、酚酞溶液、稀NaOH溶液
9. (南京)一些食物的近似PH如下:其中显碱性的是( D )
A.苹果汁:2.9~3.3 B.葡萄汁:3.5~4.5
C.牛奶:6.3~6.6 D.鸡蛋清:7.6~8.0
10. (宜昌) 某校化学小组在利用硫酸和氢氧化钠溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图像,如右图所示。下列说法正确的是D
A.图中c点所示溶液呈碱性
B.图中a点所示溶液中,含有的溶质是Na2SO4和H2SO4
C.该实验是将氢氧化钠溶液逐滴滴入到盛有硫酸的烧杯中
D.由a点到b点的pH变化过程证明酸和碱发生了中和反应
11. (雅安) 生活中某些物质的pH近似为:西瓜汁5.8、苹果汁3.1 、泡菜3.4、鸡蛋清7.6,其中酸性最强的是A
A.苹果汁 B.泡菜 C.西瓜汁 D.鸡蛋清
12. (广东)根据”题5图”实验,判断下列说法错误的是D
A.浓盐酸有挥发性 B.HC l分子在运动
C.Y杯溶液的颜色会改变D.Y杯内发生了置换反应
13. (广东)下面图示为某些物品对应的pH范围,其中显弱碱性的是C
A.小苏打 B.杨梅 C.栗子 D.菠萝
(北京)下列物质常用于改良酸性土壤的是A
A.熟石灰 B.烧碱 C.食盐 D.大理石
15.(北京)下列数据是相应物质的pH,其中呈碱性的是A
A.液体肥皂 B.菠萝汁
C.柠檬汁 D.酱油
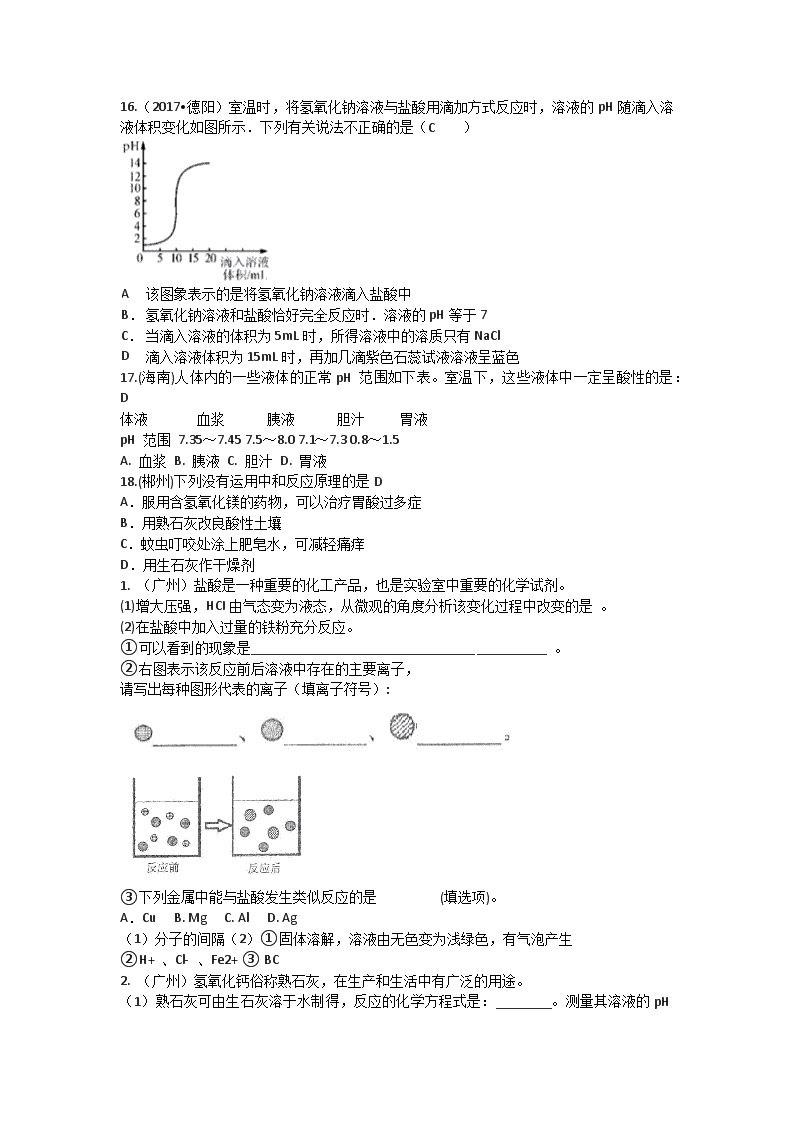
16.(2017•德阳)室温时,将氢氧化钠溶液与盐酸用滴加方式反应时,溶液的pH随滴入溶液体积变化如图所示.下列有关说法不正确的是(C )
A
该图象表示的是将氢氧化钠溶液滴入盐酸中
B.
氢氧化钠溶液和盐酸恰好完全反应时.溶液的pH等于7
C.
当滴入溶液的体积为5mL时,所得溶液中的溶质只有NaCl
D
滴入溶液体积为15mL时,再加几滴紫色石蕊试液溶液呈蓝色
17.(海南)人体内的一些液体的正常pH 范围如下表。室温下,这些液体中一定呈酸性的是:D
体液 血浆 胰液 胆汁 胃液
pH 范围 7.35~7.45 7.5~8.0 7.1~7.3 0.8~1.5
A. 血浆 B. 胰液 C. 胆汁 D. 胃液
18.(郴州)下列没有运用中和反应原理的是D
A.服用含氢氧化镁的药物,可以治疗胃酸过多症
B.用熟石灰改良酸性土壤
C.蚊虫叮咬处涂上肥皂水,可减轻痛痒
D.用生石灰作干燥剂
1. (广州)盐酸是一种重要的化工产品,也是实验室中重要的化学试剂。
(1)增大压强,HCI由气态变为液态,从微观的角度分析该变化过程中改变的是 。
(2)在盐酸中加入过量的铁粉充分反应。
①可以看到的现象是________________________________ __________ 。
②右图表示该反应前后溶液中存在的主要离子,
请写出每种图形代表的离子(填离子符号):
③下列金属中能与盐酸发生类似反应的是 (填选项)。
A.Cu B. Mg C. Al D. Ag
(1)分子的间隔(2)①固体溶解,溶液由无色变为浅绿色,有气泡产生
②H+ 、Cl- 、Fe2+ ③ BC
2. (广州)氢氧化钙俗称熟石灰,在生产和生活中有广泛的用途。
(1)熟石灰可由生石灰溶于水制得,反应的化学方程式是:________。测量其溶液的pH
时,可以________,再用标准比色卡比较试纸显示的颜色,读取该溶液的pH。
(2)用石灰浆粉刷墙壁,干燥后墙面变硬,反应的化学方程式是: 。
(3)用熟石灰来改良酸性土壤,反应的化学方程式是:________ (以土壤中含有硫酸为例)。
(4)用熟石灰粉与草木灰(主要成分是K2CO3)按一定比例混合可制得高效环保农药“黑白粉”。使用时,选择在有露水的早晨,把“黑白粉”撒在植物茎叶上,可消除忌碱虫体。
①“黑白粉”比熟石灰更高效,是由于生成了碱性更强的KOH,反应的化学方程式
是_______。
②“黑白粉”还可提供植物必需的营养素是_______(填元素符号)。
3. (益阳)将0.4%的氢氧化钠溶液滴加到2mL0.4%的盐酸中,测得混合液的pH变化曲线如右图。某学习小组对加入0~VmL氢氧化钠过程中,所得混合液pH增大原因进行了如下探究:
【猜想假设】
猜想Ⅰ:pH增大是因为盐酸被NaOH溶液稀释(或混合后溶液体积增大 ;
猜想Ⅱ:pH增大是因为发生了反应,写出反应方程式 NaOH+HCl=NaCl+H2O 。
【实验探究】
为验证猜想Ⅱ,请你帮助该小组完成下列实验。(可供选择的实验用品有:pH计、0.4%的氢氧化钠溶液、0.4%的盐酸、水。)
(1)向2mL0.4%的盐酸中加入VmL0.4%的氢氧化钠溶液,用pH计测得混合液的pH=7。
(2)向2mL0.4%的盐酸中加入VmL 水 ,用pH计测得混合液的pH < 7(填“>”、“=”或“<”)。
综合(1)和(2)证明猜想Ⅱ成立。
4. (苏州)2017年苏州市初中化学实验操作考查内容为“溶液酸碱性的检验”。请根据实
验回答下列问题。
⑴测得碳酸饮料的pH ▲ 7(填“<”或“=”或“>”)。
⑵下列使用pH试纸的方法中,正确的是 ▲ (填序号)。
A.将pH试纸剪成几段使用
B.将pH试纸直接插入待测液中
C.将pH试纸放在表面皿上,用干净的玻璃棒蘸取待测液滴在pH试纸上
D.将pH试纸湿润后放在表面皿上,用干净的玻璃棒蘸取待测液滴在pH试纸上
E.读数时,在30秒内将pH试纸呈现的颜色与标准比色卡对照
⑶本次实验中滴管使用出现了如图6~图9所示的四种常见错误操作。请你从这四幅图中任意选择一幅(请写明所选图的序号),具体说明改正错误的方法 ▲ 。
图6 图7 图8 图9
⑷使用白色点滴板完成实验有显色明显、便于对比、 ▲ (填一项)等优点。
⑴<7⑵ACE⑶ (任答其中一点)
图6,用滴管吸取液体时,应先捏扁胶头赶尽气体,再伸入试剂瓶中吸液
图7,滴管应放在洁净的烧杯内
图8,滴瓶上的滴管用后应不经洗涤直接放回原滴瓶
图9,应将滴管尖口向下
⑷节约药品
5. (苏州)中和反应在工农业生产和生活中有广泛的应用。某学生课外兴趣小组对中和反应进行研究。
⑴对于没有明显实验现象产生的中和反应,如稀盐酸与稀氢氧化钠溶液的反应,要证明它们之间确实发生了化学反应,可通过如下实验来进行。
①在盛有稀氢氧化钠溶液的烧杯中,滴加2~3滴酚酞试液,用胶头滴管吸取稀盐酸逐滴加入到上述烧杯中,边滴边用玻璃棒搅拌,当观察到 ▲ 现象时,说明它们之间发生了中和反应,且恰好完全反应。
②将稀盐酸逐滴匀速加入一定量的稀氢氧化钠溶液中,用数字化仪器对反应过程中溶液的温度、pH进行实时测定,得到的曲线如图10、图11所示。
由图10、图11可知,稀盐酸与稀氢氧化钠溶液已发生中和反应的判断依据是 ▲ 。
⑵对于某些有明显实验现象产生的中和反应,如稀硫酸与氢氧化钡溶液的反应,只要将稀硫酸滴加到氢氧化钡溶液中,观察到 ▲ 现象,就可说明反应已经发生。该反应的化学方程式是 ▲ 。
⑴①溶液由红色变为无色
②一段时间内溶液的温度升高 ,溶液pH明显下降直至小于7
⑵生成白色沉淀;Ba(OH)2+H2SO4=BaSO4↓+2H2O
6. (重庆A卷) 氧化钙俗名生石灰,某同学 针对氧化钙设计了如下实验方案:
(1)A中发生反应的化学方程式为___________。分离B中难溶物的操作I叫_________。
(2)如果要用实验证明C中不是水而是一种溶液,可以选择下列______(填序号)进行试验。
①稀盐酸 ②酚酞溶液 ③二氧化碳 ④氯化钠溶液
(3)操作II是加入某种物质使无色澄清液出现白色固体,如果加入的是饱和碳酸钠溶液,白色固体的化学式是___________;如果加入的是固体氢氧化钠(全部溶解),白色固体的化学式是___________。
(1)CaO + H2O == Ca(OH)2;过滤(2)②③(3)CaCO3;Ca(OH)2
7. (重庆B卷) 硫酸厂的废水中因含硫酸而显酸性,需要处理呈中性后才能排放。某兴趣小组的同学取少量废水按下列步骤进行实验。
第一步:验证废水酸性。往废水中滴加石蕊试液,石蕊变 ,说明废水呈酸性。第二步:处理废水。该小组同学设计了以下两个方案。
方案一:用熟石灰处理废水,其反应的化学方程式为 。
方案二:用BaCl2处理废水,观察到废水中出现 。
经过分析,同学们认为方案二没有达到处理废水的目的,因为处理后的废水中含有较多的
。
第一步:红;方案一:Ca(OH)2 + H2SO 4 = = CaSO4 + 2H2O;
方案二:白色沉淀(或浑浊);盐酸
8. (重庆B卷) 氢氧化钠和氢氧化钙是两种常见的碱。李红同学将两种碱的溶液分别装人试管A 、B 中,并进行了如下图所示的三组实验。
(1)实验l 中,两支试管的溶液都变成 色。
(2)实验2中,若B 盛装的是NaOH 溶液,发生反应的化学方程式为 ,
该反应的墓本类型是 反应。
(3)实验3中,李红同学向两支试管吹气,A 中有白色沉淀生成,发生反应的化学方程式为 。B 中无现象,为了探究吹气后B 中溶质的成分,李红进行了如下探究。
提出猜想:
猜想1 :溶质只有氢氧化钠
猜想2 :溶质只有碳酸钠
猜想3 :溶质有氢氧化钠和碳酸钠
……
实验和结论:
实验
实验现象
结论
取B 中少量溶液,加人澄清石灰水至不再
产生沉淀为止,过滤后取上层清液,
向其中加几滴酚酞试液。
产生白色沉淀
溶液呈现红色
猜想3成立
反思与评价:
老师评价李红得出的结论不正确,是因为猜想 (填数字)也会产生相同的现象。如果要验证“猜想3成立”,必须要换试剂,将 溶液换成 溶液。
(1)红;(2)2NaOH + CuSO4 == Na2SO4 + Cu(OH)2↓;复分解
(3)Ca(OH)2 + CO2 == CaCO3↓+ H2O反思与评价:2;氢氧化钙;氯化钙等
9. (2017•台州)如图为酸碱的化学性质知识网络,A、B、C、D是四种常见的不同类别的无机化合物,图中短线表示两种物质在一定条件下可以发生化学反应.请你据图回答.
(1)A、B、C三种物质中,能用来鉴别稀硫酸与氢氧化钙溶液的物质是 Cu(OH)2、CO2 .
(2)能同时实现反应①和②的物质可以是 Na2CO3(碳酸钠) ,反应①的实验现象为 有气泡(气体)产生 .
10. (南昌) 某校同学开展了如下“溶液酸碱性的检验”的实验活动:
(1)把自制的紫色紫薯汁按图1所示分别滴加到试管中,观察到的现象如下表所示:
溶液
白醋
盐酸
蔗糖水
草木灰水
石灰水
加入紫薯汁后的颜色
红色
红色
紫色
绿色
绿色
①图1中存放紫薯汁的仪器名称
②据上表推测,紫薯汁能做酸碱指示剂,遇到稀硫酸溶液可能显示的颜色是 ;
(2)用PH试纸测定图1中部分溶液的酸碱度:草木灰水pH>7,属于 (填“酸性”“中性”或“碱性”)溶液,白醋pH (填“>””<”或”=”)7;
(3)图2是三位同学分别测定土壤酸碱度的操作示意图,其中正确的是
(填“A”“B”或“C”,下同),可能导致北侧溶液pH数值发生改变的错误操作是 。
由图可知仪器的名称是滴瓶。由表格可知紫薯汁遇酸变红,固遇到稀硫酸显示的颜色也是红色。第二小题中只要牢记溶液PH<7为酸性,PH>7为碱性。根据PH值测量方法可知B是正确的,C操作中溶液被稀释,所以PH数值会发生变化。
11. (黄冈)构建模型和构建知识网络是化学学习中重要的学习方法,李华同学利用左手构建酸的性质知识网络,如图所示,请结合图示回答下列问题:
(1)如用湿润的pH试纸测定盐酸的pH,则结果会_________(填“偏大”、“偏小”、“无影响”)。
(2)图中①的现象是:__________________________。
(3)写出一个符合图中③的化学方程式________________________________。
(4)图中性质④属于__________________反应(填基本反应类型)。
(5)图中⑤的性质在工业上可用于____________________(填用途)。
(1)偏大 (2)石蕊变红 (3)HCl+AgNO3=AgCl↓+HNO3(合理即可) (4)复分解(5)盐酸除铁锈(合理即可)
12. (孝感)做完氢氧化钠与稀硫酸中和反应的实验后,兴趣小组的同学对反应后溶液中的溶质成分产生了兴趣,请你与他们一起进行以下探究。
【提出问题】溶液中的溶质是什么物质?
【作出猜想】(1)甲同学认为溶液中的溶质只有Na2SO4一种物质。
(2)乙同学认为溶液中的溶质是Na2SO4和 两种物质。
(3)丙同学认为溶液中的溶质是Na2SO4和NaOH两种物质。
【查阅资料】①Na2SO4溶液显中性。
②Al与强碱NaOH溶液反应生成偏铝酸钠(NaAlO2)等物质。
【实验验证】
实验操作
实验现象
实验结论
乙同学
实验
取中和反应后的溶液少许于试管中,将表面反复打磨后的铝片放入试管的溶液中
铝片逐渐溶解,并有大量气泡冒出,收集气体点燃,火焰呈淡蓝色
猜想(2)成立
丙同学
实验
取中和反应后的溶液少许于试管中,向试管中滴加几滴无色酚酞试液
溶液变 色
猜想(3)成立
【总结反思】丁同学根据乙、丙两位同学的实验现象,首先肯定猜想(1)不成立。经过进一步分析,丁同学认为猜想(2)也不成立,他的理由是
。兴趣小组的同学经过充分讨论,一致认为猜想(3)成立。
【知识拓展】(1)生活中能否用铝制品来盛放强碱性溶液? (填“能”或“不能”)
(2)乙同学的实验中铝片与 溶液发生了反应,请写出铝与该溶液发生反应的化学方程式 。
(2)H2SO4(硫酸) 红
滴入酚酞试液后,溶液变红色,说明溶液呈碱性,溶液中不可能含有硫酸。
(1)不能(2)NaOH(氢氧化钠) Al+2NaOH+2H2O=====2NaAlO2+3H2↑
13. (厦门)有关NaOH与CO2反应的探究
探究一:检验NaOH固体样品露置空气中一段时间后的成分
【查阅资料】Na2CO3溶液是碱性;KCl溶液、BaCl2溶液显中性、BaCO3难溶于水。
(1)检验样品是否变质。检验样品成分中是否含碳酸根的实验方法(操作、现象及结论):___________________________________________________________________。
(2)检验样品是否完全变质。实验操作:取样品加水溶解,先加过量的_________(填编号,下同),再滴加________。
A.盐酸 B.KCl溶液 C.BaCl2溶液 D.Ba(OH)2溶液 E.酚酞试液
探究二:用NaOH溶液测定空气中酸性气体(CO2、SO2)的体积分数
【实验装置】如图8所示,向细玻璃管内注入少量水,形成一段水柱;经检查该装置气密性良好。已知细玻璃管单位长度的容积为0.1mL·cm—1。水柱的质量忽略不计。
【操作步骤】保持外界条件不变,完成以下操作:
将40mL浓NaOH溶液迅速倒入烧瓶内,立即塞紧橡皮塞,并在细玻璃管上标记水柱底部的位置
观察并测量得出水柱缓慢向下移动的距离为2.0cm;
实验结束后,根据①中的标记,测得该标记以下细玻璃管及烧瓶的总容积为340mL。
(3)检查图8装置气密性的操作方法:___________________________
___________________________________________________。
(4)仅根据本次测量数据,该气体样品中酸性气体的体积分数为________(精确到0.00001)。
(5)在上述操作步骤②中,若装置温度略有升高,实验结果______(填“偏大”、“不变”或“偏小”)。
探究一:(1)取少量该样品,加入足量的稀盐酸,若有气体生成,把生成的气体通入澄清的石灰水,石灰水变浑浊,说明该样品成分中含碳酸根。(3分)(2)C E
探究二:(3)将图中装置直立于桌面一段时间后,如果水柱位置不发生移动,则说明装置气密性良好。(或其他合理答案,2分)(4)0.067%(2分)(5)偏小
14. (眉山) 观察下图并回答问题:
由上图可知,HCl与NaOH的反应实质是H+ 和OH- 之间的反应,此反应可表示为:H++0H-=H2O。像这种用实际参与反应的离子来表示反应的式子称为离子方程式。任何复分解反应都可用离子方程式来表示。
[练习] 按照书写化学方程式的要求写出下列反应的离子方程式
HCl溶液与AgNO 溶液反应: 。
HNO溶液与NaCO溶液反应: 。
[归纳] 复分解反应的实质是:阴阳离子结合生成 的反应。
[应用] 判断在水溶液中一定能大量共存的离子组是 。
a、Na+、H+、Cl-、CO32- b、H+、Ba2+、Cl-、SO42-
c、Cu2+、Na+、NO3-、OH- d、H+、K+、Cl-、SO42-
[练习] Ag+ + Cl- = AgCl↓ 2H+ + CO32- = CO2↑+ H2O[归纳] 沉淀、气体和水 d
15.(北京)亮亮做家务时接触到下列用品。
用品
脱氧剂
洁厕灵
炉灶清洁剂
有效成分
还原铁粉
盐酸
氢氧化钠
(1)他清理垃圾时发现一袋脱氧剂,拆开后看到还原铁粉已生锈,铁生锈的原因是 。
(2)他选用洁厕灵清除水垢(主要成分是碳酸钙),用化学方程式表示其原理 。
(3)他清洗炉灶时戴上橡胶手套,以防清洁剂与皮肤直接接触,其原因是 。
(4)做完家务,他用Vc泡腾片冲了一杯饮料。下列Vc泡腾片的主要成分中,属于有机物的是 (填字母序号)。
A.维生素C() B.柠檬酸() C.碳酸氢钠()
1)与潮湿的空气接触(2)
(3)有强腐蚀性(4)A,B
16.(北京)利用下图装置进行实验。实验前、、均已关闭。
内容
装置
【实验1】制备气体
【实验2】测定气体含量
Ⅰ.打开,用注射器向盛有锌粒的A中注入稀硫酸,直至液面浸没下端导管口
Ⅱ.在上方导管口收集气体
Ⅰ.A(容积)中为用排空气法收集的,B中装满水。用注射器向A中注入15mL NaOH溶液(足量),充分反应
Ⅱ.打开和
(1)检查装置气密性:保持关闭,打开、,向B中加水至液面浸没下端导管口,用手捂住A瓶外壁,说明装置在左侧气密性良好的现象是 ;用同样原理可以检查装置另一侧的气密性。
(2)实验1中,锌与稀硫酸反应的化学方程式为 ;气体收集完毕后,在不拆卸装置的情况下,使A中未反应的稀硫酸大部分转移到B中的操作是 。
(3)实验2中,当B中液面不再变化时,测得B中减少了160mL水,则A中的体积分数约为 %。
(1)B装置左侧导管口有气泡冒出(2)
(3)打开,,关闭(4)50%
17.(北京)众所周知,酚酞溶液遇溶液变红。但是,在分组实验中(如右图所示),出现了意想不到的现象:有的溶液变红后褪色;有的出现白色浑浊物。
【提出问题】分组实验中,出现意想不到的现象的原因是什么呢?
【查阅资料】酚酞溶液由酚酞固体溶于酒精配制而成。
【猜想与假设】
Ⅰ.红色褪去,与溶液和空气中的反应有关。
Ⅱ.红色褪去,与NaOH溶液的浓度有关。
Ⅲ.出现白色浑浊物,与酚酞溶液的浓度有关。
【进行实验】
实验
实验操作
实验现象
1
向盛有2 mL 溶液的试管中滴加5滴0.5%的酚酞溶液
溶液变红
2
1号试管红色褪去
2号试管5min红色褪去
3号试管30min红色明显变浅
4号试管120min红色无明显变化
3
取3支试管,分别加入2 mL水,……
酚酞溶液浓度/%
浑浊程度
5
大量浑浊物
2
少量浑浊物
无浑浊物
【解释与结论】
(1)与反应的化学方程式为 。
(2)实验1的现象表明,猜想与假设1 (填“成立”或“不成立”)。
(3)由实验2得出结论:出现“溶液变红后褪色”现象的原因是 。
(4)实验3的操作步骤:取3支试管,分别加入水, 。
【反思与评价】
(5)依据现有实验,为了确保红色不变,若酚酞溶液浓度为,建议选用NaOH溶液的浓度为 %。
(6)有同学认为,仅通过实验3得出“猜想与假设Ⅲ成立”证据不足,理由是 。
1)(2)不成立
(3)与浓度有关,浓度过高会使酚酞褪色
(4)分别向三支试管中滴加5滴5%,2%,0.5%的酚酞溶液(5)
18.(成都)用氢氧化钠溶液、稀盐酸和酚酞溶液。按下图步骤进行实验。
回答下列问题(1)无色溶液A 是 ,仪器C 的名称是 。
(2)实验中滴入酚酞溶液的目的是
(3)实验中反应的化学方程式是
(4)步骤⑤的操作名称是 ,当出现较多量固体时应
(5)实验步骤②和③两次使用了滴管,用完后需要洗涤的是 (填②或③)。
19.(海南)某化学兴趣小组同学为了探究实验室中的氢氧化钠固体是否变质,进行了有关
实验。请你与他们一起完成以下探究活动:
【猜想】
猜想I: 没有变质;
猜想Ⅱ:已经变质;
【实验和推断】
(1)加入的适量 A 溶液是 (填名称),若现象a为有气泡产生,则说明氢氧化钠
已经变质。
(2)若现象b为 ,说明氢氧化钠没有变质。
【反思】氢氧化钠的保存方法是 (填“A”或“B”)。
A.密封保存 B. 不需密封保存
20.(陕西)下图是甲、乙两位同学一起在实验室进行的氢氧化钠与盐酸中和反应的实验。
(说明:图中A1、A2、A3、B1、B2、B3均为溶液编号)
根据上图实验,请你与甲、乙同学一起完成下列探究:
探究环节
甲同学的探究
乙同学的探究
提出问题
A3溶液为什么不变红?
B3溶液中溶质成分是什么?(酚酞不计)
作出猜想
实验过程中,酚酞变质了。
猜想一:NaCl 猜想二:NaCl、HCl
实验验证
(1)取少量A3溶液于另一试管中,向其中滴加NaOH溶液,溶液变红,说明甲同学的猜想 (填“成立”或“不成立”)。
(2)你认为,在常温下A2溶液测出的pH应 (填“>”、“=”或“<”)7。
取少量B3溶液加入盛有少量铁粉的试管中,观察到有无色气泡产生,固体逐渐减少,溶液由无色变为 。据此,你认为乙同学的猜想 (填“一”或“二”)成立。
交流反思
(1)甲、乙同学的实验中,反应均涉及到的化学方程式是 。
(2)A3溶液未变红,你认为原因是A2溶液中 较多,加入的NaOH溶液未将其完全中和。
(3)甲、乙同学经过实验对比探究,一致认为做化学实验时应注意药品用量的控制。
21.(2017•株洲)醋酸(CH3COOH)是一种常见的酸,具有酸的通性.例如:醋酸与氢氧化钠溶液反应生成醋酸钠和水,化学方程式为:CH3COOH+NaOH=CH3COONa+H2O.
(1)氢氧化钾与氢氧化钠一样,也是一种常见的碱,具有碱的通性.请写出醋酸与氢氧化钾溶液发生中和反应生成的盐的化学式 CH3COOK .
(2)醋酸与盐酸一样,能与活泼金属反应生成氢气.请写出醋酸与金属锌反应的化学方程式 2CH3COOH+Zn=(CH3COO)2Zn+H2↑ .
相关文档
- 精品解析:江西省2020年中考语文试题2021-05-21 12:21:4718页
- 宁夏中考化学试卷及答案2021-05-21 12:21:346页
- 张静中学中考语文试题汇编之中考语2021-05-21 12:21:2915页
- 中考数学类比探究专题复习doc中考2021-05-21 12:20:339页
- 2020版高考物理二轮复习第2部分附2021-05-21 12:20:045页
- 相似三角形知识点整理及习题中考经2021-05-21 12:19:106页
- 【历史】西藏拉萨市拉萨中学2019-22021-05-21 12:19:0017页
- 2015杭州中考数学试卷解析答案word2021-05-21 12:19:008页
- 福建省三明第一中学2019-2020学年2021-05-21 12:18:3910页
- 广州市海珠区中考化学一模试卷2021-05-21 12:18:299页