- 926.00 KB
- 2021-05-20 发布
- 1、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 2、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报QQ:3215808601
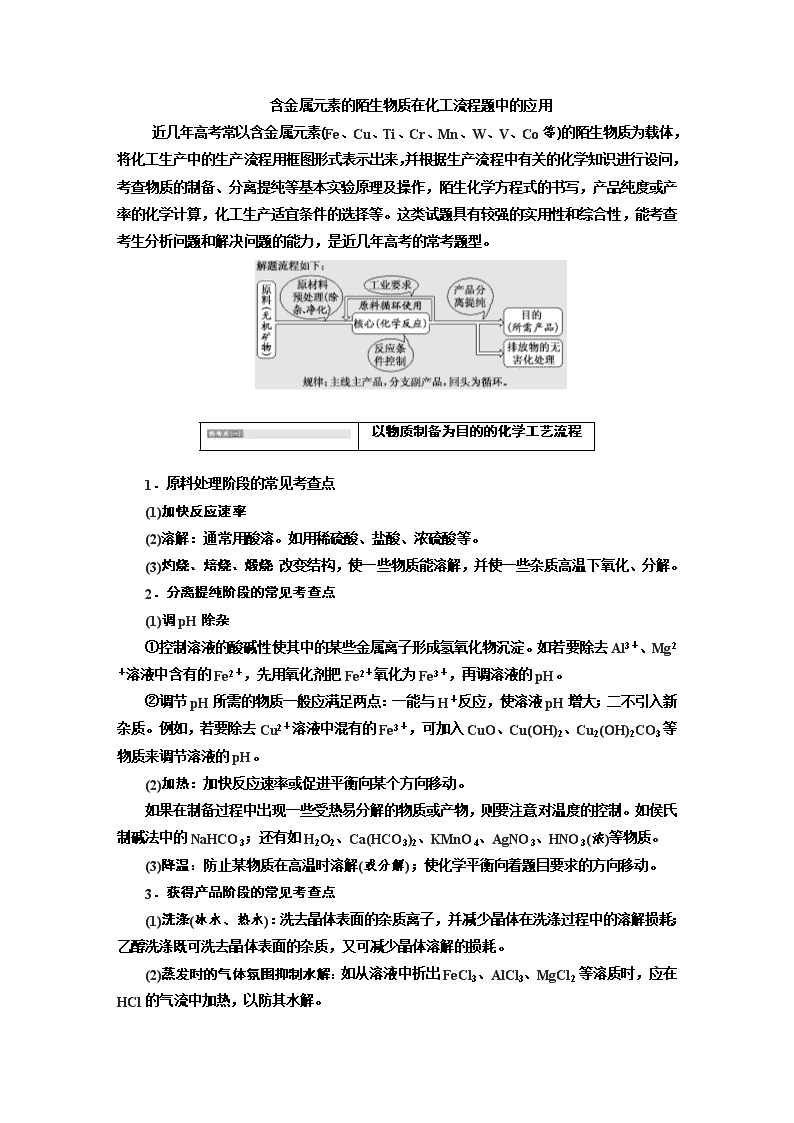
含金属元素的陌生物质在化工流程题中的应用
近几年高考常以含金属元素(Fe、Cu、Ti、Cr、Mn、W、V、Co等)的陌生物质为载体,将化工生产中的生产流程用框图形式表示出来,并根据生产流程中有关的化学知识进行设问,考查物质的制备、分离提纯等基本实验原理及操作,陌生化学方程式的书写,产品纯度或产率的化学计算,化工生产适宜条件的选择等。这类试题具有较强的实用性和综合性,能考查考生分析问题和解决问题的能力,是近几年高考的常考题型。
以物质制备为目的的化学工艺流程
1.原料处理阶段的常见考查点
(1)加快反应速率
(2)溶解:通常用酸溶。如用稀硫酸、盐酸、浓硫酸等。
(3)灼烧、焙烧、煅烧:改变结构,使一些物质能溶解,并使一些杂质高温下氧化、分解。
2.分离提纯阶段的常见考查点
(1)调pH除杂
①控制溶液的酸碱性使其中的某些金属离子形成氢氧化物沉淀。如若要除去Al3+、Mg2+溶液中含有的Fe2+,先用氧化剂把Fe2+氧化为Fe3+,再调溶液的pH。
②调节pH所需的物质一般应满足两点:一能与H+反应,使溶液pH增大;二不引入新杂质。例如,若要除去Cu2+溶液中混有的Fe3+,可加入CuO、Cu(OH)2、Cu2(OH)2CO3等物质来调节溶液的pH。
(2)加热:加快反应速率或促进平衡向某个方向移动。
如果在制备过程中出现一些受热易分解的物质或产物,则要注意对温度的控制。如侯氏制碱法中的NaHCO3;还有如H2O2、Ca(HCO3)2、KMnO4、AgNO3、HNO3(浓)等物质。
(3)降温:防止某物质在高温时溶解(或分解);使化学平衡向着题目要求的方向移动。
3.获得产品阶段的常见考查点
(1)洗涤(冰水、热水):洗去晶体表面的杂质离子,并减少晶体在洗涤过程中的溶解损耗;乙醇洗涤既可洗去晶体表面的杂质,又可减少晶体溶解的损耗。
(2)蒸发时的气体氛围抑制水解:如从溶液中析出FeCl3、AlCl3、MgCl2等溶质时,应在HCl的气流中加热,以防其水解。
(3)蒸发浓缩、冷却结晶:如NaCl和K2Cr2O7混合溶液,若将混合溶液加热蒸发后再降温,则析出的固体主要是K2Cr2O7,这样就可分离出大部分K2Cr2O7;同样原理可除去KNO3中的少量NaCl。
(4)蒸发结晶、趁热过滤:如NaCl和K2Cr2O7混合溶液,若将混合溶液蒸发一段时间,析出的固体主要是NaCl,同样原理可除去NaCl中的少量KNO3。
[典例1] (2017·全国卷Ⅰ)Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备。工艺流程如下:
回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如图所示。由图可知,当铁的浸出率为70%时,所采用的实验条件为__________________________。
(2)“酸浸”后,钛主要以TiOCl形式存在,写出相应反应的离子方程式:________________________________________________________________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃
30
35
40
45
50
TiO2·xH2O转化率/%
92
95
97
93
88
分析40 ℃时TiO2·xH2O转化率最高的原因_____________________________
________________________________________________________________________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为________。
(5)若“滤液②”中c(Mg2+)=0.02 mol·L-1,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5 mol·L-1,此时是否有Mg3(PO4)2沉淀生成?______________________(列式计算)。FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式:________________________________________________________________________。
[学审题析题]
[答案] (1)100 ℃、2 h,90 ℃、5 h
(2)FeTiO3+4H++4Cl-===Fe2++TiOCl+2H2O
(3)低于40 ℃,TiO2·xH2O转化反应速率随温度升高而增加;超过40 ℃,双氧水分解与氨气逸出导致TiO2·xH2O转化反应速率下降
(4)4
(5)Fe3+恰好沉淀完全时,c(PO)= mol·L-1=1.3×10-17mol·L-1,c3(Mg2+)·c2(PO)值为0.013×(1.3×10-17)2≈1.7×10-40
相关文档
- 2020届高考化学一轮复习化学反应速2021-05-20 13:59:4013页
- 2020版高考一轮复习化学通用版学案2021-05-20 12:49:3311页
- 2020届高考化学一轮复习化学反应速2021-05-20 11:23:2816页
- 2020届高考化学一轮复习化学平衡图2021-05-20 02:17:0225页
- 高考化学大一轮复习化学实验基础化2021-05-20 01:57:187页
- 2020届高考化学一轮复习化学反应速2021-05-19 22:14:169页
- 2021届高考化学一轮复习化学平衡图2021-05-19 19:12:5411页
- 2020届高考化学一轮复习化学常用计2021-05-19 14:15:469页
- 2020届高考化学一轮复习化学能与热2021-05-13 01:09:447页
- 山西专用高考化学一轮复习化学反应2021-05-12 22:14:3911页