- 728.00 KB
- 2021-05-10 发布
- 1、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 2、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报QQ:3215808601
第四章检测题
(时间:90分钟 满分:100分)
一、选择题(本题包括15个小题,每小题3分,共45分。每小题仅有一个选项符合题意)
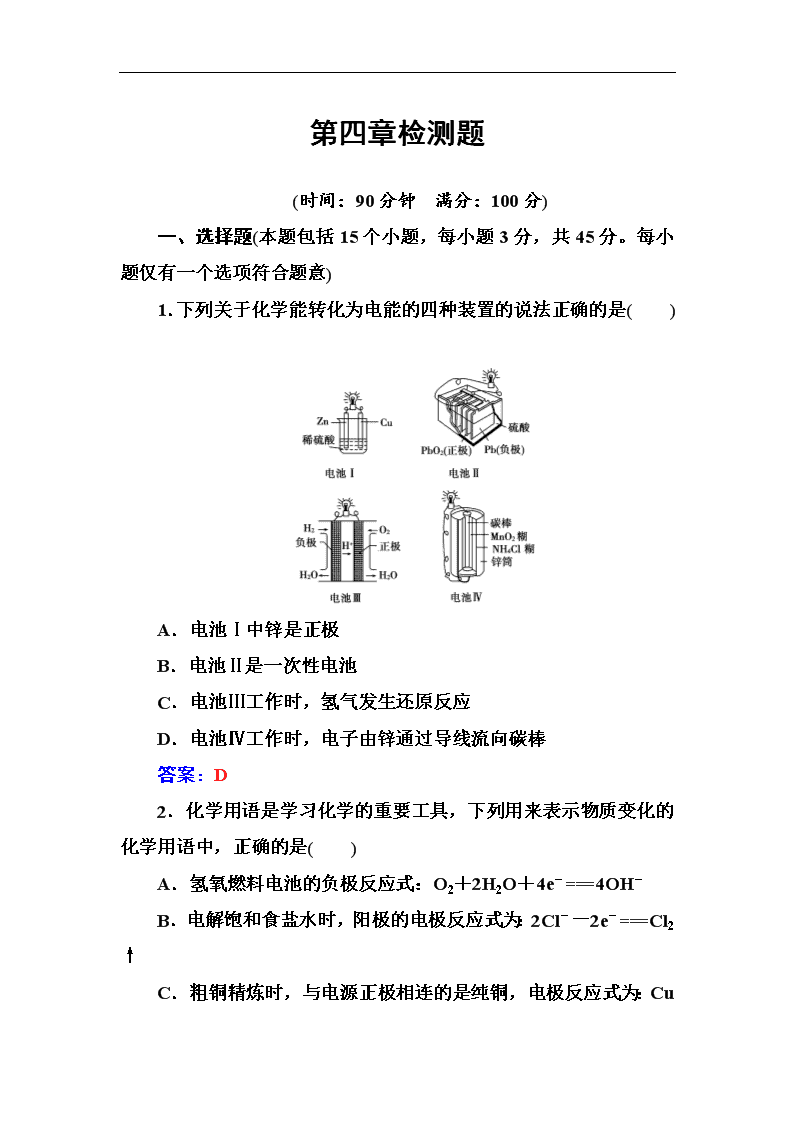
1.下列关于化学能转化为电能的四种装置的说法正确的是( )
A.电池Ⅰ中锌是正极
B.电池Ⅱ是一次性电池
C.电池Ⅲ工作时,氢气发生还原反应
D.电池Ⅳ工作时,电子由锌通过导线流向碳棒
答案:D
2.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.氢氧燃料电池的负极反应式:O2+2H2O+4e-===4OH-
B.电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-===Cl2↑
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu
--2e-===Cu2+
D.钢铁发生电化学腐蚀的正极反应式:Fe-2e-===Fe2+
答案:B
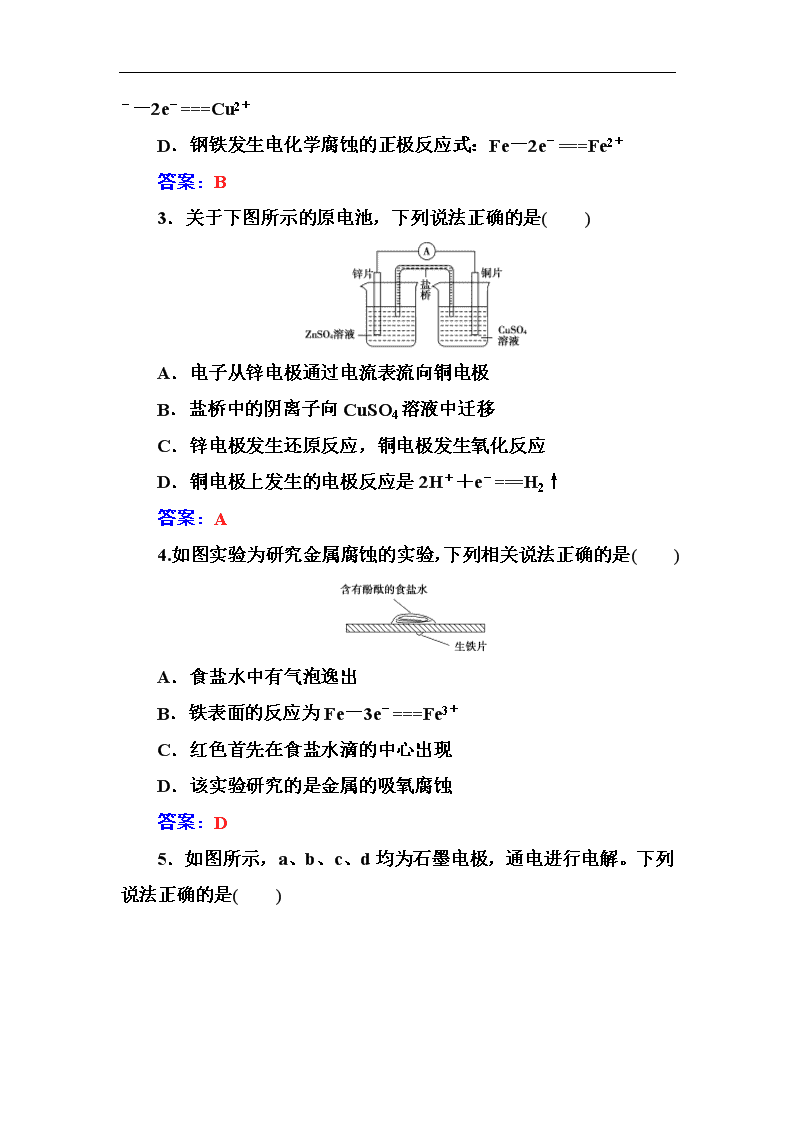
3.关于下图所示的原电池,下列说法正确的是( )
A.电子从锌电极通过电流表流向铜电极
B.盐桥中的阴离子向CuSO4溶液中迁移
C.锌电极发生还原反应,铜电极发生氧化反应
D.铜电极上发生的电极反应是2H++e-===H2↑
答案:A
4.如图实验为研究金属腐蚀的实验,下列相关说法正确的是( )
A.食盐水中有气泡逸出
B.铁表面的反应为Fe-3e-===Fe3+
C.红色首先在食盐水滴的中心出现
D.该实验研究的是金属的吸氧腐蚀
答案:D
5.如图所示,a、b、c、d均为石墨电极,通电进行电解。下列说法正确的是( )
A.乙池中d的电极反应为:2Cl--2e-===Cl2↑
B.a、c两极产生气体的物质的量相等
C.甲、乙两池中溶液的pH均保持不变
D.乙池中发生的反应为:2NaCl+2H2O2NaOH+H2↑+Cl2↑
答案:D
6.我国某大城市今年夏季多次降下酸雨。据环保部门测定,该城市整个夏季酸雨的pH平均为3.2。在这种环境中的铁制品极易被腐蚀。对此条件下铁的腐蚀的叙述不正确的是( )
A.此腐蚀过程有化学腐蚀也有电化学腐蚀
B.发生电化学腐蚀时的正极反应为2H2O+O2+4e-===4OH-
C.在化学腐蚀过程中有氢气产生
D.发生电化学腐蚀时的负极反应为Fe-2e-===Fe2+
答案:B
7.两电极用导线连接插入电解质溶液中(不考虑溶液中溶解的氧气的影响),你认为不能构成原电池的是( )
选项
A
B
C
D
电极材料
Zn
Fe
Cu
Al
电极材料
Cu
Zn
Ag
Sn
电解质溶液
CuCl2
溶液
H2SO4
溶液
CuSO4
溶液
NaOH
溶液
答案:C
8.关于如图所示装置的叙述正确的是( )
A.甲、乙装置中的锌片都作负极
B.甲、乙装置中的溶液内的H+在铜片被还原
C.甲、乙装置中锌片上发生的反应都是还原反应
D.甲装置中铜片有气泡生成,乙装置中的铜片质量减小
答案:D
9.一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应为:2C2H6 +7O2+8KOH===4K2CO3+10H2O,有关此电池的推断正确的是( )
A.正极反应为14H2O+7O2+28e-===28OH-
B.放电一段时间后,负极周围的pH升高
C.每消耗1 mol C2H6 ,则电路上转移的电子为12 mol
D.放电过程中KOH的物质的量浓度不变
答案:A
10.某学生欲完成反应2HCl+2Ag===2AgCl↓+H2↑而设计了下列四个实验,你认为可行的是( )
答案:C
11.如图所示,X、Y分别是直流电源的两极,
通电后发现a极板质量增加,b极板处有无色、无味气体放出。符合这一情况的是下表中的( )
选项
a极板
b极板
X电极
Z溶液
A
锌
石墨
负极
CuSO4
B
石墨
石墨
正极
NaOH
C
银
铁
正极
AgNO3
D
铜
石墨
负极
CuCl2
答案:A
12.(2015·福建卷)某模拟“人工树叶”电化学实验装置如下图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是( )
A.该装置将化学能转化为光能和电能
B.该装置工作时,H+从b极区向a极区迁移
C.每生成1 mol O2,有44 g CO2被还原
D.a电极的反应为3CO2+18H+-18e-===C3H8O+5H2O
答案:B
13.如图所示原电池工作时,右池中Y2O转化为Y3+。下列叙述正确的是( )
A.左池电极反应式:X4++2e-===X2+
B.每消耗1 mol Y2O,转移3 mol电子
C.改变右池溶液的c(H+),电流强度不变
D.左池中阴离子数目增加
答案:D
14.(2015·浙江卷)在固态金属氧化物电解池中,高温共电解H2OCO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如下图所示。下列说法不正确的是( )
A.X是电源的负极
B.阴极的电极反应式是H2O+2e-===H2+O2-、CO2+2e-===CO+O2-
C.总反应可表示为H2O+CO2H2+CO+O2
D.阴、阳两极生成的气体的物质的量之比是1∶1
答案:D
15.按图甲装置进行实验,若图乙中横坐标x表示通过电极的电子的物质的量。下列叙述正确的是( )
A.F表示反应生成Cu的物质的量
B.E表示反应实际消耗H2O的物质的量
C.E表示反应生成O2的物质的量
D.F表示反应生成H2SO4的物质的量
答案:B
二、非选择题(本题包括5各小题,共55分)
16.(10分)已知电极材料:铁、铜、银、石墨、锌、铝;电解质溶液:CuCl2溶液、Fe2(SO4)3溶液、盐酸。按要求回答下列问题:
(1)电工操作上规定:不能把铜导线和铝导线连接在一起使用。请说明原因____________________________________________。
(2)若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,能否构成原电池?__________,若能,请写出电极反应式,负极__________________(若不能,此空不填)。
(3)若电池反应为:Cu+2H+===Cu2++H2↑,该池属于原电池还是电解池?________,请写出各电极的电极材料和电解质溶液:______________,______________。
解析:(1)若把铜、铝导线连接在一起使用与外界空气及水分构成原电池,铝作负极,加速铝腐蚀,使其使用寿命缩短。(2)因为Cu+2Fe3+===Cu2++2Fe2+,所以能构成原电池,其负极Cu-2e-
===Cu2+。
(3)因为该反应是非自发反应,故此电池反应是电解池,其电极反应式为:阳极:Cu-2e-===Cu2+ 阴极:2H++2e-===H2↑。
答案:(1)因二者连接在潮湿的环境构成原电池,加速铝腐蚀,使其使用寿命缩短
(2)能 Cu-2e-===Cu2+
(3)电解池 阳极为Cu、阴极为Cu、Ag或石墨 盐酸
17.(10分) Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或“负极”)。
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是_____________________________________
___________________________________________________。
欲除去Cu2+,最好选用下列试剂中的________(填代号)。
a.NaOH b.Zn c.Fe d.NH3·H2O
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是_______________________________。
若电解电路中通过2 mol电子,MnO2的理论产量为________g。
解析:(1)原电池的负极是发生氧化反应的一极:Zn-2e-===Zn2+;电池工作时,电子从负极流向正极。
(2)Zn与Cu2+发生氧化还原反应,生成的Cu附着在Zn的表面构成铜锌原电池,加快反应速率,从而加快Zn的腐蚀。
(3)电解池的阴极是发生还原反应的一极:2H++2e-===H2↑;每生成1 mol MnO2需转移2 mol电子,故每通过2 mol电子,
理论上生成1 mol MnO2,质量为87 g。
答案:(1)Zn(或锌) 正极 (2)锌与还原出来的铜构成铜-锌原电池而加快锌的腐蚀 b
(3)2H++2e-===H2↑ 87
18.(12分)如图,p、q为直流电源两极,A由+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D产生气泡。试回答:
(1)p为_____极,A极发生了________反应。
(2)C为____极,试管里收集到的气体是____;D为____极,试管里收集到的气体是_____。
(3)C极的电极反应方程式为_____________________________。
(4)当反应进行一段时间后,A、B电极附近溶液的pH________(填“增大”“减小”或“不变”)。
(5)当电路中通过0.004 mol电子时,B电极上沉积金属X为0.128 g,则此金属的摩尔质量为______。
解析:(1)接通电源,X沉积于B极,说明B为阴极,则A为阳极,故q为负极,p为正极,A上发生氧化反应。
(2)H2SO4电解池中,C为阳极,C试管内得O2,D为阴极,此试管内得H2。
(4)A极:X-2e-===X2+,B极:X2++2e-===X,两极附近pH不变。
(5)设X的摩尔质量为M g/mol,则
得M=64。
答案:(1)正 氧化 (2)阳 氧气 阴 氢气
(3)4OH--4e-===O2↑+2H2O (4)不变
(5)64 g/mol
19.(10分)按如图装置实验,A、B两烧杯分别盛放200 g 10% NaOH溶液和足量CuSO4溶液。通电一段时间后,c极上有Cu析出。又测得A杯溶液中NaOH的质量分数为10.23%,试回答:
(1)电源P为________极。
(2)b极产生气体的体积为_______L(标准状况)。
(3)c极上析出沉淀的质量为__________g。
(4)d极上所发生的电极反应式:_________________。
解析:B池中c极上有金属析出,说明它为阴极。由此可知,d、b为阳极,a为阴极。按照“正接阳,负接阴”的规律,电源P为负极。NaOH溶液电解为电解水,a极产生H2,b极产生O2;CuSO4溶液的电解为混合电解,d极产生O2,其电极反应式为:4OH--4e-===2H2O+O2↑。m(NaOH)=200 g×10%=20 g
电解后溶液的质量为:=195.5 g
被电解的水为:200 g-195.5 g=4.5 g,为0.25 mol。
由此可知,b极产生的O2为0.125 mol,即2.8 L。
根据总价数相等关系,O2的总价数等于Cu的总价数,可得:0.125 mol×4=n(Cu)×2,n(Cu=0.25 mol,即16 g。
答案:(1) 负 (2) 2.8 (3) 16 (4) 4OH--4e-===2H2O+O2↑
20.(13分)请用下图所示仪器装置设计一个包括:电解饱和食盐水并测定电解时产生的氢气的体积和检验氯气的氧化性的实验装置。
(1)所选仪器连接时,各接口的顺序是(填各接口的代号字母):A接________、________接________;B接________、________接________。
(2)实验时,装置中的石墨电极接电源的________极,所发生的电极反应式为______________;铁电极接电源的________极,所发生的电极反应式为______________;此电解总反应方程式为________。
(3)实验测得产生的氢气体积(已折算成标准状况)为5.60 mL,电解后溶液的体积恰好为50.0 mL,则溶液中OH-的浓度为___________。
解析:根据电解饱和食盐水阳极所发生的反应式:2Cl—-2e—===Cl2↑,为防止电极被腐蚀,实验中一般选用石墨
作阳极,阴极发生的是水电离出的H+离子被还原,2H++2e—===H2↑,从而破坏水的电离平衡,在阴极区域里形成氢氧化钠,显碱性,阴极通常使用铁电极。电解的总反应方程式为:2NaCl+2H2O2NaOH+H2↑+Cl2↑。U型管反应器中的两个电极未限定哪个是阳极或阴极
,可以任意选用。而反应器两边连接哪些仪器及其连接顺序,取决于A、B为哪种电极、其电极产物和实验要求。设A上电极为铁质电极、B上电极为石墨电极,则反应器两边所选用的各仪器接口连接顺序为A接贮气瓶的G―→F,把水挤入量筒上H导管,用量筒测量出排出的水量,以测定氢气产生的体积。B接洗气瓶的D―→E,生成的氯气在洗气瓶里氧化淀粉碘化钾溶液,以证明其氧化性,多余的氯气通入烧杯里的C导管,借助氢氧化钠吸收氯气,防止污染大气。
已知电解产生氢气5.60 mL,相当于=
2.5×10-4mol。
x=2×2.5×10-4mol=5×10-4mol
c(OH—)==0.01 mol·L—1。
答案:(1)G F H D E C (2)正极 2Cl--2e-===Cl2↑ 负极 2H++2e-===H2↑ 2NaCl+2H2O2NaOH+H2↑+Cl2↑
(3)c(OH—)=0.01 mol·L—1
相关文档
- 人教版高中化学选修4练习:第三章第2021-05-10 17:25:119页
- 人教版高中化学选修4练习:第一章第2021-05-10 10:45:069页
- 人教版高中化学选修4练习:第三章第2021-05-08 17:59:599页
- 人教版高中化学选修4练习:第一章检2021-05-08 16:26:5913页
- 人教版高中化学选修4练习:模块综合2021-04-25 19:17:1714页
- 人教版高中化学选修4练习:第四章第2021-04-21 22:42:0810页
- 人教版高中化学选修4练习:第二章第2021-04-21 18:33:259页
- 人教版高中化学选修4练习:第一章章2021-04-14 12:17:185页
- 人教版高中化学选修4练习:第三章第2021-04-13 22:10:0210页
- 人教版高中化学选修4练习:第二章第2021-04-13 09:48:4010页