- 83.60 KB
- 2021-05-09 发布
- 1、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 2、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报QQ:3215808601
(酸碱盐)
一、酸的通性
二、碱的通性
三、盐的性质
(以上内容这里请大家对照自己的笔记本进行复习,要仔细地看并且要异常熟练。常见的酸碱盐的特征物质和特征化学性质很重要,要好好看)
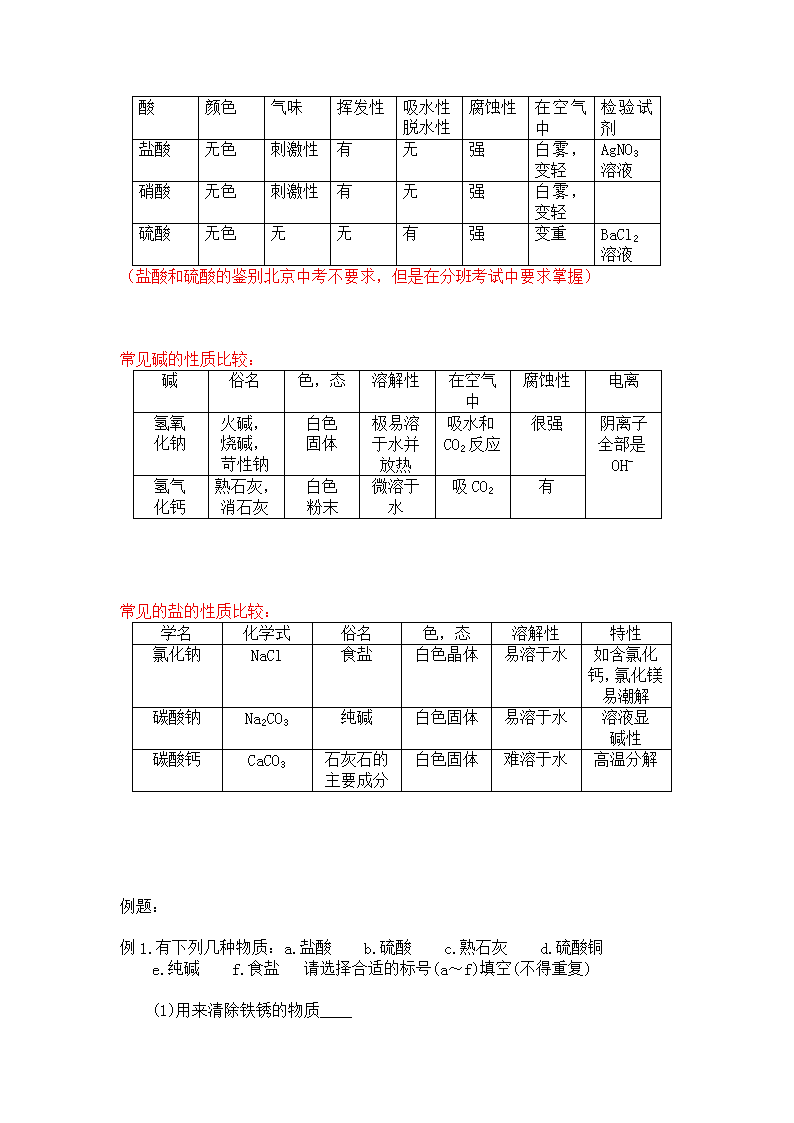
常见酸,碱,盐的性质比较:
常见的酸的性质比较:
酸
颜色
气味
挥发性
吸水性
脱水性
腐蚀性
在空气中
检验试剂
盐酸
无色
刺激性
有
无
强
白雾,变轻
AgNO3溶液
硝酸
无色
刺激性
有
无
强
白雾,变轻
硫酸
无色
无
无
有
强
变重
BaCl2溶液
(盐酸和硫酸的鉴别北京中考不要求,但是在分班考试中要求掌握)
常见碱的性质比较:
碱
俗名
色,态
溶解性
在空气中
腐蚀性
电离
氢氧
化钠
火碱,
烧碱,
苛性钠
白色
固体
极易溶于水并放热
吸水和CO2反应
很强
阴离子全部是OH-
氢气
化钙
熟石灰,消石灰
白色
粉末
微溶于水
吸CO2
有
常见的盐的性质比较:
学名
化学式
俗名
色,态
溶解性
特性
氯化钠
NaCl
食盐
白色晶体
易溶于水
如含氯化钙,氯化镁易潮解
碳酸钠
Na2CO3
纯碱
白色固体
易溶于水
溶液显
碱性
碳酸钙
CaCO3
石灰石的主要成分
白色固体
难溶于水
高温分解
例题:
例1.有下列几种物质:a.盐酸 b.硫酸 c.熟石灰 d.硫酸铜
e.纯碱 f.食盐 请选择合适的标号(a~f)填空(不得重复)
(1)用来清除铁锈的物质____
(2)常用降低土壤酸性的是____
(2)在日常生活中用做调味剂的是____
(4)少量存于胃液中帮助消化的是___
(5)农业上用于配制波尔多液的是____
(6)做馒头时用于除去面团发酵生成的酸的是____
答案为:(1)b (2)c (3)f (4)a (5)d (6)e
例2.下列物质置于空气中质量不会增加的是( )
A.纯碱 B.浓硫酸 C.石灰水 D.烧碱
答案为:A
例3.已知金属X能从CuSO4溶液中置换出铜,但不能从金属Y的硫酸盐溶液中置换出Y,则X、Cu、Y的金属活动性由强到弱的顺序为( )
A.X、Y、Cu B.Cu、X、Y C.Y、X、Cu D.Y、Cu、X
答案为:C
例4.区别熟石灰与烧碱的水溶液,可选择( )
A.CaCl2 B.Na2CO3溶液 C.CuSO4溶液 D.NaCl溶液
答案为:B
例5.CuCl2和MgCl2的混合溶液中,加入过量铁粉充分反应后,过滤,则滤纸上的物质是( )
A.Fe B.Cu C.Cu和Mg D.Fe和Cu
答案为:D
例6:在一定条件下,下列物质的转变不能一步完成的是
A. B.
C. D.
答案为:D
【解析】单质、氧化物、酸、碱、盐各类物质之间的相互转化是有条件的。只有掌握了物质的简单分类、金属活动顺序以及酸、碱、盐的溶解性等知识,同时又要熟练掌握各类物质的性质及反应发生的条件,才能灵活地应用。
为了找到解题的依据和判断方法,现将选项中能一步完成和不能一步完成的原因分析如下:
A组中由
这是由可溶性的碳酸盐Na2CO3转化成不溶性的碳酸盐CaCO3的过程。只要选择
可溶性的钙盐,或者可溶性的碱Ca(OH)2,利用盐和盐或盐和碱的复分解反应,
就可以一步实现这种转化:
如:
B组中
这是由金属氧化物转变成金属单质的过程。只要在一定条件下使用还原剂,就可
以将Fe2O3转变成Fe单质。常用的还原剂有H2、C、CO。
C组中
D组中
这两组均是由碱性氧化物向对应的碱转化的过程。这种转化,只限于可溶性的碱
如:
大多数的碱性氧化物如CuO、Fe2O3等都不能直接跟水化合生成对应的碱。所以
CuO向对应碱Cu(OH)2转变是不能一步完成的。如何由CuO制取难溶性的碱
Cu(OH)2呢?一般地说,可用下列方法:
例7.在AgNO3、Cu(NO3)2和Zn(NO3)2混合溶液中,加入一定量的铁粉,充分反应后过滤,在滤渣中加入稀盐酸,有气体产生。则下列结论正确的是( )
A.滤液中一定有Fe(NO3)3 B.滤渣只含Ag和Cu,一定无Zn
C.滤渣中一定有Ag、Cu和Fe,一定无ZnD.滤渣中一定有Ag、Cu、Fe和Zn
答案为:C
【解析】 解此题的关键是看哪种物质有剩余,与这种剩余物质反应的物质将均不能与此共存。铁粉与Zn(NO3)2溶液不反应,故滤渣中不会有金属单质锌,在滤渣中加入稀盐酸,有气体生成测滤渣中则一定含铁粉,因Fe+
Cu(NO3)2==Fe(NO3)2+Cu;Fe+2AgNO3==Fe(NO3)2+2Ag,则滤渣中除Fe外,还应有Cu和Ag。滤液中应含有Fe(NO3)2和Zn(NO3)2。
例8.使用同质量、同浓度的稀硫酸,分别与足量的下列物质反应,所得溶液溶质的质量分数最小的是( )
A.镁 B.氧化镁 C.氢氧化镁 D.碳酸镁
答案为:C
【解析】酸的量不足,四种情况中所以溶质的质量完全相等,现在只需要判断出哪一种情况中溶液的质量最大就是符合题意的答案。A中需要的单质镁的质量很少,并且还有氢气放出,不符合题意;B和D根据增量去看,情况是完全相同的,并且溶质质量分数也完全相同。只有C需要的氢氧化镁质量最多,且最终所有的质量都要转化到剩余溶液中,那么溶液质量最大,溶质质量分数最小。
例9.在天平两端分别放置盛有足量稀盐酸的烧杯,把天平调节平衡,向左盘烧杯中加入2.2克氧化钙,若使天平仍然保持平衡,右盘中需要加入金属镁的质量为( )
A.1.2克 B.2.2克 C.2.4克 D.4.4克
答案为:C
例10.酸、碱、盐是有广泛用途的重要化合物。某化学活动小组的同学围绕这几类化合物进行了一系列的探究活动。
(1) 同学们打开盛浓盐酸和浓硫酸试剂瓶的瓶盖,立即就能把它们区分开来,这是为什么?
(2)右图是某试剂瓶标签上的内容。要把10 g这种浓硫酸稀释为20%的硫酸,需要水的质量为 g。稀释浓硫酸时,不可将水倒进浓硫酸里,请解释其原因__________________________________________________________________________________________________________。
(3)为探究一瓶氢氧化钠固体的变质情况,同学们进行了如下实验。
①取少量该固体样品置于试管中,向其中加入一种无色溶液,发现有气泡产生,说明该样品中含有碳酸钠,由此可确定该固体已发生变质。则无色溶液可能是 。
②为探究该固体中是否还有未变质的氢氧化钠,同学们又进行了如下表所示的实验。已知碳酸钠的水溶液呈碱性,它的存在会对氢氧化钠的检验造成干扰。请根据右图部分物质的溶解性表(20℃)所提供的信息,将下表填写完整。
实验目的
实验操作
现象
结论或化学方程式
除去碳酸钠
取少量该固体样品溶于水配成溶液,滴加适量的 溶液.充分反应后过滤
有白色沉淀生成
有关反应的化学方程式为
检验是否含有氢氧化钠
在滤液中滴加酚酞溶液
该样品中含有氢氧化钠
(4)若73 g质量分数为20%的盐酸与127g氢氧化钠溶液恰好完全中和,试计算反应后所得溶液中溶质的质量分数。
【解析】
思路方法点拨:本题是一道围绕酸、碱、盐知识的综合应用题,试题的开放性很强,是对考生的科学探究能力、计算能力、分析问题的能力、过程与方法等的综合考查。
第(1)小题是对科学探究的过程与方法的考查,打开盛浓盐酸和浓硫酸试剂瓶的瓶盖,立即就能把它们区分开来,是由于探究过程中可以看到瓶口有的有白雾,有的没有,原因是浓盐酸具有挥发性,挥发出氯化氢气体在瓶口与空气中的水蒸气形成盐酸小液滴的缘故。
第(2)考查溶液稀释方法和有关计算,根据溶液稀释前后溶质质量不变,(试剂瓶标签上信息知浓硫酸的质量分数为98%)设需要加入水的质量为X:
10g×98%=(10g+X)×20% 解之,X=39g 。
稀释浓硫酸时,由于水的密度较小,浮在浓硫酸上面,而且浓硫酸溶解时放出的热会使水立刻沸腾,使硫酸液滴向四周飞溅,所以不可将水倒进浓硫酸里。
第(3)小题①考查碱的化学性质和分析推理能力,NaOH变质是NaOH和空气中的CO2作用,生成了Na2CO3和H2O,检验NaOH是否变质实际上是检验NaOH中是否含有Na2CO3,酸可以选用HCl,H2SO4(答案写一种酸就可以)等;
第(3)小题②要想探究该固体中是否还有未变质的氢氧化钠,根据下表实验步骤,必须先除去碳酸钠,再检验是否还有未变质的氢氧化钠。因此,题目综合分析难度稍高,隐藏了先除杂后检验信息。除去碳酸钠,即把碳酸根转化成气体或沉淀。根据本题情况,若加入酸,把碳酸根转化成气体,会影响下一步对氢氧化钠的检验,所以只能设法把碳酸根转化成沉淀。根据物质的溶解性表信息(北京考卷的溶解性表会在是卷卷头给出的)知,可以加入氢氧化钙或氯化钙或硝酸钙。但加入氢氧化钙,会产生碱性溶液造成干扰,影响下一步对氢氧化钠的检验,因此只可加入硝酸钙或氯化钙溶液。然后滴加酚酞试液,溶液变红既可证明有氢氧化钠。
第(4)小题
是对根据化学方程式进行计算和溶液的质量分数的综合能力的考查。(此种考法这几年盛行于北京之外的其他省市,但是北京市倾向于在实验探究题里面做一些定量的计算这种方式越来越明显了。大家要提前适应)
此小题比较简单,可以用化学方程式来做。这答案为11.7%
相关文档
- 高中化学必修二知识点归纳总结大全2021-05-09 03:06:5331页
- 河南专用2020版中考英语八下第14课2021-05-09 03:06:369页
- 河北省沧州市献县宏志中学2019-2022021-05-09 03:06:3518页
- 中考化学之实验专题2021-05-09 03:06:233页
- 陕西省中考数学试题2021-05-09 03:05:5312页
- 河南省南阳市第一中学2020届高三上2021-05-09 03:05:5226页
- 北京市昌平区新学道临川学校2019-22021-05-09 03:05:3723页
- 2014高考英语一轮复习完型填空常用2021-05-09 03:05:206页
- 中考数学试题分类大全31 解直角三2021-05-09 03:03:4455页
- 人教2016—2017 学年度七年级地理2021-05-09 03:03:354页