- 82.02 KB
- 2021-04-14 发布
- 1、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 2、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报QQ:3215808601
化学实验基本方法
蒸发
过滤
蒸馏
物质的分离和提纯
萃取(分液)
化学实验基本方法
常见离子的检验
一、分离和提纯的区别
分离
提纯
含义
把混合物的各成分分开
把混合物中的杂质除去
区别
分开后的物质要恢复原来的状态
杂质不必恢复原状态
二、混合物分离提纯的物理方法:
(1) 过滤
1、适用范围:分离 和
2、操作需要的仪器是:_____、_____、______、_____、_______。
(固体,液体的混合物,烧杯,漏斗,玻璃棒,滤纸,铁架台)
(2)蒸发
1、适用范围:将___________从_______中分离出来
2、操作需要的仪器是:_____________________________________
【注意】①停止加热的时间是:______________________________
②玻璃棒的作用是:________________________________
(固体溶质,溶剂,蒸发皿中出现较多量固体时停止加热,加快散热,防止里面的液体溅出来)
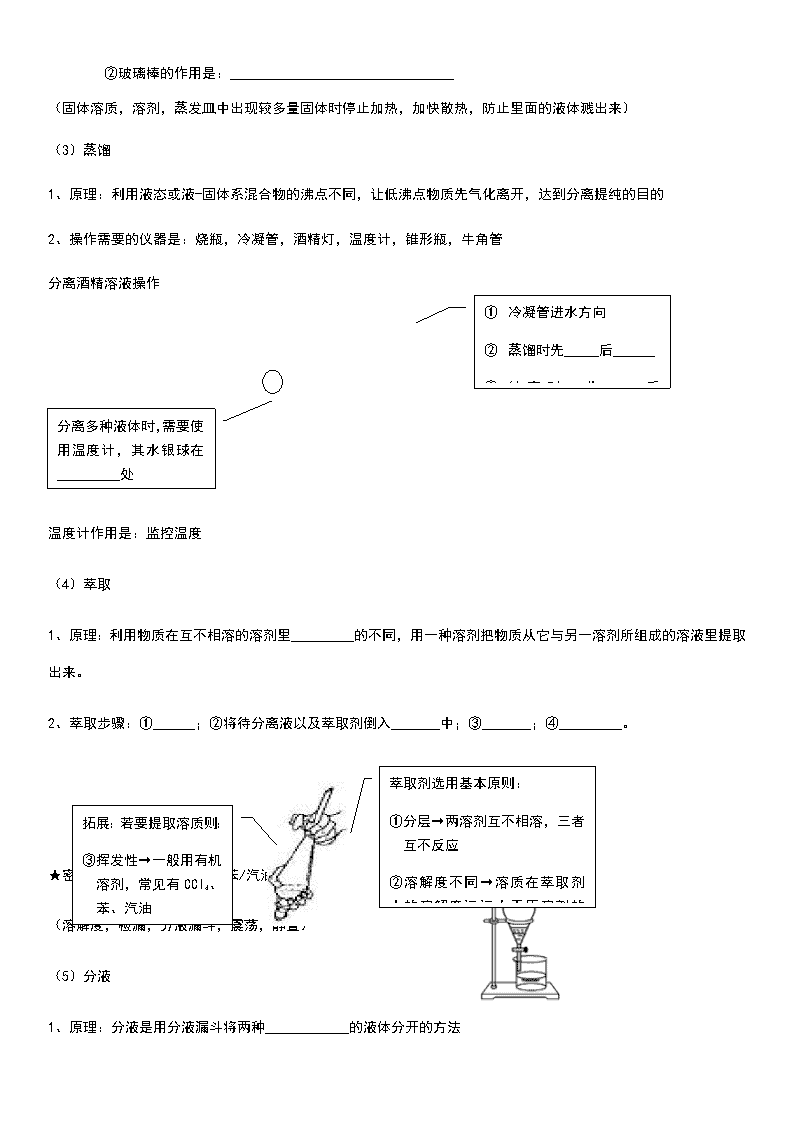
(3)蒸馏
1、原理:利用液态或液-固体系混合物的沸点不同,让低沸点物质先气化离开,达到分离提纯的目的
2、操作需要的仪器是:烧瓶,冷凝管,酒精灯,温度计,锥形瓶,牛角管
① 冷凝管进水方向
② 蒸馏时先_____后______
③ 结束时,先_____后______
分离酒精溶液操作
分离多种液体时,需要使用温度计,其水银球在_________处
温度计作用是:监控温度
(4)萃取
1、原理:利用物质在互不相溶的溶剂里_________的不同,用一种溶剂把物质从它与另一溶剂所组成的溶液里提取出来。
2、萃取步骤:①______;②将待分离液以及萃取剂倒入_______中;③_______;④_________。
萃取剂选用基本原则:
①分层→两溶剂互不相溶,三者互不反应
②溶解度不同→溶质在萃取剂中的溶解度远远大于原溶剂的溶解度
拓展:若要提取溶质则:
③挥发性→一般用有机溶剂,常见有CCl4、苯、汽油
★密度比较:CCl4 > 水 ; 苯/汽油 < 水
(溶解度,检漏,分液漏斗,震荡,静置)
(5)分液
1、原理:分液是用分液漏斗将两种____________的液体分开的方法
2、分液步骤:①打开___________ ②下层液体从______流出,上层液体从________倒出
(密度不同且互不相容,分液漏斗,下口,上口)
【1】工业上利用粗盐提纯得到较大量的精盐(NaCl),现已知粗盐的主要成分是NaCl,还有一些泥沙, Mg2+,Ca2+等杂质,还可能有SO42-,,请完成设计方案并回答问题。
依题意可得:
难溶性杂质: 泥沙 ;可溶性的杂质: 含有Mg2+,Ca2+和SO42-的盐
回答问题:
1、操作②中的玻璃仪器有:烧杯,玻璃棒,漏斗 等,其中玻璃棒的作用是 引流
2、洗涤的作用是: 将沉淀上的吸附的产品洗脱下来,减小产品的损失____
实验简要方案
【实验目的】
粗盐提纯得到较大量精盐NaCl
【实验步骤】
①将粗盐置于烧杯中,加入足量的水,搅拌溶解成悬浊液
② 过滤 (填操作名称)
③洗涤滤渣,将洗涤液流入滤液中
除难溶性杂质
1、除杂过程中加入过量试剂的原因是: 确保完全除去杂质
2、检验SO42-时,先加入盐酸的原
因是:排除碳酸根离子的影响
判断除尽SO42-的方法是: 取最后一次的沉淀洗涤液加入氯化钡溶液,无沉淀产生说明洗干净了
3、三种离子共存时,除杂(均过
量)原则是: Ca2+要在SO42-之后
①除Mg2+:往滤液中加入过量的
②检验SO42-:静置,取少量的上层清液于试管中, 加入盐酸酸化的硝酸钡溶液,有沉淀产生则有硫酸根
③除SO42-:往浊液中滴加过量的
④除Ca2+:往上述浊液中加入过量的
Na2CO3溶液
⑥除 OH-和CO32- (填离子符号):往上述滤液中滴加过量的 稀盐酸
1、操作①中的仪器有: 酒精灯,蒸发皿,玻璃棒等,其中玻璃棒的作用是 加快蒸发速率
① 蒸发 (填操作名称):将滤液倒入 蒸发皿 中,并不断用玻璃棒 搅拌,直到 出现大量固体时 停止加热,并用余热蒸干
提取固体NaCl
【2】已知某工业废水中含有大量CuSO4,少量的Ag+、Hg2+以及部分污泥,通过下述过程可从该废水中回收硫酸铜晶体及其它物质。
(1)步骤1的主要操作是 ,需用到的玻璃仪器除烧杯外有 。
(2)步骤2中需加入某种试剂后再将混合物分离,该试剂是(填化学式) ,
固体残渣的成分是(填化学式) 。
(3)步骤3中涉及的操作是:蒸发浓缩、 、过滤、烘干。
(4)步骤2应该在通风橱中进行,原因是
解析:
(1)难溶性固体与液体(悬浊液)分离方法,这里选用过滤。原理是利用滤纸上孔隙将固体留在滤纸上,从而达到实验目的。仪器:(从下往上记忆),铁架台(带铁圈)、烧杯、漏斗、滤纸、玻璃棒。
“洗涤”:为了降低损耗,过滤后,滤渣表面仍有溶液残留,因此利用洗涤操作。
(2)实验目的是回收硫酸铜晶体,因此一般分离提纯时,先利用物理方法,后用化学方法。这里利用置换反应的化学原理,同时避免引入其他杂质,因此试剂选用Cu;由于为了使全部Hg、Ag全部被除尽,加入过量的Cu。
(3)从溶液中提取出固体溶剂,选用固液分离的另一个操作结晶。由于五水合硫酸铜的溶解度受温度的影响较大,因此选用冷却结晶。为了提高产量,一般会蒸发浓缩,冷却结晶
(4)考察实验安全问题,因为汞是易挥发的液态金属并有毒性,所以需要在通风橱中进行。
【3】某化学课外小组用海带为原料制取了少量碘水。现用CCl4从碘水中萃取碘并用分液漏斗分离两种溶液。其实验操作可分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50mL碘水和15mLCCl4加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.将分液漏斗下面的活塞拧开,使下层液体慢慢沿烧杯壁流下,待下层液体流尽时及时关闭活塞
F.从分液漏斗上口倒出上层水溶液;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准漏斗口上的小孔;
H.静置,分层。
就此实验,完成下列填空:
(1)、______→______→______→A→______→G→E→F。
(2)、上述E步骤的操作中应注意____________________。上述G步骤操作的目的是_____________________。
(3)、能选用CCl4从碘水中萃取碘的原因是_____________________________________。
(4)、已知碘在酒精中的溶解度比在水中的大得多,能不能用酒精来萃取碘水中的碘,________(填“能”或“不能”),其理由是___________________________。
【答案】
(1)C B D H
(2)应使漏斗下端管口紧靠烧杯内壁,及时关闭活塞,不要让上层液体流出 使漏斗内外空气相通,以保证E操作时,漏斗里的液体能够流出
(3)CCl4与水不互溶,且碘在CCl4中溶解度比在水中大很多
(4)不能 酒精和水可以互溶
三、常见离子检验(排干扰,选试剂,标用量)
1.SO42-:取少量待测液于试管中,先滴加过量的稀盐酸后,后滴加1~2滴BaCl2溶液,若有白色混浊,则说明原溶液中有SO42-;反之,不存在
2.Cl- :取少量待测液于试管中,滴加适量的稀硝酸和1~2滴AgNO3溶液,若有白色混浊,则说明原溶液中有Cl-;反之,不存在(或用稀硝酸酸化的AgNO3溶液)
3.CO32-:取少量待测液与试管中,滴加少量的BaCl2溶液,出现白色混浊,再加入过量的稀盐酸,沉淀溶解,并生成的无味的气体,使澄清石灰水变浑浊。
4. H+ :①将试纸置于表面皿,用洁净玻璃棒蘸取待测液滴在pH试纸上,并与标准比色卡对比,则pH<7
②能使紫色石蕊试液变红
5.OH-:①能使紫色石蕊试液变蓝②能使无色酚酞变红
②将试纸置于表面皿,用洁净玻璃棒蘸取待测液滴在pH试纸上,并与标准比色卡对比,则pH>7
【1】下列离子检验的方法正确的是( )
A.某溶液+硝酸银溶液→产生白色沉淀,则原溶液中有Cl-
B.某溶液+氯化钡溶液→产生白色沉淀,则原溶液中有SO42-
C.某溶液+氢氧化钠溶液→产生蓝色沉淀,则原溶液有Cu2+
D.某溶液+稀硫酸→生成无色气体,则原溶液有CO32-
【答案】C
1.提纯含有少量BaCl2杂质的KCl溶液,可以使用的方法为( )
A.加入过量的Na2CO3溶液,过滤除去沉淀,所得溶液中补加适量盐酸
B.加入过量的K2SO4溶液,过滤除去沉淀,所得溶液中补加适量盐酸
C.加入过量的Na2SO4溶液,过滤除去沉淀,所得溶液中补加适量盐酸
D.加入过量的K2CO3溶液,过滤除去沉淀,所得溶液中补加适量盐酸
【答案】D
2.关于粗盐提纯的下列说法正确的是 ( )
A. 溶解粗盐时,应多加水尽量使溶液稀些,防止食盐溶解不完全。
B. 滤去不溶性杂质以后,将滤液移至坩埚内加热浓缩。
C. 当蒸发到蒸发皿中出现大量晶体时,停止加热,利用余热将液体蒸干。
D. 将制得的晶体转移到干净的过滤器中用大量水进行洗涤。
【答案】C
3.下列实验操作中正确的是( )
A. 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
B. 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C. 萃取操作时,选择的萃取剂的密度必须比水大
D. 蒸馏操作时,冷水从上口入,下口出
【答案】B
4.为了除去粗盐中Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作。其中正确的操作顺序是( )
①过滤②加过量的NaOH溶液③加适量盐酸④加过量Na2CO3溶液⑤加过量BaCl2溶液
A.①④②⑤③ B.④①②⑤③ C.②⑤④①③ D.⑤②④①③
【答案】D
5.除去NaCl中含有的Ca2+、Mg2+、SO42-、HCO3-等离子,通常采用以下四种试剂:①Na2CO3
②BaCl2 ③NaOH ④HCl。加入试剂合理的操作顺序是( )
A.①②③④ B.③①②④ C.④②①③ D.②①③④
【答案】D
6.提纯含有少量硝酸钡杂质的硝酸钾溶液,设计实验方案为
过量的X 过滤 除去沉淀 适量硝酸
溶液 硝酸钾溶液,则X试剂为( )
A.Na2CO3 B.K2CO3 C.Na2SO4 D.K2SO4
【答案】B
7.下列每组中的两对物质,都能用分液漏斗分离且油层由上口倒出的是( )
A.汽油和水、四氯化碳和水 B.苯和水、汽油和水
C.食用油和水、醋酸和水 D.葡萄糖和水,酒精和水
【答案】B
8.粗食盐常含有少量Ca2+、Mg2+、SO42-以及泥沙等杂质,实验室提纯NaCl的流程如下(加入的试剂稍过量)
(1)步骤③中加入的试剂A是 。
(2)若将步骤⑤与步骤⑥对调,先用盐酸调pH再过滤,将对实验结果产生的影响是 。
(3)在①、⑤、⑦三个步骤的操作中都要用到玻璃棒,分别说明它们使用玻璃棒的目的:
步骤①中: ;步骤⑤中: ;
步骤⑦中: 。
【答案】NaOH溶液。 沉淀溶解引入新杂质。 加速溶解。引流。加快蒸发
9、对下列实验过程评价正确的是( )
A.某固体中加入稀盐酸,产生了无色气体,证明该固体一定含有碳酸盐
B.某溶液中滴加BaCl2,生成不溶于稀HNO3的白色沉淀,该溶液中一定含SO42-
C.某无色溶液滴入酚酞试液显红色,该溶液不一定是碱溶液
D.验证烧碱溶液中是否含Cl-,先加稀盐酸除去OH-,再加AgNO3溶液,有白色沉淀出现,证明含Cl-
【答案】C
10.某溶液中含有较大量的Cl-、CO32-、OH-等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是()
①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液
A.①②④②③ B.④②①②③ C.①②③②④ D.④②③②①
【答案】B
11、现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂出去溶液中的NaCl和Na2SO4,从而得到纯净的NaNO3溶液。相应的实验过程可用下图表示:
请回答下列问题:
⑴写出实验流程中下列物质的化学式:试剂X_________,沉淀A________,沉淀B___________。
⑵上述实验流程中加入过量的Na2CO3的目的是____________________________
______________________________________________________。
⑶按此实验方案得到的溶液3中肯定含有_________(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的___________,之后若要获得固体NaNO3需进行的实验操作是___________(填操作名称)。
【答案】(1)BaCl2;BaSO4;AgCl(2)除去过量的BaCl2和AgNO3(3)Na2CO3;HCl;蒸发
相关文档
- 2020届高考化学一轮复习化学反应与2021-04-14 13:40:078页
- 2021届高考化学一轮复习化学平衡常2021-04-14 12:41:4816页
- 2020届高考化学一轮复习化学计量在2021-04-14 11:08:338页
- 2021届高考化学一轮复习化学平衡图2021-04-14 10:24:5312页
- 2021届高考化学一轮复习化学键作业2021-04-14 09:52:014页
- 2021版高考化学一轮复习化学反应速2021-04-14 03:29:5716页
- 2021版高考化学一轮复习化学平衡常2021-04-13 21:10:2815页
- 2020届高考化学一轮复习化学反应速2021-04-13 19:56:5412页
- 2019届高考化学一轮复习化学反应的2021-04-13 19:38:145页
- 高考化学一轮复习化学平衡常数与平2021-04-13 15:09:0916页