- 1.62 MB
- 2021-04-14 发布
- 1、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 2、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报QQ:3215808601
化学实验基础及综合应用
第十章
题型突破
10
化学实验仪器的组合应用
化学是以实验为基础的一门科学,化学知识的形成与考查多数都依托于化学实验,化学实验仪器又是进行化学实验的必备手段。有关化学实验仪器的组合创新应用是近几年来高考命题的重点和热点,在选择题和综合实验题中都经常出现,另外在工艺流程题中也时有出现;该题型通常考查化学实验仪器的识别、用途、使用以及组合创新的应用等,同时还能够很好地考查学生运用化学实验仪器完成实验的化学实验和探究能力,培养创新意识;其解题的关键是明确实验目的,理解实验原理,掌握实验仪器的常规用途,重点是学会化学实验仪器的迁移应用,该题型通常具有一定的难度,在复习备考中要引起足够的重视。
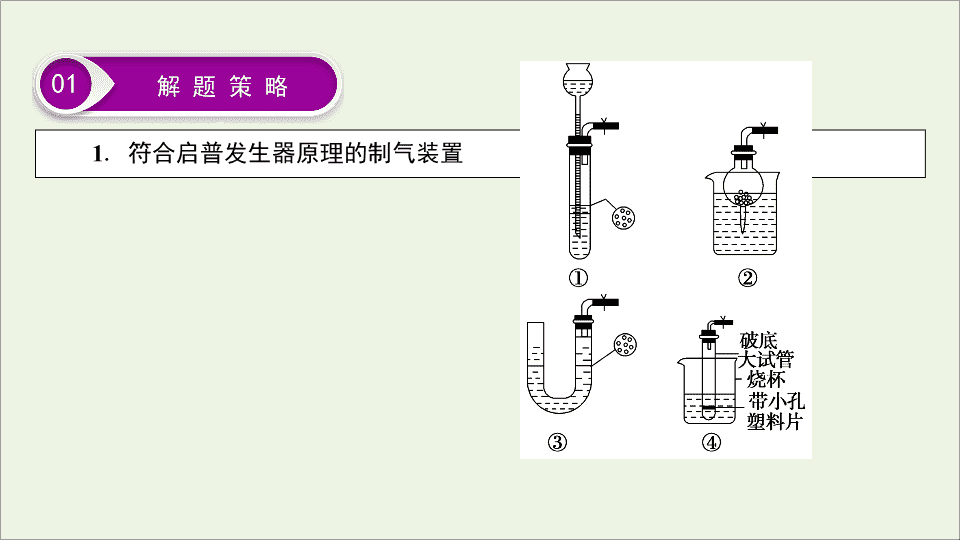
1
.
符合启普发生器原理的制气装置
01
解 题 策 略
2
.
可以测量气体体积的装置
3
.
可作为蒸馏及冷凝的装置
⑤
4
.
可作为气体干燥或除杂的装置
5
.
常见的实验安全装置
(1)
防倒吸装置
(2)
防堵塞装置
6
.
过滤装置的创新
——
抽滤
由于水流的作用,使图中装置
a
、
b
中气体的压强减小,故使过滤速率加快。
02
真 题 示 例
(2016
·
全国卷
Ⅰ
,
26)
氮的氧化物
(NO
x
)
是大气污染物之一,工业上在一定温度和催化剂条件下用
NH
3
将
NO
x
还原生成
N
2
。某同学在实验室中对
NH
3
与
NO
2
反应进行了探究。回答下列问题:
(1)
氨气的制备
①
氨气的发生装置可以选择上图中的
________
,反应的化学方程式为
___________________________________________________________________________________
。
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→
__________(
按气流方向,用小写字母表示
)
。
A
dcfei
(2)
氨气与二氧化氮的反应
将上述收集到的
NH
3
充入注射器
X
中,硬质玻璃管
Y
中加入少量催化剂,充入
NO
2
(
两端用夹子
K
1
、
K
2
夹好
)
。在一定温度下按图示装置进行实验。
红棕色气体慢慢变浅
Z
中
NaOH
溶液产生倒吸现象
反应后气体分子数减少,
Y
管中压强小于外压
03
即 时 训 练
1
.
(2019
·
山东菏泽模拟
)
实验室用下列装置制备无水
AlCl
3
(183℃
升华,遇潮湿空气即产生大量白雾
)
说法正确的是
(
)
A
A
.该实验过程中
e
瓶可能产生白雾
B
.
b
、
c
装置中分别盛装饱和
NaHCO
3
溶液和浓硫酸
C
.实验开始时应先点燃
d
处酒精灯,再点燃
a
处酒精灯
D
.实验后向烧瓶中加入足量硝酸银和稀硝酸,可确定生成的
MnCl
2
的质量
解析
由题意可知,
a
装置是制取
Cl
2
的发生装置,制得的氯气中含有
HCl
和水蒸气两种杂质,为了防止对
d
装置制备
AlCl
3
的干扰,则
b
装置中应盛装饱和食盐水除去
HCl
气体,然后在通过装有浓硫酸的
c
装置除去氯气中的水蒸气,盛有
NaOH
溶液的
f
装置是为了除去未反应的氯气以免污染空气。
f
装置中的水蒸气通过导管进入
e
装置使
AlCl
3
发生潮解产生白雾,
A
正确;由以上分析可知,
B
错误;实验开始时应先点燃
a
处的酒精灯,等把整套装置中的空气排出后再点燃
d
处的酒精灯制备
AlCl
3
,以免空气中的氧气和水蒸气干扰无水
AlCl
3
的制备,
C
错误;由于
MnO
2
只能与浓盐酸反应,所以等反应结束时烧瓶中还有稀盐酸剩余,故实验后向烧瓶中加入足量的硝酸银和稀硝酸不能确定生成的
MnCl
2
的质量,
D
错误。
2
.
(2018
·
安徽安庆二模
)
实验室测定已部分变质的过氧化钠样品纯度的装置如图所示
(Q
为弹性良好的气球不与药品反应,取定量的样品放入其中
)
。按图示安装好仪器,打开分液漏斗的活塞,将稀硫酸滴入气球中。下列说法中不正确的是
(
)
D
A
.稀硫酸滴入气球中,
Q
中能生成两种气体
B
.准确读取量筒
Ⅰ
读数后,先关闭
K
3
然后打开
K
2
,再缓缓打开
K
1
,准确读取量筒
Ⅱ
读数
C
.
Ⅰ
、
Ⅱ
中测量的气体体积的差值即为
CO
2
的体积
(
相同状况下
)
D
.
b
中的固体试剂可以是碱石灰,也可以是无水氯化钙。
解析
变质的过氧化钠中含有碳酸钠,加入稀硫酸后
Q
内发生反应:
2Na
2
O
2
+
2H
2
SO
4
===2Na
2
SO
4
+
2H
2
O
+
O
2
↑
;
Na
2
CO
3
+
H
2
SO
4
===Na
2
SO
4
+
H
2
O
+
CO
2
↑
,所以
Q
中能生成两种气体,
A
正确;反应生成的
CO
2
、
O
2
使气球变大,将大广口瓶中气体排出,水进入量筒
Ⅰ
中,所以量筒
Ⅰ
中水的体积即为生成的
CO
2
、
O
2
的体积;反应停止后,关闭
K
3
,打开
K
2
,再缓缓打开
K
1
,广口瓶内外相通,气球
Q
会慢慢缩小;混合气体通过碱石灰吸收
CO
2
后,最后量筒
Ⅱ
中收集的是
O
2
;准确读取量筒
Ⅱ
读数,
B
正确;由前面分析知,量筒
Ⅰ
测量的是
CO
2
、
O
2
的体积,量筒
Ⅱ
测量的是
O
2
的体积,所以
Ⅰ
、
Ⅱ
中测量的气体体积的差值即为
CO
2
的体积
(
相同状况下
)
,
C
正确;
b
中的固体试剂主要是用于吸收
CO
2
,而无水氯化钙不能吸收
CO
2
,所以
b
中的固体试剂不可以是无水氯化钙,
D
错误。
3
.某兴趣小组同学共同设计了如图所示的多功能实验装置。该装置既可用于制取气体,又可用于验证物质的性质。
(1)
现有以下药品:锌粒、铜片、浓
H
2
SO
4
、浓
HNO
3
、蒸馏水、
NaOH
溶液。打开
K
1
,关闭
K
2
,可制取
________
气体。
(2)
某同学用石灰石、醋酸、硅酸钠溶液等药品设计了另一实验。他的实验目的是
____________________________________
;
打开
K
2
,关闭
K
1
,将
A
中液体加入
B
中后,观察到的实验现象为
____________________________________________________
。
NO
2
比较碳酸、醋酸、硅酸的酸性强弱
B
中固体溶解,产生无色气体,
C
试管中产生白色沉淀
解析
(1)
打开
K
1
,关闭
K
2
,相当于用向上排空气法制取密度比空气大的气体,再根据所给试剂知只能制备
NO
2
。
(2)
比较
CH
3
COOH
、
H
2
CO
3
、
H
2
SiO
3
酸性强弱,可用石灰石和醋酸先制备
CO
2
,
CO
2
再与
Na
2
SiO
3
溶液反应生成
H
2
SiO
3
沉淀。
4
.亚硝酰氯
(ClNO)
是有机物合成中的重要试剂,红褐色液体或黄色气体,具有刺鼻恶臭味,遇水反应生成一种氢化物和两种氧化物。某学习小组在实验室用
Cl
2
和
NO
制备
ClNO
并测定其纯度,相关实验
(
夹持装置略去
)
如下。请回答:
(1)
制备
Cl
2
发生装置可以
________(
填大写字母
)
,反应的离子方程式为
______________________________________________________________________________________________________
。
(2)
欲收集一瓶干燥的氯气,选择装置,其连接顺序为:
a→_________________________(
按气流方向,用小写字母表示
)
,若用到
F
,其盛装药品为
_______________
。
A
f→g→c→b→d→e→j→h
饱和食盐水
(3)
实验室可用下图装置制备亚硝酰氯
(ClNO)
;
①实验室也可用
B
装置制备
NO
,
X
装置的优点为
___________________________________________________
。
排除装置内空气的干扰;可以随开随用,随关随停
②
检验装置气密性并装入药品,打开
K
2
,然后再打开
______(
填“
K
1
”
或“
K
3
”)
,通入一段时间气体,
(
其目的为
___________________________________________)
,然后进行其它操作,当
Z
有一定量液体生成时,停止实验。
③若无装置
Y
,则
Z
中
ClNO
可能发生反应的化学方程式为
_______________________________________
。
(4)
取
Z
中所得液体
m
g
溶于水,配制成
250 mL
溶液,取出
25.00 mL
,以
K
2
CrO
4
溶液为指示剂,用
c
mol
·
L
-
1
AgNO
3
标准溶液滴定至终点,消耗标准溶液的体积为
22.50 mL
。
(
已知:
Ag
2
CrO
4
为砖红色固体;
K
sp
(AgCl)
=
1.56×10
-
10
,
K
sp
(Ag
2
CrO
4
)
=
1×10
-
12
)
,则亚硝酰氯
(ClNO)
的质量分数为
________________________________________________________(
用代数式表示
)
。
K
3
排尽三颈烧瓶中的空气,防止
NO
和
ClNO
变质
2ClNO
+
H
2
O===2HCl
+
NO
↑
+
NO
2
↑
(3)
①
实验室用铜和稀硝酸反应制备
NO
,
NO
不溶于水,但是能够与氧气反应;选用
X
装置作为发生装置的优点为排除装置内空气的干扰;可以随开随用,随关随停。
②
检验装置气密性并装入药品,打开
K
2
,
K
3
,通入一段时间氯气,排尽三颈烧瓶中的空气,防止
NO
和
ClNO
变质;正确答案:
K
3
;排尽三颈烧瓶中的空气,防止
NO
和
ClNO
变质。
③
根据题意可知:亚硝酰氯
(ClNO)
遇水反应生成一种氢化物和两种氧化物,若无装置
Y
,就会有水蒸气进入发生装置,会造成
ClNO
与水反应,化学方程式为
2ClNO
+
H
2
O===2HCl
+
NO
↑
+
NO
2
↑
。