- 487.57 KB
- 2021-02-26 发布
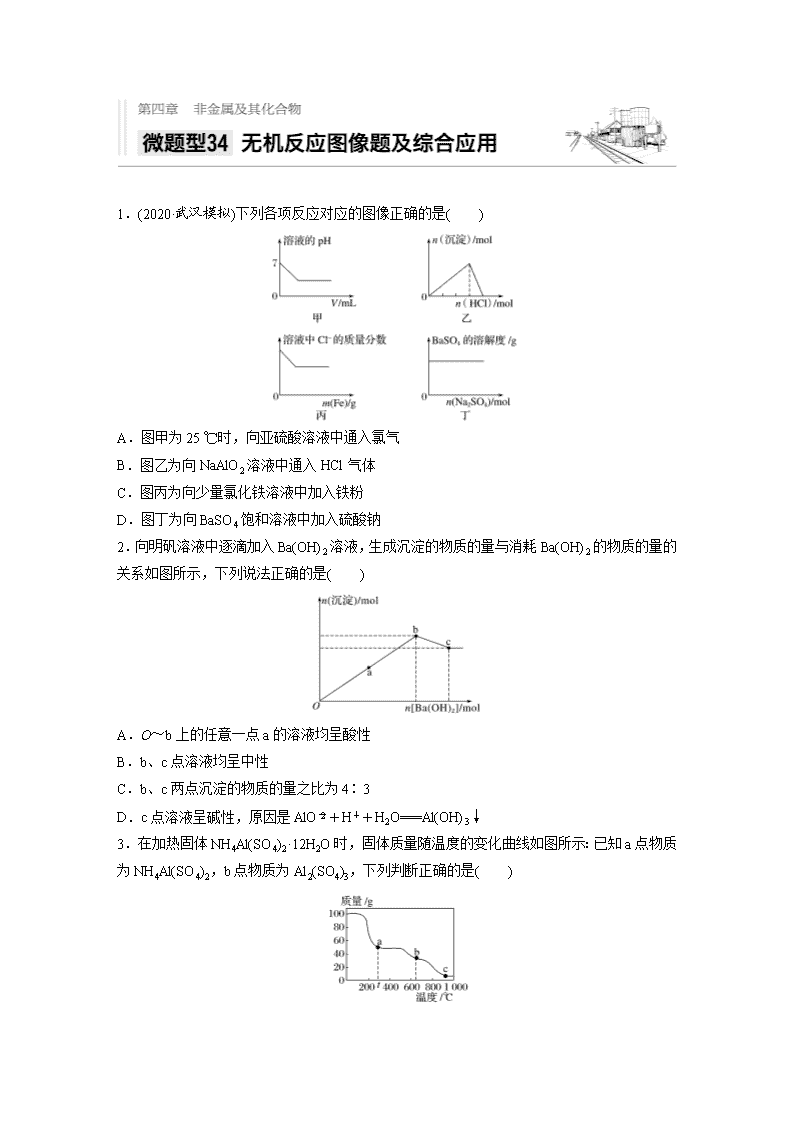
1.(2020·武汉模拟)下列各项反应对应的图像正确的是( )
A.图甲为25 ℃时,向亚硫酸溶液中通入氯气
B.图乙为向NaAlO2溶液中通入HCl气体
C.图丙为向少量氯化铁溶液中加入铁粉
D.图丁为向BaSO4饱和溶液中加入硫酸钠
2.向明矾溶液中逐滴加入Ba(OH)2溶液,生成沉淀的物质的量与消耗Ba(OH)2的物质的量的关系如图所示,下列说法正确的是( )
A.O~b上的任意一点a的溶液均呈酸性
B.b、c点溶液均呈中性
C.b、c两点沉淀的物质的量之比为4∶3
D.c点溶液呈碱性,原因是AlO+H++H2O===Al(OH)3↓
3.在加热固体NH4Al(SO4)2·12H2O时,固体质量随温度的变化曲线如图所示:已知a点物质为NH4Al(SO4)2,b点物质为Al2(SO4)3,下列判断正确的是( )
A.0~t ℃的过程变化是物理变化
B.c点物质是工业上冶炼铝的原料
C.a→b反应中生成物只有Al2(SO4)3和NH3两种
D.Al2(SO4)3能够净水,可用离子方程式表示为Al3++3OH-===Al(OH)3
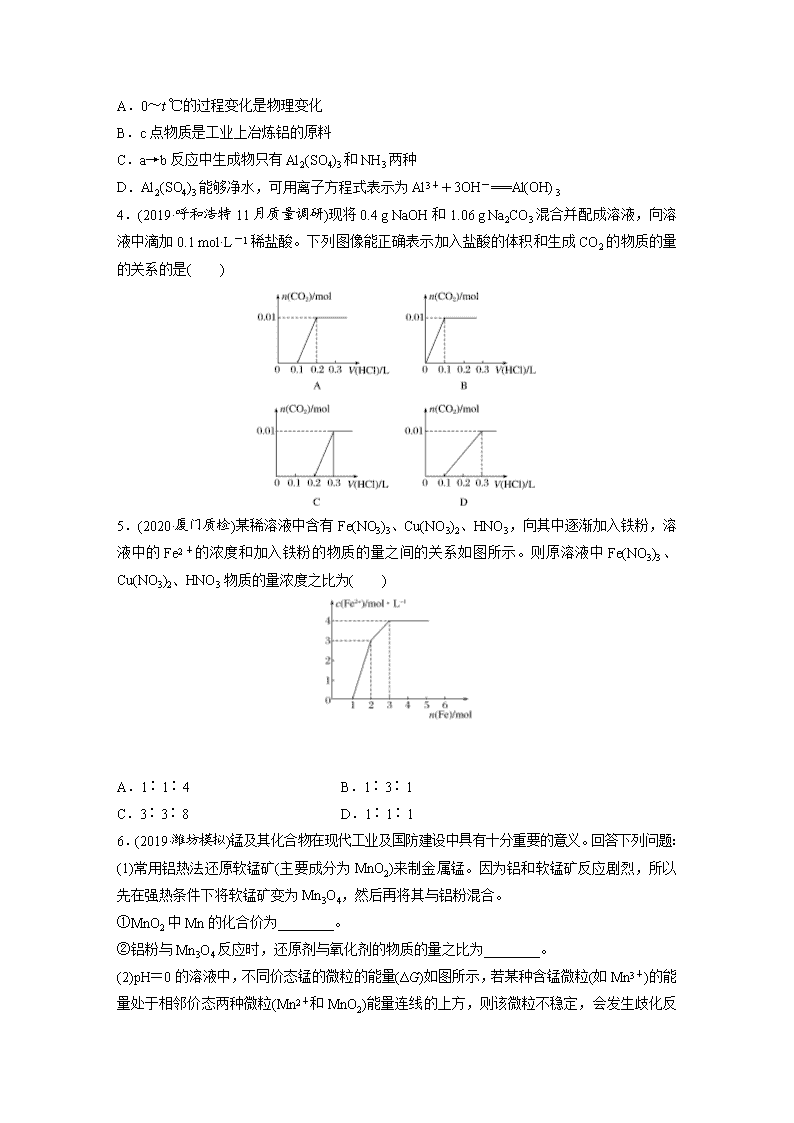
4.(2019·呼和浩特11月质量调研)现将0.4 g NaOH和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
5.(2020·厦门质检)某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中的Fe2+的浓度和加入铁粉的物质的量之间的关系如图所示。则原溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )
A.1∶1∶4 B.1∶3∶1
C.3∶3∶8 D.1∶1∶1
6.(2019·潍坊模拟)锰及其化合物在现代工业及国防建设中具有十分重要的意义。回答下列问题:
(1)常用铝热法还原软锰矿(主要成分为MnO2)来制金属锰。因为铝和软锰矿反应剧烈,所以先在强热条件下将软锰矿变为Mn3O4,然后再将其与铝粉混合。
①MnO2中Mn的化合价为________。
②铝粉与Mn3O4反应时,还原剂与氧化剂的物质的量之比为________。
(2)pH=0的溶液中,不同价态锰的微粒的能量(ΔG)如图所示,若某种含锰微粒(如Mn3+)的能量处于相邻价态两种微粒(Mn2+和MnO2)能量连线的上方,则该微粒不稳定,
会发生歧化反应,转化为相邻价态的微粒。
①MnO________(填“能”或“不能”)稳定存在于pH=0的溶液中。
②实验室可利用以下反应检验Mn2+的存在:2Mn2++5S2O+8H2O===16H++10SO+2MnO,确认Mn2+存在的现象是_____________________________________________
________________________________________________________________________;
检验时必须控制Mn2+的浓度和用量,否则实验失败。理由是_____________________
________________________________________________________________________。
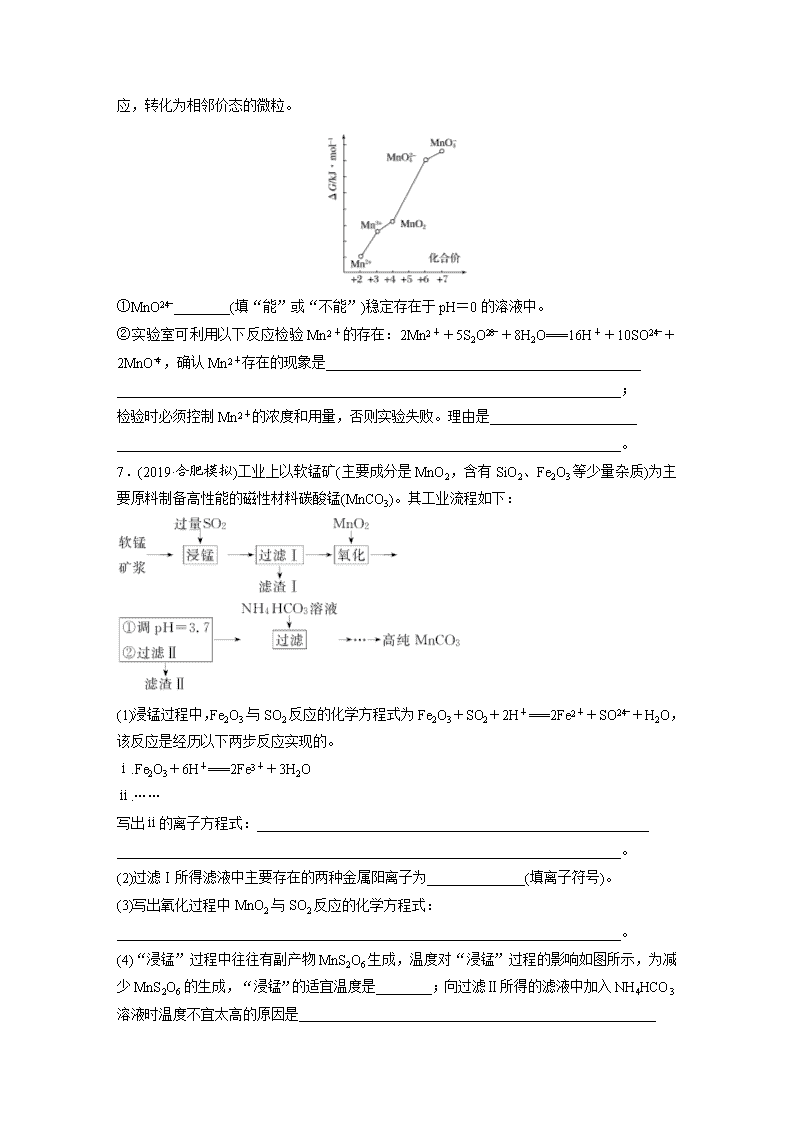
7.(2019·合肥模拟)工业上以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:
(1)浸锰过程中,Fe2O3与SO2反应的化学方程式为Fe2O3+SO2+2H+===2Fe2++SO+H2O,该反应是经历以下两步反应实现的。
ⅰ.Fe2O3+6H+===2Fe3++3H2O
ⅱ.……
写出ⅱ的离子方程式:________________________________________________________
________________________________________________________________________。
(2)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为______________(填离子符号)。
(3)写出氧化过程中MnO2与SO2反应的化学方程式:
________________________________________________________________________。
(4)“浸锰”过程中往往有副产物MnS2O6生成,温度对“浸锰”过程的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是________;向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度不宜太高的原因是___________________________________________________
________________________________________________________________________。
(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有气体生成,写出该反应的离子方程式:________________________________________________________________________
________________________________________________________________________。
(6)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是________________
__________________________________________________________________________
______________________________________________________。
答案精析
1.C
2.A [b点时反应的离子方程式为2Al3++6OH-+3Ba2++3SO===2Al(OH)3↓+3BaSO4↓,此时溶液的溶质是K2SO4,溶液呈中性,KAl(SO4)2溶液由于Al3+水解而显酸性,故O~b之间任意一点溶液都显酸性;b点之后,再加入Ba(OH)2,反应的离子方程式为2Al(OH)3+2OH-+Ba2++SO===2AlO+BaSO4↓+4H2O,c点溶液的溶质为KAlO2,溶液显碱性,故A正确、B错误;假设有1 mol KAl(SO4)2,b点沉淀的物质的量为2.5 mol,c点沉淀的物质的量则为2 mol,二者的比为5∶4,故C错误;c点溶液呈碱性的原因是AlO水解,故D错误。]
3.B
4.C [NaOH和Na2CO3均为0.01 mol,滴加0.1 mol·L-1盐酸,盐酸先中和NaOH,无气体产生,所需盐酸体积为0.1 L;盐酸再与Na2CO3反应生成NaHCO3,该过程无气体产生,消耗盐酸0.1 L,最后NaHCO3与盐酸反应生成CO2 0.01 mol,综上,C项正确。]
5.A [氧化性强弱顺序:HNO3>Fe3+>Cu2+,0~1时发生Fe+4HNO3===Fe(NO3)3+NO↑+2H2O,消耗1 mol Fe的同时消耗4 mol硝酸,生成1 mol Fe3+,1~2时发生Fe+2Fe3+===3Fe2+,消耗1 mol Fe的同时消耗2 mol Fe3+,因此原溶液中Fe3+的物质的量为1 mol,2~3时发生Fe+Cu2+===Fe2++Cu,消耗1 mol Fe的同时消耗1 mol Cu2+,则原溶液中有1 mol Cu2+,溶液的体积相同,浓度之比等于物质的量之比,则三者浓度之比为1∶1∶4。]
6.(1)①+4 ②8∶3
(2)①不能 ②溶液由无色变为紫红色 过量的Mn2+能与生成的MnO反应,从而影响实验现象的观察
7.(1)2Fe3++SO2+2H2O===2Fe2++SO+4H+
(2)Mn2+、Fe2+
(3)MnO2+SO2===MnSO4
(4)90 ℃ 防止NH4HCO3受热分解,提高原料利用率
(5)Mn2++2HCO===MnCO3↓+CO2↑+H2O
(6)取1~2 mL最后一次洗涤液于试管中,滴加盐酸酸化的BaCl2溶液,若无白色沉淀产生,则洗涤完全;反之,则未洗涤完全