- 412.00 KB
- 2024-03-25 发布
课后作业(十)
[基础巩固]
一、氯气的制备
1.下列离子方程式书写正确的是( )
A.氯气溶于水:Cl2+H2OH++Cl-+HClO
B.氯气和烧碱作用:Cl2+OH-===2Cl-+H2O
C.浓盐酸制取氯气:
MnO2+2H++2Cl-Cl2↑+Mn2++H2O
D.CO2通入澄清石灰水:
CO2+Ca2++OH-===CaCO3↓+H2O
[解析] B、C、D电荷不守恒,同时B、C、D不符合质量守恒定律。
[答案] A
2.在制氯气时有如下操作:操作顺序正确的是( )
①连接好装置,检查气密性 ②缓缓加热,加快反应,使气体均匀逸出 ③在圆底烧瓶中加入二氧化锰粉末 ④从盛有浓盐酸的分液漏斗中将浓盐酸缓缓滴入烧瓶中
⑤用向上排空气法收集氯气
A.①②③④⑤ B.③④②①⑤
C.①③④②⑤ D.①③②④⑤
[解析] 制取氯气的实验操作顺序为:连接装置,检查装置的气密性,防止装置连接处漏气,向圆底烧瓶中加入固体药品二氧化锰粉末,从分液漏斗中缓缓加入浓盐酸,加热,待气体均匀放出时收集气体,氯气有毒,最后连有尾气吸收装置吸收氯气,防止污染空气,所以正确操作顺序为①③④②⑤,故C正确。
[答案] C
3.实验室用浓盐酸与足量的二氧化锰反应产生少量的氯气。若反应过程中消耗了7.3 g HCl,理论上可收集到的氯气的质量( )
A.等于3.55 g B.小于3.55 g
C.大于3.55 g D.约等于7.1 g
[解析] 理论上可收集到的氯气的质量,可直接根据化学方程式计算,设收集到氯气的质量为x,则
4HCl(浓)+MnO2MnCl2+Cl2↑+2H2O
4×36.5 g 71 g
6
7.3 g x
x=3.55 g。
[答案] A
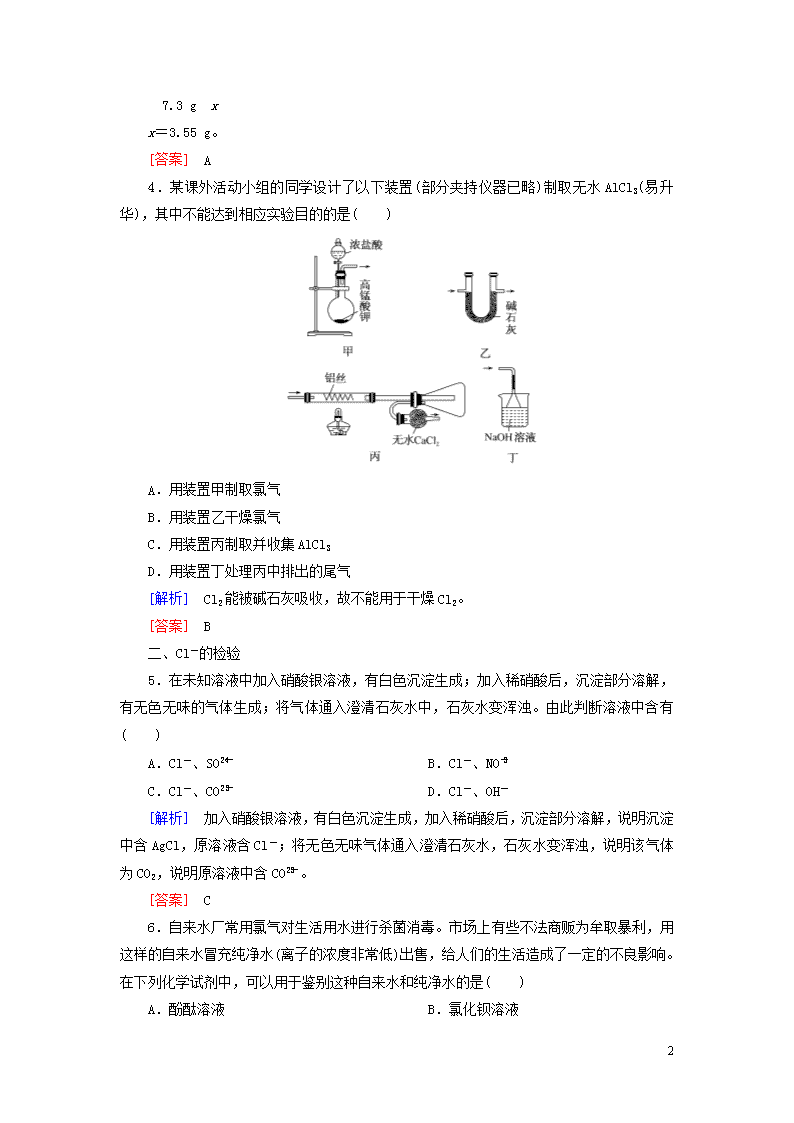
4.某课外活动小组的同学设计了以下装置(部分夹持仪器已略)制取无水AlCl3(易升华),其中不能达到相应实验目的的是( )
A.用装置甲制取氯气
B.用装置乙干燥氯气
C.用装置丙制取并收集AlCl3
D.用装置丁处理丙中排出的尾气
[解析] Cl2能被碱石灰吸收,故不能用于干燥Cl2。
[答案] B
二、Cl-的检验
5.在未知溶液中加入硝酸银溶液,有白色沉淀生成;加入稀硝酸后,沉淀部分溶解,有无色无味的气体生成;将气体通入澄清石灰水中,石灰水变浑浊。由此判断溶液中含有( )
A.Cl-、SO B.Cl-、NO
C.Cl-、CO D.Cl-、OH-
[解析] 加入硝酸银溶液,有白色沉淀生成,加入稀硝酸后,沉淀部分溶解,说明沉淀中含AgCl,原溶液含Cl-;将无色无味气体通入澄清石灰水,石灰水变浑浊,说明该气体为CO2,说明原溶液中含CO。
[答案] C
6.自来水厂常用氯气对生活用水进行杀菌消毒。市场上有些不法商贩为牟取暴利,用这样的自来水冒充纯净水(离子的浓度非常低)出售,给人们的生活造成了一定的不良影响。在下列化学试剂中,可以用于鉴别这种自来水和纯净水的是( )
A.酚酞溶液 B.氯化钡溶液
6
C.氢氧化钠溶液 D.硝酸银溶液
[解析] 用Cl2消毒后的自来水,由于发生反应:Cl2+H2OH++Cl-+HClO,所以用AgNO3检验生成的Cl-,若有白色沉淀生成,说明为自来水。
[答案] D
7.现有盐酸、NaCl溶液、NaOH溶液和新制氯水,可用来区别它们的一种试剂是( )
A.AgNO3溶液 B.酚酞溶液
C.紫色石蕊溶液 D.饱和食盐水
[解析] 盐酸遇紫色石蕊溶液变红,NaCl溶液遇紫色石蕊溶液无明显现象,NaOH溶液遇紫色石蕊溶液变蓝,新制氯水遇紫色石蕊溶液先变红后褪色。
[答案] C
8.氯仿(CHCl3)可用作麻醉剂,常因保存不慎而被空气氧化产生剧毒物质COCl2(光气)和氯化氢,为防止事故发生,使用前要检验氯仿是否变质,应选用的检验试剂是( )
A.水 B.AgNO3溶液
C.NaOH溶液 D.KI溶液
[解析] 氯仿氧化后生成COCl2(光气)和HCl,因此,用AgNO3溶液检验HCl中Cl-的存在即可判断氯仿是否变质。
[答案] B
[能力提升]
9.如图所示仪器可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是( )
A.a-b-c-d-e-f-g-h
B.a-e-d-c-b-h-i-g
C.a-d-e-c-b-h-i-g
D.a-c-b-d-e-h-i-f
[解析] 装置连接顺序:制氯气、除杂(HCl、水蒸气)、反应制备FeCl3、尾气处理、注意洗气瓶中导管应“长进短出”。
[答案] B
10.某同学用以下装置制备并检验Cl2的性质。下列说法正确的是( )
6
A.图Ⅰ:若MnO2过量,则浓盐酸可全部消耗完
B.图Ⅱ:仅证明新制氯水具有酸性
C.图Ⅲ:产生了棕黄色的雾
D.图Ⅳ:湿润的有色布条褪色
[解析] MnO2和浓盐酸在加热条件下反应,随着反应的进行,浓盐酸浓度变小,MnO2不与稀盐酸反应,即使MnO2过量,盐酸也不能全部消耗完,A项错误;图Ⅱ不仅能证明新制氯水具有酸性,还可以证明新制氯水具有漂白性,B项错误;铜丝在Cl2中燃烧,生成棕黄色的烟,C项错误。
[答案] D
11.下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的的是( )
A.用装置甲制取氯气
B.用装置乙除去氯气中混有的少量氯化氢
C.用装置丙分离二氧化锰和氯化锰溶液
D.用装置丁蒸干氯化锰溶液制MnCl2·4H2O
[解析] A项,二氧化锰和浓盐酸制备氯气需要加热,甲装置没有加热仪器,错误;B项,饱和碳酸氢钠溶液能吸收氯气,但NaHCO3和HCl反应能生成CO2,引入新的杂质气体,所以吸收试剂应该为饱和食盐水,并且洗气瓶气体流向为长导气管进短导气管出,错误;C项,二氧化锰不溶于水,氯化锰易溶于水,因此分离二氧化锰和氯化锰溶液需要过滤,正确;D项,若蒸干氯化锰溶液可能得不到MnCl2·4H2O,错误。
[答案] C
12.实验室里用如图所示仪器和药品来制取纯净的无水氯化铜(Cu+Cl2CuCl2
6
)。图中A、B、C、D、E、F表示玻璃管接口,接口的弯曲和伸长等部分未画出。根据要求填写下列各小题空白。
(1)如果所制气体从左向右流向时,上述各仪器装置的正确连接顺序是(填各装置的序号)( )接( )接( )接( )接( )接( ),其中②与④装置相连时,玻璃管接口(用装置中字母表示)应是________接________。
(2)装置②的作用是__________________________;
装置④的作用是__________________________。
(3)实验开始时,应首先检验装置的________,实验结束时,应先熄灭________处的酒精灯。
(4)在装置⑤的烧瓶中,发生反应的化学方程式为__________________________
__________________________。
[解析] 制取纯净的无水CuCl2,应由Cu和纯净的Cl2加热制得,欲制得纯净的氯气需③和⑤组合制得Cl2,再经④洗去Cl2中的氯化氢,经过②除去水蒸气,最后排出的尾气用碱液吸收以防止多余的Cl2污染环境。
[答案] (1)③ ⑤ ④ ② ① ⑥ C B
(2)除去Cl2中的水蒸气 除去Cl2中的HCl气体
(3)气密性 ①
(4)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
13.图中为实验室制取氯气及性质验证的装置图:
参考装置图回答下列问题:
(1)请指出仪器a的名称________,仪器b的名称________,写出装置A中反应的化学方程式__________________________
__________________________。
6
(2)在装置D中可观察到的现象是__________________,装置E中可观察到的现象是__________________,装置F中可观察到的现象是__________________________。
(3)装置B的作用为________,装置C的作用为________,装置H的作用为________,写出装置H的化学方程式__________________________。
[解析] (1)由装置图可知,仪器a的名称是分液漏斗,仪器b的名称是圆底烧瓶,装置A中的化学反应方程式为MnO2+4HCl(浓)Cl2↑+MnCl2+2H2O。(2)Cl2本身没有漂白作用,它与水反应生成的HClO有漂白作用,因此干燥的有色布条不会褪色,湿润的有色布条会褪色,湿润的淀粉-KI试纸变蓝色。(3)装置B中盛放的是饱和食盐水,它的作用是除去Cl2中的HCl,装置C中盛放的是浓硫酸,它的作用是除去H2O,装置H中盛放的是NaOH溶液,它的作用是吸收Cl2,防止污染环境,发生反应的化学方程式为Cl2+2NaOH===NaCl+
NaClO+H2O。
[答案] (1)分液漏斗 圆底烧瓶 MnO2+4HCl(浓)Cl2↑+MnCl2+2H2O
(2)干燥的有色布条无变化 湿润的有色布条褪色 湿润的淀粉-KI试纸变蓝
(3)除去Cl2中的HCl 除去Cl2中的H2O 吸收多余Cl2 Cl2+2NaOH===NaCl+NaClO+H2O
14.有一包白色固体,它可能含有KCl、K2CO3、KNO3中的一种或几种,现进行如下实验:
①溶于水,得无色溶液;
②向溶液中滴加AgNO3溶液,生成白色沉淀;
③再滴加稀硝酸,沉淀减少但不完全消失,同时有气泡生成。
根据上述现象判断:
(1)白色固体一定含有的成分是________,可能含有的成分是________。
(2)写出上述实验中有关反应的离子方程式:
__________________________。
[解析] 由②产生白色沉淀知,可能含有K2CO3和KCl中的一种或两种。由③沉淀减少且有气泡生成知,一定含有K2CO3;由沉淀不完全消失可知,一定含有KCl。
[答案] (1)KCl和K2CO3 KNO3
(2)Ag++Cl-===AgCl↓,2Ag++CO===Ag2CO3↓,Ag2CO3+2H+===2Ag++H2O+CO2↑
6