- 562.00 KB
- 2024-03-09 发布
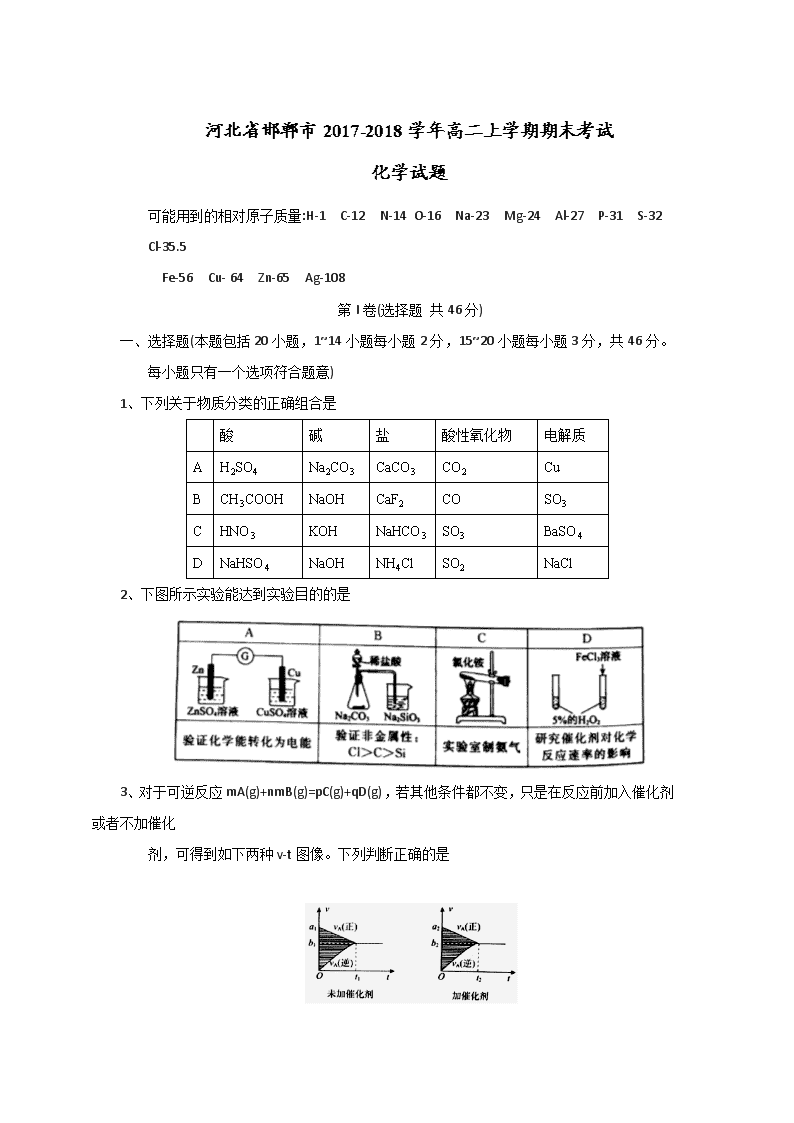
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27 P-31 S-32 Cl-35.5
Fe-56 Cu- 64 Zn-65 Ag-108
第I卷(选择题 共46分)
一、 选择题(本题包括20小题,1~14 小题每小题2分,15~20小题每小题3分,共46分。每小题只有一个选项符合题意)
1、 下列关于物质分类的正确组合是
酸
碱
盐
酸性氧化物
电解质
A
H2SO4
Na2CO3
CaCO3
CO2
Cu
B
CH3COOH
NaOH
CaF2
CO
SO3
C
HNO3
KOH
NaHCO3
SO3
BaSO4
D
NaHSO4
NaOH
NH4Cl
SO2
NaCl
2、 下图所示实验能达到实验目的的是
3、 对于可逆反应mA(g)+nmB(g)=pC(g)+qD(g),若其他条件都不变,只是在反应前加入催化剂或者不加催化
剂,可得到如下两种v-t图像。下列判断正确的是
A.b1>b2,t1>t2 B.b1c(NH4+)>c(OH-)>c(H+)
D.c(NH4+)>c(C1-)>c(OH-)>c(H+)
9、 可逆反应C(s)+ CO2(g)2CO(g)在体积固定的密闭容器中进行,达到平衡状态的标志是
①单位时间内生成n mol CO2的同时生成2n mol CO
②单位时间内生成n mol CO2的同时消耗2n mol CO
③用CO2、CO 表示的反应速率之比为1: 2的状态
④混合气体的密度不再改变的状态
⑤体系内压强不再改变的状态
⑥ 混合气体的平均相对分子质量不再改变的状态
A. ①④⑤⑥ B.②④⑤⑥ C.①③④⑤ D.全部
10、 下列事实能说明HClO为弱电解质的是
①常温下0.1mol/L HClO溶液的pH>1
②常温下NaClO溶液的pH>7
③用HClO溶液做导电实验时,灯泡很暗
④HClO不稳定,易分解
A.①③ B.②③ C.③④ D.①②
11、 已知:1mol S(s)转化为气态硫原子吸收能量280 kJ,SF4分子中只存在S-F键。断裂1mol F-F,S-F键需吸收的能量分别为160kJ,330 kJ。则S(s)+3F2(g)==SF4(g)的反应热ΔH 为
A.-1780kJ/mol B.-1220kJ/mol C.-450kJ/mol D.+430kJ/mol
12、 下列图像分别表示有关反应的反应过程与能量变化的关系。据此判断下列说法中正确的是
A. 由图甲可知金刚石比石墨稳定
B.由图乙可知红磷(P)转化为白磷(P4)为吸热反应
C.由图丙可知S(s)+O2(g)==SO2(g) ΔH1,S(g)+O2(g)==SO2(g) ΔH2,则ΔH 2> ΔH1
D.由图丁可知CO(g)+H2O(g)==CO2(g)+H2(g) ΔH>0
8、 下图为某化学小组设计的一个用于探究电解原理的实验装置,其中X 为阳离子交换膜。下列有关说法正确的是
A.通入甲醚的电极上发生的电极反应式为CH3OCH3+3H2O-12e-=2CO2 ↑+12H+
B.乙装置中C电极上生成氢气
C.反应一段时间后,向乙中加入几滴酚酞试液,铁电极附近溶液变红色
D.反应一段时间后,丙装置中两个电极上的质量变化量相等
9、 利用下图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产。下列说法一定正确的是
A.电解饱和氯化钠溶液一段时间后,加入盐酸可使电解后溶液恢复到原来的浓度
B.电镀工业中,X是待镀件,Y是镀层金属
C.外加电流的阴极保护法中,Y是待保护金属
D.若X、Y均为情性电极,电解CuSO4溶液,电解一段时间。溶液的pH变大
10、 现有常温下的四份溶液:①0.001mol/LCH3COOH溶液;②0.001mol/LHCl溶液;③pH=11的氨水;④pH=11的NaOH溶液。下列说法正确的是
A.水的电离程度由大到小排序:②=④>③>①
B.将②③混合,若c(NH4+)>c(OH-
),则混合液一定呈酸性
C.将四份溶液分别稀释到原体积相同倍数后,所得溶液的pH;③>④,②>①
D.将①④混合,若pH=7,则消耗溶液的体积:①>④
16、在恒容密闭容器中进行反应:2NO2(g)+O3(g)N2O5(g)+O2(g) 该反应相关图像如下所示,其中对应的分析或结论正确的是
17、下列有关说法正确的是
A.反应SiO2(s)+3C(s)=SiC(s)+2CO(g)室温下不能自发进行,则该反应的ΔH<0
B.可以用Na2S溶液与AlCl3溶液反应制取Al2S3
C.铅蓄电池放电过程中,正极质量增加,负极质量减小
D.在NaHS溶液中,滴入少量CuCl2溶液产生黑色沉淀,pH减小
18、常温下,浓度为0.1mol/L的下列六种溶液:①NaHSO4溶液 ②盐酸 ③NH4Cl溶液 ④CH3COONa溶液⑤NaCl溶液 ⑥醋酸溶液 下列有关判断正确的是
A.c(Na+):①>⑤>④
B.c(H+):①=②>③>⑥>④
C.④和⑥同等体积混合:c(CH3COO-)>c(Na+ )>c(CH3COOH)
D.①和④两种溶液混合,使溶液pH=7,则c(Na+)=c(CH3COO-)+c(SO42-)
19、下列说法符合事实的是
A.强酸与强碱中和滴定时可以选用甲基橙或酚酞作指示剂;强碱与弱酸中和滴定时应该选用酚酞作指示剂
B.在5 mL.0.1mol/L 的AgNO3溶液中加入3ml等浓度的NaCl溶液,有白色沉淀产生,再加入3 ml 等浓度的Na2S溶液,溶液中又有黑色沉淀生成,说明Ksp(Ag2S)>Ksp(AgCl)
C.物质的量浓度均为0.01mol/L的弱酸HX及其盐NaX溶液等体积混合后:c(X-
)+c(HX)=0.005 mol/L
D.已知Ksp(AgCl)= 1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12。 在含Cl-、CrO42-浓度相同的溶液中滴加AgNO3溶液时,首先生成Ag2CrO4沉淀
20、在一定体积pH=12的Ba(OH)2 溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液的pH=11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则溶液NaHSO4与Ba(OH)2 溶液的体积比是
A.1:2 B.2:1 C.1:4 D.4:1
第II 卷(非选择题 共54分)
二、填空题(本题包括4小题,共54 分)
21、(共12分)按要求填空。
I.常温下,两种溶液①0.01mol/L CH3COOH ②0.01mol/LCH3COONa中:
(1)溶液①的pH_________(填“ >” “< ”或“ =” )7, 其原 因 是__________________(用电离方程式表示)。
(2)溶液②呈_____________(填“酸”“碱”或“ 中 ”) 性, 升 高 温 度 可 以_________(填“ 促进”或“ 抑制”)
CH3COONa的水解。
II.(1)下列关于浓度均为0.1mol/L的NH3·H2O和NH4Cl溶液中c(NH4+ )的叙述正确的是___(填字母)。
a.两种溶液中c(NH4+ )都等于0.1mol/L
b.两种溶液中c(NH4+ ) 都小于0.1mol/L
c.NH4Cl溶液中c(NH4+ )小于NH3·H2O溶液中c(NH4+ )
(2)泡沫灭火器中药品的主要成分是硫酸铝和碳酸氢钠,内筒为塑料筒,内盛______(填写化学式)溶液,
筒和内筒之间装有________(填写化学式)溶液。使用灭火器时,倒置,将两种溶液混合,发生剧烈的反
其反应的离子方程式为____________________________________________。
(3)已知下列物质在20 ℃下的Ksp如下:
化学式
①AgCl
②AgBr
③Agl
颜色
白色
黄色
黄色
Ksp
2.0×10-10
5.4×10-13
8.3×10-17
20℃时,上述三种银盐的饱和溶液中,Ag+的物质的量浓度由大到小的顺序为_________(填序号)。
22、 (共16分) I.某学生用0.1000mo l/L的NaOH标准溶液滴定未知浓度的盐酸,其操作可分为如下几步:
A.取标准NaOH容液注入碱式滴定管至刻度线0 以上2 cm~3 cm;
B.量取25.00mL.待制盐酸溶液注入洁净的锥形瓶,并加儒2~3滴酚酞;
C.用标准溶液润洗滴定管2~3 次;
D.调节液面至“0”或“0”以下刻度并记下读数;
E.把盛有标准溶液的碱式滴定管周定好,调节滴定管尖嘴使之充满溶液;
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记滴定管液面的刻度。
据此实验光成填空:
(1)正确操作步骤的顺序是______、______、______、______、B、______。(用序号字母填写)
(2)滴定管洗涤之前必须_______________________。
(3) 上述B 步骤操作之前,先用待测溶液润洗锥形瓶,则对滴定结果的影响是________(填“ 偏大” “偏小” 或“不变” )。
滴定次数
盐酸(mL)
0.1000mol/LNaOH的体积(mL)
滴定前
滴定后
溶液体积
第一次
25.00
0.00
26.11
26.11
第二次
25.00
1.56
30.30
28.74
第三次
25.00
0.22
26.31
26.09
(4)若第四次滴定开始和结束时,滴定管中的液面如图所示;则所滴NaOH溶液的体积为_____mL。
(5)某学生根据四次实验记录数据计算该盐酸溶液的物质的量浓度:c(HC)=________。
II.氧化还原滴定实验与中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)现用0.001mol/LKMnO4。酸性溶液滴定未知浓度的无色NsHSO3
溶液,反应的离子方程式为2MnO4-+5HSO3-+H+=2Mn2++5SO42-+3H2O。完成下列问题:
(1)下列仪器中,与该滴定实验无关的为__________。
A. 胶头滴管 B.锥形瓶 C.量筒(10 mL) D.滴定管夹
(2)高锰酸钾溶液盛放在_____( 填“酸“或“碱”)式滴定管。
(3)判断到达滴定终点的实验现象是___________________________。
22、 (共14 分)在一定温度下,向一个体积为1L的容器中,通入2mol A2 租8molB2 及固体催化剂,使之反应。已知: A2(g)+ 3B2(g) 2AB3(g),△H=-Q kJ/mol。平衡时容积内气体压强为起始时的80%。
(1)平衡时容器内AB3的体积分数为____________,A2 的转化率_________,该反应的平衡常数的表达式K=_____________。
(2)达平衡时,放出热量为__________(填序号)。
A.等于Q kJ B.大于Q kJ
C.小于Q kJ D.可能大于、小于或等于Q kJ
(3)t2时刻速率变化如下图所示,外界条件的变化可能是_______________________。
(4)该温度下测得某一时刻时各物质的浓度均为0.5mol/L,则此v(正)____(填“>”“<“或“=”)v(逆)。
(5)保持同一温度。在相同容器中,起始通入一定物质的量的A2、B2、AB3,欲使平衡时AB3 的体积分数为1/4,且起始时反应表现为向正反应方向进行,则充入A2的物质的量a mol的取值范围为_______
23、 (共12 分》铝空气电池具有高效、廉价、续航能力强等特点,其原理如图所示。
(1)电池正极的电极反应式为_______________________________。
(2)若电池工作过程中转移了2.5mol电子,则理论上消耗的氧气的质量为___________g。
(3)以铝空气电池为电源电解KOH和KI的混合溶液制取KIO3(石墨为电极材料)时,电解过程中阳极的电极反应式为________________________________。
(4)25℃时,用铝空气电池作电源,采用惰性电极电解500 mLAgNO3溶液,电解的总反应化学方程式为______________,所得溶液(假设溶液电解前后体积不变)的pH=1,则此时硝酸的浓度为_____,则该过程中消耗铝的质量为_______g。
第I卷(选择题 共46分)
一、选择题(本题包括20小题,1~14 小题每小题2分,15~20小题每小题3分,共46分。)
1-5:CDCAA 6-10:BCDAD 11-15:BBCCD 16-20:CDCAD
第II卷(非选择题 共54 分)
一、 填空题(本题包括4小题,共54 分)
21、(共12 分)
I.(1)<(1分) CH3COOHCH3COO-+H+(1分)
(2)碱(1分)促进(1分)
II.(1)b(2分)
(2)Al2(SO4)3(1分) NaHCO3(1分) A13++3HCO3-=A1(OH)3↓+3CO2↑(2 分)
(3)①>②>③ (2 分)
22、(每空2分,共16分)
I.(1)C、A、E、D、B、F(共2 分,只要有一个错不得分)
(2)检查是否漏液(2 分) (3)偏大(2 分) (4)26.10 (2 分) (5)0.1044 mol/L(2 分)
II.(1)AC(2分,只选1个且正确得1分,答错1个得0分)
(2)酸(2 分)
(3)最后一滴KMnO4滴下时,溶液由无色变为紫红色,且半分钟内不褪色(2 分)
23、(每空2分,共14 分)
(1)25% 50% c2(AB3)/c(A2)c3(B2) (2)A
(3)升高温度;(4)<;(5)1
您可能关注的文档
- 2017-2018学年河北省邯郸市高二上学期期末考试化学试题 Word版
- 英语卷·2018届安徽省亳州市蒙城县第一中学高三上学期第五次月考(2018-01)
- 2018-2019学年浙江省余姚中学高二下学期3月质量测试地理试题 (Word版)
- 难忘的秋天500字小学记叙文
- 关于“好书伴我行,共筑中国梦”征文最新范文5篇
- 内分泌学练习试卷30
- 北京市东城区2019届高三上学期期末教学统一检查 生物试题(扫描版含答案)
- 精选幼师教育培训心得总结精选范文5篇最新
- 江西专版2020中考英语复习方案速测16完形填空A+B+阅读理解D+还原短文试题
- 数学文卷·2018届湖南省永州市祁阳县高三上学期第二次模拟考试(2017