- 237.00 KB
- 2024-02-27 发布
牡一中2017级高二学年假期检测
化 学 试 题
相对原子质量:H1 C12 N14 O 16 Cl 35.5 Na23 Al 27 Fe56 Cu64 Ag108
第I卷(选择题,共60分)
一、(每小题只有一个选项符合题意,每题4分,共15小题,计60分)
1、在一定条件下的溶液中,反应FeCl3+3KSCN Fe(SCN)3+3KCl达到平衡后,在其他条件不变的情况下,改变下列条件,能使平衡逆向移动的是( )
A. 加水稀释 B. 加入少量FeCl3固体 C. 加入少量KCl固体 D. 加入少量KSCN固体
2、用已知浓度的盐酸滴定未知浓度的NaOH溶液,使测得的NaOH溶液浓度偏高的是( )
A.滴定前滴定管中有气泡,滴定后消失
B.碱式滴定管量取NaOH溶液时,未进行润洗操作
C.滴定时达到滴定终点时俯视读数
D.锥形瓶取用NaOH待测液前加少量蒸馏水洗涤
3、下列解释事实的方程式不正确的是( )
A. 电化学镀银的阳极反应式: Ag+ + e-= Ag
B. 测0.1 mol/L氨水的pH为11:NH3·H2ONH4++OH−
C. pH=5的硫酸稀释1000倍,pH约等于7:H2OH++OH−
D. 泡沫灭火器的反应原理:Al3++3HCO3- = Al(OH)3↓+3CO2↑
4、同体积的1mol/L的HCl、H2SO4、CH3COOH、HNO3分别加入过量的Mg。下列叙述正确的是( )A. HNO3、HCl、H2SO4中放出H2的速率相同
B. HCl、HNO3中放出H2的量相等
C. HCl、CH3COOH中放出H2的量相等
D. H2SO4中放出H2的量最多,其余的相等
5、电化学气敏传感器可用于监测环境中的含量,其工作原理如图所示,被氧气氧化为,下列说法错误的是( )
A. 溶液中向电极b移动
B. 氨气在电极a上发生氧化反应
C. 反应消耗的与的物质的量之比为4:5
D. 正极的电极反应式为:
6、关于化学反应进行的方向叙述不正确的是( )
A. △H<0,△S>0时,反应自发进行,如金属钠和水的反应
B. 过程的自发性能判断过程的方向,还能确定过程是否一定会发生
C. △H>0,△S<0时,反应不自发进行,如2CO(g)=2C(s)+O2(g)
D. 等量的同一种物质,气态时的熵值最大、液态时次之、固态时最小
7、对达到化学平衡的反应:,增大压强,下列叙述中正确的是( )A. 增大压强,活化分子的百分数增大,反应速率增大
B. 增大压强,单位体积内活化分子数增多,反应速率增大
C. 增大压强,正反应速率增大逆反应速率减小,平衡正向移动
D. 增大压强,逆反应速率增大正反应速率减小,平衡逆向移动
8、25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A. 水电离的c(H+)=10-13 mol/L 的溶液中:Na+、NH4+、CH3COO-、HCO3-
B. c(H+)=10-12 mol/L的溶液中:K+、AlO2-、NO3-、SO42-
C.能使甲基橙变红色的溶液中:Na+、NO3-、Cl-、Fe2+
D. 含有溶质为NaHCO3的溶液: Cl-、Al3+、Na+、AlO2-
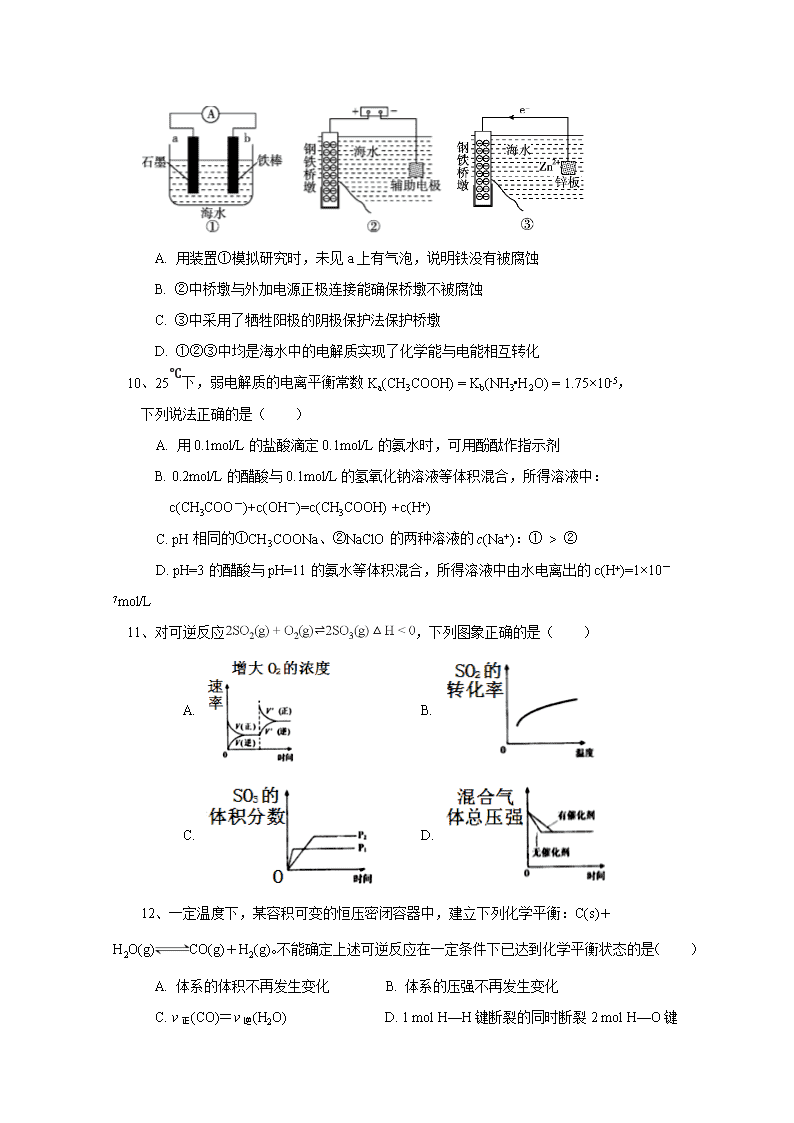
9、研究金属桥墩腐蚀及防护是跨海建桥的重要课题。下列有关判断中正确的是( )
A. 用装置①模拟研究时,未见a上有气泡,说明铁没有被腐蚀
B. ②中桥墩与外加电源正极连接能确保桥墩不被腐蚀
C. ③中采用了牺牲阳极的阴极保护法保护桥墩
D. ①②③中均是海水中的电解质实现了化学能与电能相互转化
10、25℃下,弱电解质的电离平衡常数Ka(CH3COOH) = Kb(NH3•H2O) = 1.75×10-5,
下列说法正确的是( )
A. 用0.1mol/L的盐酸滴定0.1mol/L的氨水时,可用酚酞作指示剂
B. 0.2mol/L的醋酸与0.1mol/L的氢氧化钠溶液等体积混合,所得溶液中:
c(CH3COO-)+c(OH-)=c(CH3COOH) +c(H+)
C. pH相同的①CH3COONa、②NaClO的两种溶液的c(Na+):① > ②
D. pH=3的醋酸与pH=11的氨水等体积混合,所得溶液中由水电离出的c(H+)=1×10-7mol/L
11、对可逆反应,下列图象正确的是( )
A. B.
C. D.
12、一定温度下,某容积可变的恒压密闭容器中,建立下列化学平衡:C(s)+H2O(g)CO(g)+H2(g)。不能确定上述可逆反应在一定条件下已达到化学平衡状态的是( )
A. 体系的体积不再发生变化 B. 体系的压强不再发生变化
C. v正(CO)=v逆(H2O) D. 1 mol H—H键断裂的同时断裂2 mol H—O键
13、一定温度下,在3个体积均为1.0 L的恒容密闭容器中反应2H2(g)+CO(g)CH3OH(g)达到平衡,下列说法正确的是( )
容器
温度/K
物质的起始浓度/mol•L−1
物质的平衡浓度/mol•L−1
c(H2)
c(CO)
c(CH3OH)
c(CH3OH)
Ⅰ
400
0.20
0.10
0
0.080
Ⅱ
400
0.40
0.20
0
Ⅲ
500
0
0
0.10
0.025
A. 该反应的正反应吸热
B. 达到平衡时,容器I中反应物转化率比容器Ⅱ中的大
C. 达到平衡时,容器Ⅱ中c(H2)小于容器Ⅲ中的两倍
D. 达到平衡时,容器Ⅲ中的正反应速率比容器I中的小
14、下列说法正确的是( )
A. 0.1 mol·L-1 Na2CO3溶液中:c(HCO3-)+c(H2CO3)+2c(CO32-) = c(Na+)
B. 物质的量浓度相等的Na2SO3和NaHSO3溶液中:3c(Na+)=2[c(SO32—) + c(HSO3-)+ c(H2SO3) ]
C. 同浓度的下列溶液中,① NH4HSO4 ② NH4Cl ③ NH3·H2O,c(NH4+)由大到小的顺序是:②>①>③
D. 常温下,浓度均为0.1mol/L NaCN和HCN溶液中pH=9,
则c(HCN)>c(Na+)> c(CN-)> c(OH-)> c(H+)
15、已知pAg+=−lgc(Ag+),pX−=−lgc(X−)。某温度下,AgBr、AgCl在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
A. Ksp(AgBr)=1.0×10-14 mol2·L-2
B. 向饱和AgCl溶液中加入NaCl固体,可使a点变到d点
C. 一定温度下,AgCl固体分别在下列溶液①10mL0.01mol·L-1KCl溶液 ②10mL蒸馏水③40mL0.03mol·L-1HCl溶液中的溶解度由大到小的排列顺序是②>①>③
D. 常温下,AgCl在纯水中的Ksp比在AgNO3溶液中的Ksp大
第II卷(非选择题,共40分)
16. (20分)金属单质及其化合物在生活、生产中有广泛应用,回答下列问题:
(1)火法炼锌,是在鼓风炉中加热到1 100 ~ 1 300 ℃,发生反应Ⅰ:
ZnO(s)+CO(g)Zn(g)+CO2(g) ΔH=+198 mol•L-1。
①该反应的平衡常数表达式K=_________________。
②温度为T1时,反应Ⅰ的平衡常数为K1,则同温下反应Ⅱ:
ZnO(s)+CO(g) Zn(g)+CO2(g)的平衡常数K2=____________(用K1表示)。
③某温度时反应Ⅰ的平衡常数K=1.0 mol•L-1,起始时在容积固定的密闭鼓风炉中通入0.11 mol•L-1 CO(ZnO足量),达平衡时,CO的浓度为_____________mol•L-1 。
(2) 由CuCl2溶液制备无水CuCl2 ,请回答相关问题:
①CuCl2水溶液呈 性 ,原因是(用离子方程式表示):______ ___
把CuCl2溶液蒸干,灼烧,最后得到的主要固体产物是 。
②某酸性CuCl2溶液中含有少量的FeCl3,为了除掉FeCl3杂质,需要加入____________,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=________ mol•L-1。(已知25℃,Ksp[Fe(OH)3]=4.0×10-38)
(3)以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN),发生反应
Al2O3(s)+3C(s)+N2(g)= 2AlN(s)+3CO(g) ΔH=+1 026 kJ·mol-1
一定温度下,在压强为p的反应体系中,平衡时CO的物质的量浓度为c;若温度不变,反应体系的压强减小为0. 5p,则平衡时CO的物质的量浓度__________。
A.小于0.5c B.大于0.5c,小于c C.等于c D.大于c
17.(20分)某甲烷燃料电池工作时的装置如图所示,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少。请回答下列问题:
(1)铁电极为乙池中_____电极(填“M”或“N”);其对应的电极反应式为______________;通入甲烷的铂电极的电极反应式为___________________________________________。
(2)在此过程中,乙池中某一电极析出金属银4.32g时,乙池中总反应(离子方程式):______ _ _____。甲池中理论上消耗氧气_______L(标准状况下);
(3)若用乙池进行粗铜精炼,①粗铜为乙池中_____电极(填“M”或“N”)
②有关粗铜精炼的描述,正确的是___________
A. 精炼过程中,硫酸铜的浓度不变
B. 杂质都将以单质形式沉积到池底
C. 纯铜增重2.56 g,电路中通过电子为0.08 mol
③粗铜精炼结束后的废电解液中常含有Zn2+、Pb2+,向废电解液中加入Na2S溶液,当有PbS和ZnS沉淀时,=________________(已知:Ksp(PbS)=3.4×,Ksp(ZnS)=1.6×) 。
牡一中2017级高二学年假期检测 答案
化 学 试 题
第I卷(选择题,共60分)
一、(每小题只有一个选项符合题意,每题4分,共15小题,计60分)
1
2
3
4
5
6
7
8
9
10
A
A
A
C
C
B
B
B
C
C
11
12
13
14
15
A
B
C
D
D
二、非选择题(40分)
16.(20分)
(1)①c(Zn)·c(CO2)/c(CO)。(2分)
②(2分)
③0.01 (3分)
(2)①酸(2分)Cu2++2H2OCu (OH)2+2H+ (2分) CuO (2分) ② CuO或Cu(OH)2或CuCO3或Cu2(OH)2CO3 (2分) 4.0×10-8 (3分)
(3) B(2分)
17.(20分)
(1) M (2分) Ag+ + e-= Ag (2分)
CH4-8e-+10OH-=CO32—+7H2O (3分)
(2)4Ag++2H2O ==电解 == 4Ag+O2↑+4H+ (3分),0.224 (3分)
(3)N (2分) C (2分) 4.7×10-3(3分)