- 399.50 KB
- 2024-02-04 发布
2017-2018学年安徽省临泉县第一中学高二12月阶段考(第三次月考)
化学
考试时间:90分钟;总分:100分 命题:宋傅;审题:曹现锋
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息;2.请将答案正确填写在答题卡上。
可能用到的元素相对原子质量:H 1 Li 3 Be 4 C 12 N 14 O 16 F19 Si 28 Na 23 K 39 Ca 40 Fe 56 Cu 64
一、选择题(本题共16小题,每小题3分,共48分,每小题只有一个最佳选项)
1.下列有关生活生产中的叙述合理的是
A.打开啤酒瓶的瓶盖,有大量的气泡冒出来,该现象不能用勒夏特列原理解释
B.硫酸工业中SO2转化为SO3时采用常压,是因为增大压强不会提高SO2的转化率
C.工业上合成氨采用500 ℃左右的温度,最主要原因是该反应的催化剂在500 ℃左右时活性最好
D.氯碱工业中用离子交换膜电解槽电解时,往阴极室注入经过精制的饱和NaCl溶液,往阳极室注入稀氢氧化钠溶液(或去离子水)
2.下列物质属于电解质且又能导电的是
A.金属铜 B.液态的氯化氢 C.溶液 D.熔融的
3.①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池。①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少。据此判断这四种金属活泼性由大到小的顺序是
A.①③④② B.①②④③ C.③④②① D.③①②④
4.下列实验事实不能证明醋酸是弱酸的是
A.常温下,测得醋酸钠溶液的pH>7
B.常温下,将pH=1的醋酸溶液稀释1 000倍,测得pH<4
C.常温下,将物质的量浓度相同的醋酸溶液与氢氧化钠溶液等体积混合后恰好中和
D.常温下,测得0.1 mol/L醋酸溶液的pH=4
5.下列有关化学用语能确定为丙烯的是
A. B.C3H6 C.H:错误!未找到引用源。::错误!未找到引用源。:错误!未找到引用源。:H D.CH2=CH—CH3
6.室温下由水电离产生的c(H+)=10-13 mol·L-1的溶液中,一定能大量共存的离子组是
A.NH、Ba2+、Cl-、NO B.Cl-、、Na+、K+
C.Na+、K+、ClO-、OH- D.SO、NO、Fe2+、Mg2+
7.已知某可逆反应mA(g)+nB(g) ⇌ pC(g) ΔH=Q 在密闭容器中进行,如图中表示在不同反应时间T时,温度T和压强p与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析下列判断正确的
A.T1<T2 p1>p2 m+n>p Q<0 B.T1>T2 p1<p2 m+n<p Q>0
C.T1<T2 p1<p2 m+n>p Q>0 D.T1>T2 p1<p2 m+n<p Q<0
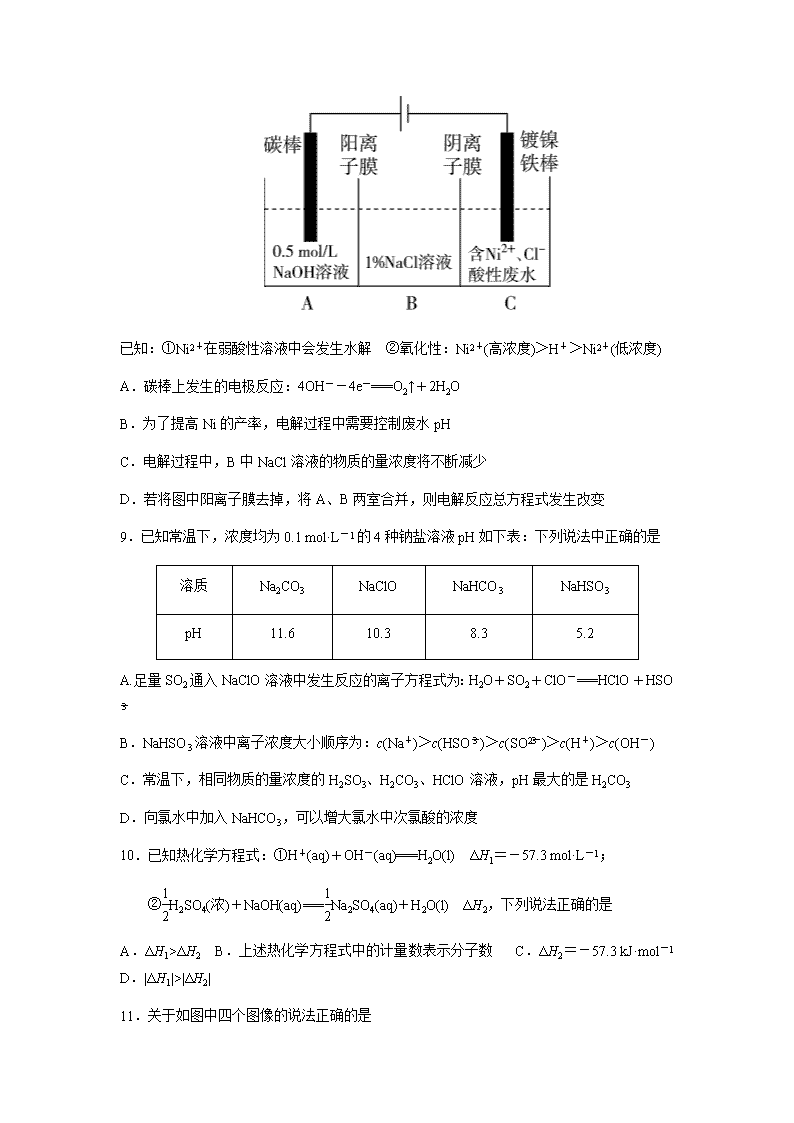
8.工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示,下列说法错误的是
已知:①Ni2+在弱酸性溶液中会发生水解 ②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A.碳棒上发生的电极反应:4OH--4e-===O2↑+2H2O
B.为了提高Ni的产率,电解过程中需要控制废水pH
C.电解过程中,B中NaCl溶液的物质的量浓度将不断减少
D.若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
9.已知常温下,浓度均为0.1 mol·L-1的4种钠盐溶液pH如下表:下列说法中正确的是
溶质
Na2CO3
NaClO
NaHCO3
NaHSO3
pH
11.6
10.3
8.3
5.2
A.足量SO2通入NaClO溶液中发生反应的离子方程式为:H2O+SO2+ClO-===HClO+HSO
B.NaHSO3溶液中离子浓度大小顺序为:c(Na+)>c(HSO)>c(SO)>c(H+)>c(OH-)
C.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO溶液,pH最大的是H2CO3
D.向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度
10.已知热化学方程式:①H+(aq)+OH-(aq)===H2O(l) ΔH1=-57.3 mol·L-1;
②H2SO4(浓)+NaOH(aq)===Na2SO4(aq)+H2O(l) ΔH2,下列说法正确的是
A.ΔH1>ΔH2 B.上述热化学方程式中的计量数表示分子数 C.ΔH2=-57.3 kJ·mol-1 D.|ΔH1|>|ΔH2|
11.关于如图中四个图像的说法正确的是
注:图中,E表示能量,p表示压强,t表示时间,V表示体积。
A.①表示其他条件不变时,反应4A(g)+3B(g) 2C(g)+6D在不同压强下B的体积分数随时间的变化,则D一定是气体
B.②表示化学反应H2(g)+Cl2(g)===2HCl(g)的能量变化,则该反应的反应热ΔH=+183 kJ/mol
C.③表示10 mL 0.1 mol/L Na2CO3和NaHCO3两种溶液中,分别滴加0.1 mol/L盐酸,产生CO2的体积随盐酸体积的变化,则b表示Na2CO3溶液
D.④表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液
12.实验室测定水体中氯离子的含量时常使用AgNO3溶液滴定法,已知在25 ℃时几种银盐的Ksp:
难溶盐
AgCl
AgBr
AgI
Ag2CrO4
Ag2CO3
Ksp
1.8×10-10
5.4×10-13
8.3×10-17
1.9×10-12
8.1×10-12
颜色
白色
淡黄色
黄色
砖红色
白色
可用作滴定Cl-指示剂的是
A.Na2CO3 B.K2CrO4 C.NaBr D.NaI
13. 根据如图回答,下列说法不正确的是
A.燃料电池中正极反应为O2+4e-+4H+===2H2O
B.此装置用于电镀铜时,硫酸铜溶液的浓度不变
C.此装置用于铁表面镀铜时,a为铁
D.若用该装置进行粗铜的精炼,当有1 mol水生成时,可得到64 g精铜
14.某烃的结构简式为,它可能具有的性质是
A.易溶于水,也易溶于有机溶剂
B.它既能使溴水褪色,也能使酸性高锰酸钾溶液褪色
C.它能使溴水褪色,但不能使酸性高锰酸钾溶液褪色
D.它使溴水褪色的原因是因为该烃与溴水中的发生了取代反应
15.用标准盐酸滴定未知浓度的NaOH溶液,下列操作不会引起实验误差的是
A.用碱式滴定管取10.00 mL NaOH溶液放入用蒸馏水洗净的锥形瓶中,加入少量的蒸馏水再进行滴定
B.用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,后装入NaOH溶液进行滴定
C.用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定
D.用酚酞作指示剂滴至红色刚变无色时即停止加盐酸
16.已知2SO2 (g)+O2 (g) 2SO3(g) ΔH=-197 kJ·mol-1。t ℃时,在一定条件下,将2 mol SO2和1 mol O2分别置于恒容和恒压的两个密闭容器中,达到平衡状态时分别反应放出的热量为Q1、Q2,下列关于Q1、Q2的关系判断正确的是
A.Q1=Q2 B.Q1>Q2 C.Q1<Q2 D.无法判断
二、填空题(本题包括5小题,共52分)
17.按要求回答下列问题:
(1)反应Cl2+H2OH++Cl-+HClO其化学平衡常数K的表达式为:_____________
(2)常温下,向一定体积的0.1 mol·L-1醋酸溶液中加水稀释后,下列说法正确的是__________
A.溶液中导电粒子的数目减少 B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中不变 D.溶液中减小
(3)硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为:H2SO4=H++HSO4-,HSO4-⇌H++SO42-。请回答下列有关问题:
①Na2SO4溶液呈______(填“弱酸性”、“ “中性”或“弱碱性”),其理由是___________________(用离子方程式表示);
②H2SO4溶液与BaCl2溶液反应的离子方程式为:______________________________;
③在0.10mol/L的Na2SO4溶液中,下列离子浓度关系正确的是_______(填写编号);
A.c(SO42-)+c(HSO4-)+c(H2SO4)=0.1mol/L
B.c(OH-)=c(H+)+c(HSO4-)
C.c(Na+)+c(H+)=c(OH-)+c(HSO4-)+2c(SO42-)
D.c(Na+)>c(SO42-)>c(OH-)>c(HSO4-)>c(H+)
18.下图是一个电化学过程的示意图。
Ⅰ.在甲池中,A端通入甲烷,B端通入氧气。丙池溶液在装置工作过程中质量减少了9g。请回答下列问题:
(1)此时A端为_______极(填“正”或“负”),A极的电极反应式为______________________________。
(2)若乙池溶液的体积为1 L,则此时乙池溶液中=________(不考虑Ag+的水解)。
(3)丙池中产生的气体体积为________L(标准状况下)。
Ⅱ.制取KMnO4的最好方法是电解K2MnO4,若此时把丙池中阳极材料换成铂极,阴极材料换为铁板,硫酸钠溶液换成K2MnO4溶液,则可制取KMnO4。
(4)阳极的电极反应式为__________________________________。此时溶液中pH________(填“变大”“变小”或“不变”)。
19.汽车在现代生活中扮演着越来越重要的角色,但其尾气(碳氢化合物、氮氧化物及一氧化碳等)带来的环境污染越来越明显,机动车废气排放已成为城市大气污染的重要来源。
(1)在汽车尾气系统中安装催化转换器,可有效减少尾气中的CO、NOx和碳氢化合物等废气,
已知:①N2(g)+O2(g)===2NO(g)ΔH1=+180 kJ/mol,
②CO(g)+O2(g)===CO2(g) ΔH2=-283 kJ/mol,
③2NO(g)+2CO(g)===2CO2(g)+N2(g) ΔH3,则ΔH3=________ kJ·mol-1
(2)气缸中生成NO的反应为:N2(g)+O2(g)===2NO(g)ΔH>0,汽车启动后,气缸内温度越高,单位时间内NO排放量越大,原因是_______________________________________________。
(3) 25 ℃时,向0.18 mol·L-1的MgCl2
溶液中,逐滴加入浓NaOH溶液,刚好出现沉淀时,溶液的pH为________;当Mg2+刚好完全沉淀时,溶液中的为_______________________ (假定溶液体积不变化,已知Ksp[Mg(OH)2]=1.8×10-11,=1.34,离子浓度1 mol·L-1时认为离子沉淀完全)。
(4)NH4HSO4在分析试剂、医药、电子工业中用途非常广泛,现向100 mL 0.1 mol·L-1 NH4HSO4溶液中逐滴滴加0.1 mol·L-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示.试分析图中a-e 5个点,回答下列问题:
①在c点,溶液中各离子浓度由大到小的排列顺序是_________。
②水的电离程度最大的是________点;
20.氧化还原滴定实验与中和滴定原理相似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液,或反之),现用0.1 mol·L-1酸性KMnO4溶液(标准液)滴定未知浓度的H2O2水溶液(待测液),反应离子方程式是:
2MnO+5H2O2+6H+===2Mn2++5O2↑+8H2O,请回答下列问题:
(1)该滴定实验一定不需要用到的仪器有下列中的________(填字母)。
A.酸式滴定管(50 mL) B.碱式滴定管(50 mL)C.白纸 D.锥形瓶 E.铁架台 F.滴定管夹G.量筒 (10 mL)
(2)滴定时是否需要添加指示剂________,理由______________。
(3)实验中取H2O2溶液10.00 mL,滴定前后滴定管液面刻度分别为1.00mL和21.00mL,则H2O2浓度为________。
21.如图是石蜡油在炽热碎瓷片的作用下产生C2H4,并检验C2H4性质的实验,完成下列各题。
(1)B中溶液褪色,原因是 。
(2)C中反应的化学方程式为 。
(3)在D处点燃时必须进行的操作是 ,
D处反应的化学方程式为 。
临泉一中2017-2018年度高二上学期阶段考试-化学答案
1-5 CDACD 6-10 BBCDA 11-15DBCBA 16 C (每小题3分,共48分)
非选择题每空2分,共52分。
17. (1) (2) CD (漏选扣1分,错选不得分)
(3)①弱碱性 ⇌
② ③ BCD(漏选扣1分,错选不得分)
18. (1 ) 负 (2) 0
(3) 16.8 (4) 增大
19.(1) -746 (2)温度升高,化学反应速率加快,而且平衡右移
(3)9 molL
(4)①c(Na+)>c(SO)>c(NH)>c(OH-)=c(H+) ② b
20. (1) BG(漏选扣1分,错选不得分)
(2) 不需要 因为滴定终点时,溶液由无色变为紫红色
(3) 0.5 molL
21. (1)酸性高锰酸钾溶液被乙烯还原
(2) CH2=CH2+Br2→CH2BrCH2Br
(3)验纯 C2H4+3O22CO2+2H2O