- 577.44 KB
- 2024-01-20 发布
- 1、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 2、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报QQ:3215808601
2020届新课标Ⅰ卷冲刺高考考前预热卷(七)
化学试题卷
考生注意:
1.本卷共100分,考试时间50分钟。
2. 答卷前,考生务必将自己的姓名、考生号、考场号和座位号填写在答题卡上。
3. 不得在本卷上答题,请将答案填写在答题卡指定区域。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 P 31 S 32 Cl 35.5 Cu 64 Zn 65
一、选择题:本大题共7小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题目要求的。
7.化学与生产、生活息息相关。下列说法错误的是( )。
A.秸秆的大量焚烧将产生雾霾
B.由地沟油炼制的生物柴油属于烃类
C.“山东疫苗案”涉及的疫苗,因未冷藏储运而失效,这与蛋白质变性有关
D.建设港珠澳大桥时采用超高分子量聚乙烯(UHMWPE)纤维吊绳,UHMWPE属于有机高分子化合物
8.下列说法不正确的是( )。
A.疫苗一般应冷藏存放,目的是避免蛋白质变性
B.宣纸、棉衬衣和草帽的主要成分均为纤维素
C.食用油反复加热会产生稠环芳香烃等有害物质
D.高分子材料塑料、橡胶、合成纤维均难以自然降解
9.设NA为阿伏加德罗常数的值。下列有关叙述不正确的是( )。
A.在电解精炼铜的过程中,当阴极析出32 g铜时,转移的电子数为NA
B.将1 mol CH4与1 mol Cl2混合光照,充分反应后,生成气体的分子数为NA
C.9.2 g甲苯被酸性KMnO4氧化生成苯甲酸时,反应中转移的电子数为0.6NA
D.0.1 mL O2 完全反应时,转移的电子数不一定为0.4NA
10.短周期主族元素a、b、c、d的原子序数依次增大,a原子核外电子总数与b原子次外层的电子数相同;c是自然界中含量最高的金属元素;d与a同族。下列叙述正确的是( )。
A.简单离子半径大小:d>a>b>c
B.da2可使蓝色石蕊试液先变红后褪色
C.c的氧化物对应的水化物是强碱
D.d单质的氧化性比a单质的氧化性强
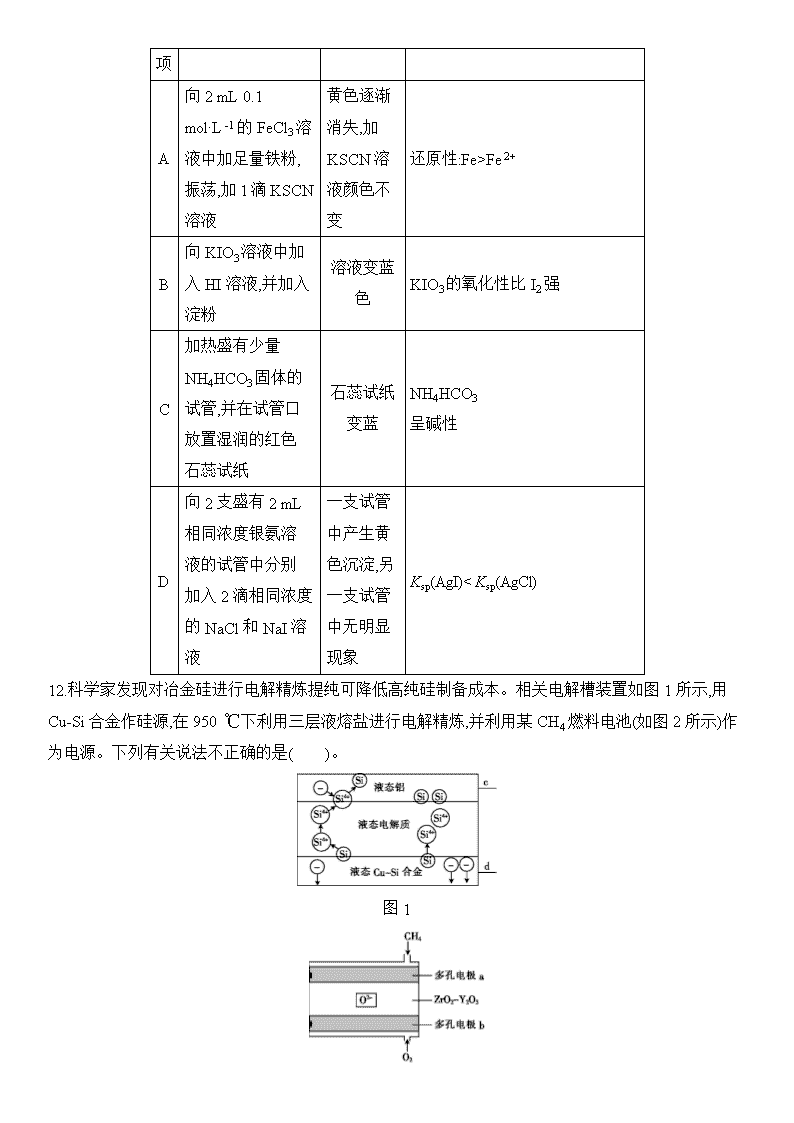
11.由下列实验及现象不能推出相应结论的是( )。
选
实验
现象
结论
项
A
向2 mL 0.1 mol·L-1的FeCl3溶液中加足量铁粉,振荡,加1滴KSCN溶液
黄色逐渐消失,加KSCN溶液颜色不变
还原性:Fe>Fe2+
B
向KIO3溶液中加入HI溶液,并加入淀粉
溶液变蓝色
KIO3的氧化性比I2强
C
加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸
石蕊试纸变蓝
NH4HCO3
呈碱性
D
向2支盛有2 mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液
一支试管中产生黄色沉淀,另一支试管中无明显现象
Ksp(AgI)c(Na+)>c(NO2-)
二、非选择题:包括必考题和选考题两部分。第26~28题为必考题,每道题考生都必须作答。第35、36题为选考题,考生根据要求作答。
(一)必考题:共43分。
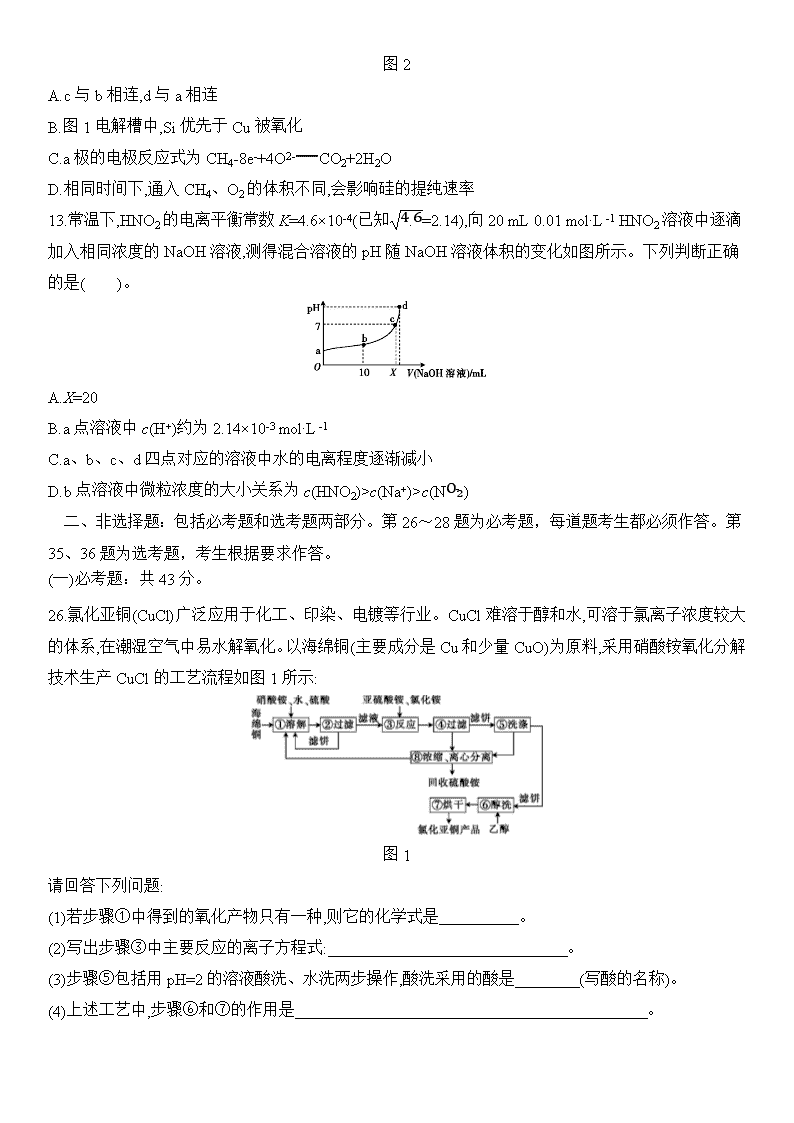
26.氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺流程如图1所示:
图1
请回答下列问题:
(1)若步骤①中得到的氧化产物只有一种,则它的化学式是 。
(2)写出步骤③中主要反应的离子方程式: 。
(3)步骤⑤包括用pH=2的溶液酸洗、水洗两步操作,酸洗采用的酸是 (写酸的名称)。
(4)上述工艺中,步骤⑥和⑦的作用是 。
(5)氯化亚铜产率与温度、溶液pH的关系如图2所示。据图分析,流程化生产氯化亚铜的过程中,温度过低影响CuCl产率的原因是 ;温度过高、pH过大也会影响CuCl产率的原因是 。
图2
27.氨气和氯气是重要的工业原料,某兴趣小组设计了相关实验探究它们的某些性质。
[实验1]认识喷泉实验的原理,并测定电离平衡常数K(NH3·H2O)。
(1)能使图1中装置Ⅱ产生喷泉的实验操作是 。
(2)喷泉实验结束后,发现三颈烧瓶中未充满水(假如装置的气密性良好),原因是 。用 (填仪器名称)量取25.00 mL喷泉实验后的氨水至锥形瓶中,用0.0500 mol·L-1的盐酸测定氨水的浓度,滴定曲线如图2所示(已知a、b、c三点中有一点表示两者恰好中和)。下列关于该滴定实验的说法正确的是 (填字母)。
A.可选择甲基橙作指示剂
B.b点时,氨水与盐酸恰好中和
C.酸式滴定管未用盐酸润洗会导致测定结果偏低
D.当pH=11.0时,K(NH3·H2O)约为2.2×10-5
[实验2]拟用图3装置设计实验来探究纯净、干燥的氯气与氨气的反应。
(3)A中发生反应的化学方程式为 。
(4)上图中的装置连接顺序为① ;② ;③ 。(用大写字母表示)
若按照正确顺序连接实验装置,则整套实验装置存在的主要缺点是 。
(5)写出装置F中的反应的一种工业用途: 。
(6)反应完成后,装置F中底部有固体物质生成。请利用该固体物质设计一个实验方案证明NH3·H2O为弱碱(实验用品自选): 。
28.研究处理NOx、SO2,对环境保护有着重要的意义。回答下列问题:
(1)SO2的排放主要来自煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。已知吸收过程中相关反应的热化学方程式如下:
①SO2(g)+NH3·H2O(aq)NH4HSO3(aq) ΔH1=a kJ·mol-1;
②NH3·H2O(aq)+NH4HSO3(aq)(NH4)2SO3(aq)+H2O(l) ΔH2=b kJ·mol-1;
③2(NH4)2SO3(aq)+O2(g)2(NH4)2SO4(aq) ΔH3=c kJ·mol-1。
则反应 2SO2(g)+4NH3·H2O(aq)+O2(g)2(NH4)2SO4(aq)+2H2O(l) ΔH= 。
(2)NOx的排放主要来自汽车尾气,有人利用反应C(s)+2NO(g)N2(g) + CO2(g) ΔH=-34.0 kJ·mol-1,用活性炭对NO进行吸附。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,测得NO的转化率 α(NO)随温度的变化如图所示:
①由图可知,1050 K前反应中NO的转化率随温度升高而增大,原因是 ; 在1100 K 达平衡时,CO2的体积分数为 。
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050 K达平衡时,容器内压强为1.1×106 Pa,该反应的化学平衡常数Kp= (已知:气体分压=气体总压×体积分数)。
(3)在高效催化剂的作用下用CH4还原NO2,也可消除氮氧化物的污染。在相同条件下,选用A、B、C三种不同催化剂进行反应,生成 N2的物质的量与时间变化关系如图所示,其中活化能最小的是 (填字母)。
(4)在汽车尾气的净化装置中 CO和NO发生反应:2NO(g) + 2CO(g)N2(g) + 2CO2(g) ΔH2=-746.8 kJ·mol-1。实验测得,v正=k正·c2(NO)·c2(CO) ,v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数 (填“>”“< ”或“=”) k逆增大的倍数。
②若在1 L 的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡,CO的转化率为40%,则k正k逆= (保留2位有效数字)。
(二)选考题:共15分。请考生从给出的2道化学题中任选一题作答。如果多做,则按第一题计分。
35.[化学——选修3:物质结构与性质](15分)
Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)下列Li原子电子排布图表示基态原子的是 (填字母)。
A.
B.
C.
D.
(2)LiH熔点近700 ℃,LiH的晶体类型为 ;LiH极易潮解,潮解的化学方程式为 。
(3)LiFePO4是锂离子电池的电极材料,LiFePO4中的阴离子空间构型是 ,中心原子的杂化类型为 。LiFePO4中存在 (填字母)。
A.离子键 B.σ键 C.π键 D.金属键
(4)Li2O具有反萤石结构,晶胞如图(b)所示。已知Li2O的密度为a g·cm-3,阿伏加德罗常数的值为NA,则晶胞参数为 cm(列出计算式)。
图(b)
36.[化学——选修5:有机化学基础](15分)
具有抗菌作用的白头翁素衍生物M的合成路线如图所示:
已知:ⅰ.RCH2BrR—HCCH—R'
ⅱ.R—HCCH—R'
ⅲ.R—HCCH—R'
(以上R、R'、R″代表氢原子、烷基或芳香基等)
(1)C中官能团名称为 ,B的化学名称为 。
(2)F的结构简式为 ,则与F具有相同官能团的同分异构体共 种(考虑顺反异构,不包含F)。
(3)由G生成H的化学方程式为 ,反应类型为 。
(4)下列说法正确的是 (填字母)。
a.由H生成M的反应是加成反应
b.可用硝酸银溶液鉴别B、C两种物质
c.1 mol E最多可以与4 mol H2发生加成反应
d.1 mol M与足量NaOH溶液反应,消耗4 mol NaOH
(5)以乙烯为起始原料,结合已知信息选用必要的无机试剂,写出合成CH3CHCHCH3的路线: 。
参考答案
7
8
9
10
11
12
13
B
D
B
A
C
A
B
26. (1)CuSO4
(2)2Cu2++SO32-+2Cl-+H2O2CuCl↓+SO42-+2H+
(3)硫酸
(4)使CuCl干燥,防止其水解氧化
(5)温度过低反应速率慢 温度过高、pH过大,容易向CuO和Cu2O转化,且温度过高,铵盐(氯化铵、亚硫酸铵)易受热分解(合理即可)
27. (1)在三颈烧瓶中收集满氨气,关闭止水夹a,打开止水夹b,用热毛巾敷在三颈烧瓶底部
(2)氨气中混有空气(或其他合理答案) 碱式滴定管 AD
(3)2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O
(4)D E C 无尾气处理装置
(5)用氨气检验氯气管道是否漏气
(6)取装置F中的固体物质溶于水配成溶液,测定溶液的pH,若pH<7,则可证明NH3·H2O为弱碱(或其他合理答案)
28. (1)(2a+2b+c) kJ·mol-1
(2)①1050 K前反应未达到平衡状态,随着温度升高,反应速率加快,NO转化率增大 20% ②4
(3)A
(4)①< ②0.25
35.答案 (1)D
(2)离子晶体 LiH+H2OLiOH+H2↑
(3)正四面体形 sp3 ABC
(4)3120a·NA
36. (1)溴原子、羧基 邻甲基苯甲酸(或2-甲基苯甲酸)
(2) 5
(3)+NaOH+NaI+H2O 消去反应
(4)ac
(5)