- 120.50 KB
- 2024-01-11 发布
1
铝铁等金属的化学性质
学
习
目
标
1、掌握铝、铁等金属的主要性质。
2、知道铝的两性,能描述铝与酸、碱反应的实验现象,并会书写反应的化学方程式。
3、了解铝铁等金属在自然界中的存在形态及用途。
重
点
金属铝、铁的化学性质
难
点
金属铝的化学性质
学
法
指
导
通过对铝、铁性质的学习,及与金属钠性质的对比,明确金属的还原性不同,与
同一物质反应时的现象及反应产物也不同。而且并非所有金属都只能与酸反应。会分
析发生反应的内在原因,以提高自身观察能力和分析问题的能力。通过经历实验探究
和问题讨论的过程,了解实验研究化学物质的一般方法。
自
学
引
导
︵
学
生
课
前
必
须
完
成
︶
一、自主学习:(请同学们认真阅读课本 48-51 页,你一定能完成下列表格。能用化
学方程式表示的用化学方程式表示)
金属
化学性质
钠 镁 铝 铁
与 O2 反应
与水反应
与酸反应
与碱反应
与盐反应
金属活泼
性
金属活泼性逐渐( )
还原性逐渐 ( )
二、自主练习:(通过自学,相信自己能解决下列问题)
1.将铁片分别放入下列溶液中,充分反应后溶液的质量(不包括固体)比反应前减
2
轻的是: ( )
A 硫酸铜溶液 B 稀硫酸 C 氢氧化钠溶液 D 氯化钠溶液
2.下列说法正确的是:( )
A.常温下,镁铝表面能生成一层致密的氧化膜,保护内层的金属不被继续氧化
B.未打磨的铝箔因表面有氧化膜,因此在空气中加热后不能燃烧,若将氧化
膜去
除后再加热,则可在空气中燃烧
C.在化学反应中,由于铝原子能失去三个电子,而钠原子只能失去一个电子,
所
以铝的还原性比钠强
D.因铜是不活泼金属,故即使在潮湿的空气中也不会被腐蚀。
3.下列有关厨房铝制品的使用中,你认为合理的是 ( )
A.盛放食醋 B.烧开水 C.用金属丝擦洗表面的污垢 D.用碱水洗涤
三、你还有哪些不会的问题,请提出来让老师和同学帮你解决
独
立
思
考
合
作
探
究
探究 1 在点燃镁条前,常用砂纸打磨,这样点起来更容易。铝的情况是这样吗?
为什么?
发散思维:活泼金属在空气中易与 反应,表面生成一层氧化膜。有的氧化
膜 ,不能保护内层金属,如铁表面的 ,主要成分为 ;而
有的氧化膜 ,可以保护内层金属不被继续氧化,如镁、铝等。并且除此之
外,它们还能被 、 等具有 性的物质所氧化。因为这些金属
元素原子最外层电子 ,单质往往表现出 性。
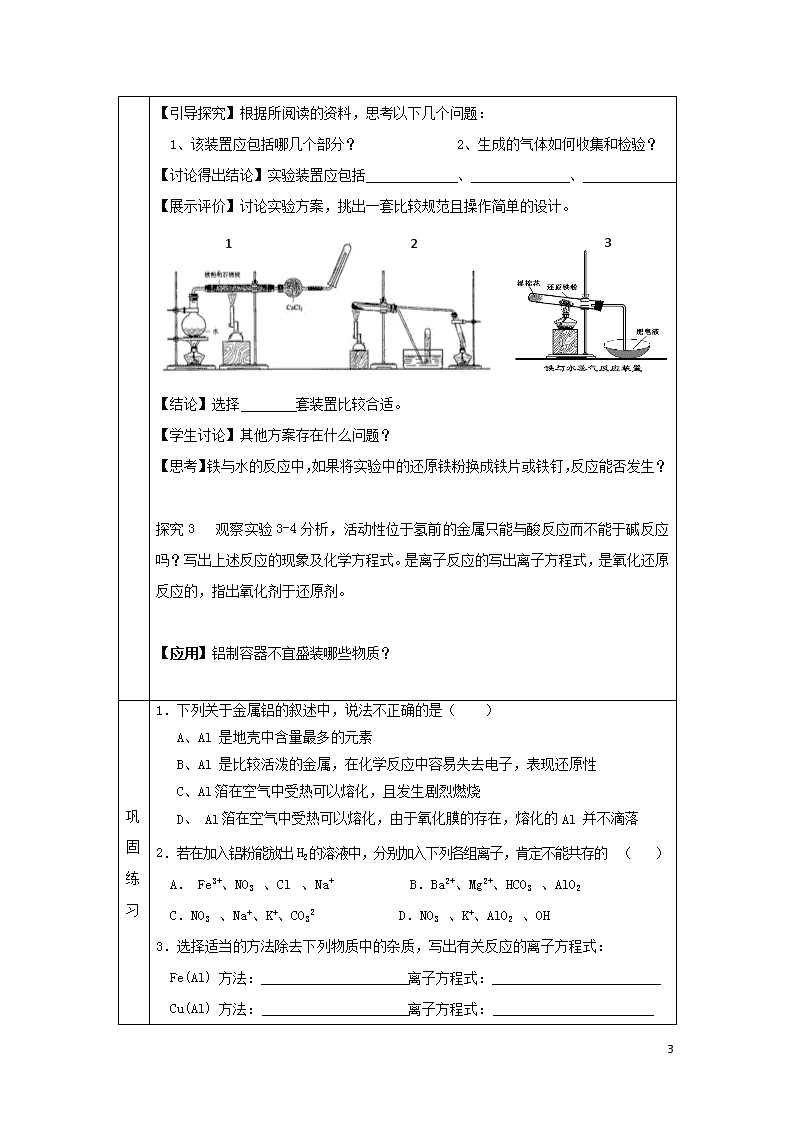
探究 2 铁不能于冷、热水反应,但能否与水蒸气反应呢?试设计实验进行验证。
【活动用品】3 支试管、水槽、蒸发皿、胶塞、导管、酒精喷灯等
【活动内容】设计实验装置,使还原铁粉与水蒸气反应。
3
【引导探究】根据所阅读的资料,思考以下几个问题:
1、该装置应包括哪几个部分? 2、生成的气体如何收集和检验?
【讨论得出结论】实验装置应包括 、 、 。
【展示评价】讨论实验方案,挑出一套比较规范且操作简单的设计。
【结论】选择 套装置比较合适。
【学生讨论】其他方案存在什么问题?
【思考】铁与水的反应中,如果将实验中的还原铁粉换成铁片或铁钉,反应能否发生?
探究 3 观察实验 3-4 分析,活动性位于氢前的金属只能与酸反应而不能于碱反应
吗?写出上述反应的现象及化学方程式。是离子反应的写出离子方程式,是氧化还原
反应的,指出氧化剂于还原剂。
【应用】铝制容器不宜盛装哪些物质?
巩
固
练
习
1.下列关于金属铝的叙述中,说法不正确的是( )
A、Al 是地壳中含量最多的元素
B、Al 是比较活泼的金属,在化学反应中容易失去电子,表现还原性
C、Al 箔在空气中受热可以熔化,且发生剧烈燃烧
D、 Al 箔在空气中受热可以熔化,由于氧化膜的存在,熔化的 Al 并不滴落
2.若在加入铝粉能放出 H2 的溶液中,分别加入下列各组离子,肯定不能共存的 ( )
A. Fe3+、NO3、Cl、Na+ B.Ba2+、Mg2+、HCO3、AlO2
C.NO3、Na+、K+、CO32 D.NO3、K+、AlO2、OH
3.选择适当的方法除去下列物质中的杂质,写出有关反应的离子方程式:
Fe(Al) 方法: 离子方程式:
Cu(Al) 方法: 离子方程式:
1 2 3
4
4.已知铝既能与酸反应产生氢气,又能与碱溶液反应产生氢气,若取等质量的铝粉
分别与足量的稀盐酸和 NaOH 溶液反应,所得氢气的体积在同样条件下相比( )
A.与酸反应产生氢气多 B.与碱反应产生氢气多
C.一样多 D.不知道铝粉的质量,无法比较
5.用铝箔包装 0.1 mol 金属钠,用针扎出一些小孔,放入水中,完全反应后,用排
水集气法收集产生的气体,则收集的气体为(标准状况下)( )
A.O2 和 H2 的混合气体 B.1.2 L H2 C.大于 1.12 LH2 D.小于 1.12 L 气体
学
习
体
会
达
标
测
试
1.某无色溶液能与铝反应放出氢气,该溶液中肯定不能大量共存的离子组是( )
A.Cl-、Mg2+、K+、SO42- B.NH4+、Cl-、Na+、Ba2+
C.SO42-、Cl-、CO32-、Na+ D.HCO3-、K+、NH4+、SO42-
2.某课外活动小组做如下实验:往一铝制的易拉罐内充满 CO2,然后往罐内注入足量
的 NaOH 溶液,立即用胶布严封罐口,过一段时间后,他们发现罐壁内凹而瘪,再
过一段时间后,瘪了的罐壁重新鼓起。
(1)罐壁内凹而瘪的原因是,反应的化学方程式是 。
(2)罐壁再鼓起的原因是,有关的化学方程式是 。
(3)如果用薄铁金属制易拉罐,做上述实验时,出现的结果是 。
3.下列反应的离子方程式书写正确的是( )
A.钠和冷水反应 Na+2H2O=Na++2OH-+H2↑
B.金属铝溶于氢氧化钠溶液 Al+2OH-=AlO2-+H2↑
C.金属铝溶于盐酸中 2Al+6H+=2Al3++3H2↑
D.铁跟稀硫酸反应 2Fe+6H+=2Fe3++3H2↑
4.某无色透明的溶液,能跟金属铝反应放出氢气。依据反应后铝元素存在的状态,
判断下列离子中哪些在反应前后的溶液里始终可以大量存在?需要做出判断的离
子是:Mg2+、Cu2+、Ba2+、H+、Ag+、SO42-、SO32-、CO32-、OH-、Cl-(已知 Ba 的金属
活泼性大于 Al)
5
(1)当生成 Al3+且有金属铝剩余时,可能存在的离子是 。
(2)当生成 AlO2-且有金属铝剩余时,可能存在的离子是 。
5.结合探究 2 铁于水蒸气反应的实验图 1,回答下列问题:
(1)写出该反应的反应方程式: ;并
指明该氧化还原反应的还原剂是 ,氧化剂是 。
(2)实验前必须对整套装置进行气密性检查,操作方法是 。
(3)圆底烧瓶中盛装的水,该装置受热后的主要作用是 ;
烧瓶底部放置了几片碎瓷片,碎瓷片的作用是 。
(4)酒精灯和酒精喷灯点燃的顺序是 ,
为什么? 。
(5)干燥管中盛装是的物质是 ,作用是 。
(6)试管中收集气体是 ,如果要点燃该气体,则必须对该气体进行 ,
方法是 ,这一操作的目的是