- 278.50 KB
- 2023-12-24 发布
2018-2019学年甘肃省天水一中高二寒假作业检测化学试题
可能用到的相对原子质量 C : 12 O : 16 H : 1 S : 32 Cu : 64
一、选择题(每空3分,共48分)
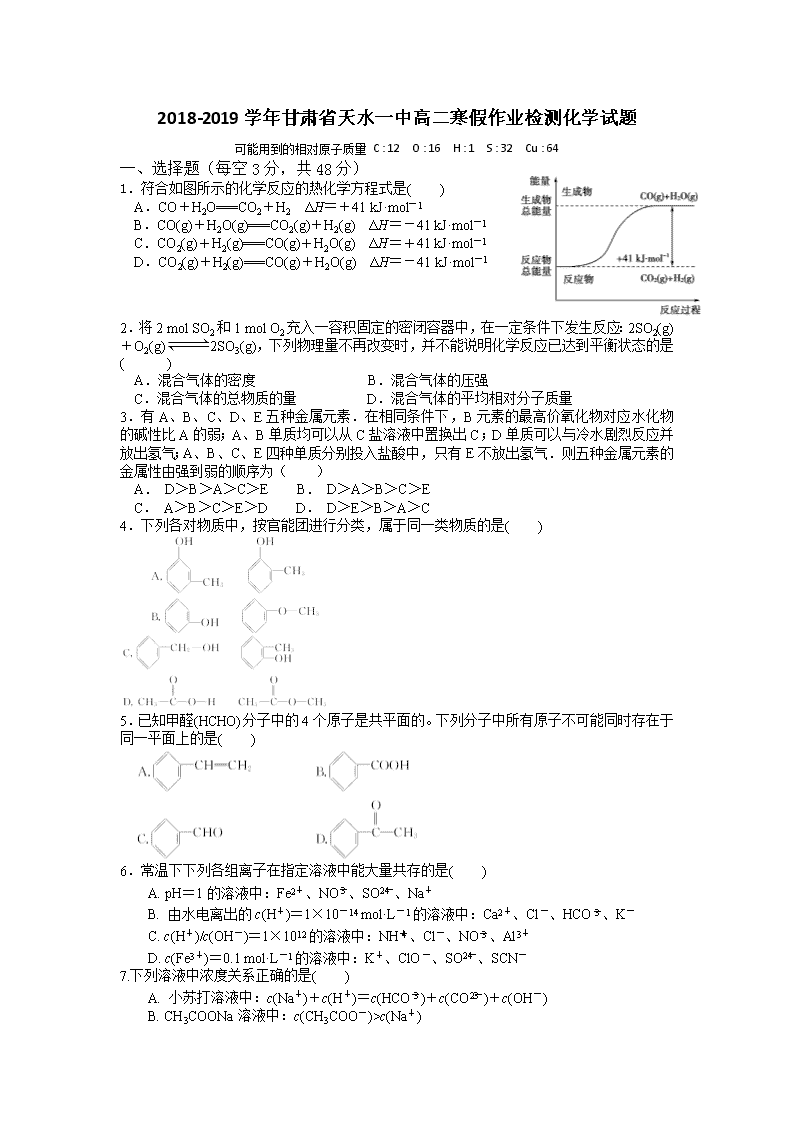
1.符合如图所示的化学反应的热化学方程式是( )
A.CO+H2O===CO2+H2 ΔH=+41 kJ·mol-1
B.CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=-41 kJ·mol-1
C.CO2(g)+H2(g)===CO(g)+H2O(g) ΔH=+41 kJ·mol-1
D.CO2(g)+H2(g)===CO(g)+H2O(g) ΔH=-41 kJ·mol-1
2.将2 mol SO2和1 mol O2充入一容积固定的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g) 2SO3(g),下列物理量不再改变时,并不能说明化学反应已达到平衡状态的是 ( )
A.混合气体的密度 B.混合气体的压强
C.混合气体的总物质的量 D.混合气体的平均相对分子质量
3.有A、B、C、D、E五种金属元素.在相同条件下,B元素的最高价氧化物对应水化物的碱性比A的弱;A、B单质均可以从C盐溶液中置换出C;D单质可以与冷水剧烈反应并放出氢气;A、B、C、E四种单质分别投入盐酸中,只有E不放出氢气.则五种金属元素的金属性由强到弱的顺序为( )
A. D>B>A>C>E B. D>A>B>C>E
C. A>B>C>E>D D. D>E>B>A>C
4.下列各对物质中,按官能团进行分类,属于同一类物质的是( )
5.已知甲醛(HCHO)分子中的4个原子是共平面的。下列分子中所有原子不可能同时存在于同一平面上的是( )
6.常温下下列各组离子在指定溶液中能大量共存的是( )
A. pH=1的溶液中:Fe2+、NO、SO、Na+
B. 由水电离出的c(H+)=1×10-14 mol·L-1的溶液中:Ca2+、Cl-、HCO、K-
C. c(H+)/c(OH-)=1×1012的溶液中:NH、Cl-、NO、Al3+
D. c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO、SCN-
7.下列溶液中浓度关系正确的是( )
A. 小苏打溶液中:c(Na+)+c(H+)=c(HCO)+c(CO)+c(OH-)
B. CH3COONa溶液中:c(CH3COO-)>c(Na+)
C. 物质的量浓度相等的CH3COOH溶液和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
D. 0.1 mol/L的NaHA溶液,其pH=4,则c(HA-)>c(H+)>c(H2A)>c(A2-)
8.在相同的条件下(500 ℃),有相同体积的甲、乙两容器,甲容器充入1 g O2和1 g SO2,乙容器充入2 g O2和2 g SO2。下列叙述中错误的是( )
A.化学反应速率:乙>甲 B.平衡时O2的浓度:乙>甲
C.平衡时SO2的转化率:乙>甲 D.平衡时SO2的体积分数:乙>甲
9.室温时,M(OH)2(s) M2+(aq)+2OH-(aq) Ksp=a,c(M2+)=b mol·L-1时,溶液的pH等于( )
A.lg() B.lg() C.14+lg() D.14+lg()
10.将有机物完全燃烧,生成CO2和H2O,将12 g该有机物完全燃烧产物通过浓硫酸,浓硫酸增重14.4 g,再通过碱石灰,又增重26.4 g。则该有机物的分子式为( )
A.C4H10 B.C2H6O
C.C3H8O D.C2H4O2
11.某温度下,在2 L的密闭容器中,加入1 mol X(g)和2 mol Y(g)发生反应:
X(g)+mY(g) 3Z(g)
平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1 mol Z(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是( )
A.m=2 B.两次平衡的平衡常数相同
C.X与Y的平衡转化率之比为1∶1
D.第二次平衡时,Z的浓度为0.4 mol·L-1
12.一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应为2C2H6+7O2+8KOH=4K2CO3+10H2O,有关此电池的推断正确的是( )
A、负极反应为14H2O+7O2+28e-=28OH-
B、放电一段时间后,负极周围的PH升高
C、每消耗1molC2H6,则电路上转移的电子为14mol
D、放电过程中KOH的物质的量浓度不变
13.某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔材料.下列说法正确的是( )
A. 电极A表面反应之一为NO2-e-+H2O= NO3_+2H+
B. 电极B附近的c(NO3_)增大
C. 电解质溶液中电流的方向由B到A,电子的流向与之相反
D. 该电池工作时,每转移4mol电子,消耗22.4L O2
14.在1 200 ℃时,天然气脱硫工艺中会发生下列反应
H2S(g)+O2(g)===SO2(g)+H2O(g) ΔH1 ①
2H2S(g)+SO2(g)===S2(g)+2H2O(g) ΔH2 ②
H2S(g)+O2(g)===S(g)+H2O(g) ΔH3 ③
2S(g)===S2(g) ΔH4
则ΔH4的正确表达式为( )
A.ΔH4=(ΔH1+ΔH2-3ΔH3) B.ΔH4=(3ΔH3-ΔH1-ΔH2)
C.ΔH4=(ΔH1+ΔH2-2ΔH3) D.ΔH4=(ΔH1-ΔH2-3ΔH3)
15.已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出X kJ热量。已知单质C(s)的燃烧热为Y kJ·mol-1,则1 mol C(s)与O2(g)反应生成CO(g)的反应热ΔH为( )
A.-Y kJ·mol-1 B.-(10X-Y)kJ·mol-1
C.-(5X-0.5Y)kJ·mol-1 D.+(10X-Y)kJ·mol-1
16.在体积为2 L的恒容密闭容器中发生反应xA(g)+yB(g) zC(g),图①表示200 ℃时容器中A、B、C的物质的量随时间的变化,图②表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是 ( )
A.200 ℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B.由图②知反应xA(g)+yB(g) zC(g)的ΔH>0,且a=2
C.若在图①所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆)
D.200 ℃,6 min时向容器中充入2 mol A和1 mol B,重新达到平衡时,A的体积分数大于0.5
二.填空题(共52分)
17.(共12分)某课外活动小组用下图装置进行实验,试回答:
(1)若开始时K接M,则该装置为 (填“原电池”或“电解池”)铁极上的电极反应式为 。
(2)若开始时K接N,则石墨极为______极(填“正”、“负”、“阳” 或“阴”),装置中的总化学方程式为 , 铁极上的现象为 ,石墨电极的反应现象为 ,若反应过程中有0.1mol的电子发生转移,则铁电极上产生物质的质量为____g,石墨极上产生的物质在标准状况下的体积为 L。
18.(共8分)现有下列可逆反应:A(g)+B(g) xC(g),在不同条件下生成物C在反应混合物中的质量分数(C%)和反应时间(t)的关系如下图:
请根据图象回答下列问题:
(1)若甲图中两条曲线分别表示有催化剂和无催化剂的情况,则 __________曲线表示无催化剂时的情况(填字母,下同)。
(2)若乙图表示反应达到平衡后分别在恒温恒压条件下和恒温恒容条件下向平衡混合气体中充入惰性(与反应体系中任一物质均不反应)气体后的情况,则__________曲线表示恒温恒容的情况。
(3)根据丙图可以判断该可逆反应的正反应是________热反应(填“吸”或“放”)。
(4)化学计量数x的值____________(填取值范围);判断的依据是
________________________________________________________________________。
19.(共12分)如图是由4个碳原子结合成的6种有机物(氢原子没有画出)
(1)写出有机物(a)的系统命名法的名称______________。
(2)有机物(a)有一种同分异构体,试写出其结构简式________________________。
(3)上述有机物中与(c)互为同分异构体的是________(填代号)。
(4)任写一种与(e)互为同系物的有机物的结构简式______。
(5)上述有机物中不能与溴反应并使其褪色的有________(填代号)。
(6)(a)(b)(c)(d)四种物质中,4个碳原子一定处于同一平面的有________(填代号)。
20.(共12分) 现有25 ℃时0.1 mol/L的氨水。请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中________(填“增大”“减小”或“不变”);
(2)若向氨水中加入稀硫酸,使其恰好中和,写出反应的离子方程式
________________________________________________________________________;
所得溶液的pH________7(填“>”“<”或“=”),用离子方程式表示其原因
________________________________________________________________________
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH)=a mol/L,则c(SO)=________;
(4)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1∶1,则所得溶液中各离子物质的量浓度由大到小的关系是______________________________________。
21.(共8分)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如下图所示(图中的ΔH表示生成1 mol产物的数据)。
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式是
________________________________________________________________________
(2)PCl5分解成PCl3和Cl2的热化学方程式是
________________________________________________________________________
(3) P和Cl2分两步反应生成1 mol PCl5的ΔH3=________,P和Cl2一步反应生成1 mol PCl5的ΔH4______ΔH3(填“大于”“小于”或“等于”)。
高二级寒假作业检测化学考试题答案
1.选择题
1
2
3
4
5
6
7
8
C
A
B
A
D
C
C
D
9
10
11
12
13
14
15
16
C
C
D
C
A
A
C
B
2.填空题
17. (1) 原电池 Fe -2e- =Fe2+ (2分)
(2) 阳极 CuCl2Cu+Cl2↑ (2分) 有红色固体析出
有气泡产生 3.2 (2分) 1.12 (2分)
18. (1)b (2)a (3)吸 (2分)
(4)大于2(或>2或≥3) (2分) 保持温度不变,增大压强,C%减小,说明平衡向逆反应方向移动,故x>1+1=2 (2分)
19.(1) 2甲基丙烷 (2分) (2) CH3CH2CH2CH3 (2分) (3) b、f (2分)
(4) CHCH(合理即可) (2分) (5) (a)、(f) (2分)(6) (b)、(c)、(d) (2分)
20.(每空2分) (1)减小
(2)NH3·H2O+H+===NH+H2O < NH+H2ONH3·H2O+H+
(3) mol·L-1 (4) c(NH)>c(SO)>c(H+)>c(OH-)
21.(每空2分) (1)Cl2(g)+P(s)===PCl3(g) ΔH=-306 kJ·mol-1
(2)PCl5(g)===PCl3(g)+Cl2(g) ΔH=+93 kJ·mol-1
(3)-399 kJ·mol-1 等于